高糖对人肝星状细胞的激活作用及机制
2013-08-06吴剑锋徐迪晖赵海金
吴剑锋,徐迪晖,赵海金
(1.解放军广州疗养院,广州 510515;2.南方医科大学南方医院消化科,广州 510515;3.南方医科大学南方医院呼吸科,广州 510515)
肝纤维化(hepatic fibrosis,HF)是各种慢性肝病共有的病理变化,表现为胶原为主的细胞外基质(extracelluar matrix,ECM)在肝脏过度的沉积。肝星状细胞(hepatic stellate cells,HSCs)的激活是HF的中心关键环节,HSCs被激活后,其表型向肌成纤维细胞转化,合成大量α-SMA、胶原等基质成分而参与HF的发生发展[1]。糖尿病和HF关系密切,一方面慢性肝病可影响糖代谢;另一方面,近年来研究发现,糖尿病会促进慢性肝病HF的进展,是发生肝硬化的一个重要危险因素[2,3]。探讨高血糖在HF发病中的作用及其机制,有助于发现防治HF的新策略。本实验通过体外高糖(模拟糖尿病高血糖)处理人HSCs,观察研究高糖对人HSCs的活化作用及其机制,为临床防治糖尿病相关HF提供新的实验依据。
1 材料和方法
1.1 材料
D-葡萄糖、甘露醇购自Sigma Aldrich公司(USA),DMEM培养基以及特级胎牛血清(FBS)购自 Gibco BRL(USA),抗 TGF-β1抗体购自 Abcam(Cambridge,UK,ab64715),抗 MMP-2 抗体购自Sigma Aldrich(St.Louis,MO,SAB4501891),抗I型胶原抗体购自Abcam(ab34710),抗α-SMA抗体购自Santa Cruz Biotechnology(CA,sc-130619)。
1.2 细胞培养与处理方法
HSCs细胞由中山大学实验动物中心提供。在37℃、5%CO2的条件下,培养于含有10%胎牛血清的DMEM培养基中。实验分组:正常对照组(normal glucose group,NG,5.5mmol/L葡萄糖)、高糖组(high glucose group,HG,30mmol/L葡萄糖)和渗透压对照组(osmolality control group,OC,5.5mmol/L葡萄糖+19.5mmol/L甘露醇)。
1.3 Western blot测定蛋白的表达
HSCs细胞接种于60mm培养皿中,各实验组给予不同的处理因素后,用预冷的PBS洗2次,加入细胞裂解液,4℃静置30min,12 000r/min离心10min,取上清,采用BCA法进行蛋白定量。总蛋白经SDSPAGE分离后,转移到PVDF膜上。用5%脱脂奶粉封闭1.5h,随后加入抗 TGF-β1、MMP-2、I型胶原和α-SMA抗体(1∶1 000),4℃过夜,用TBST洗3次,10min/次。将PVDF膜用发光试剂ECL显色,暗室曝光到X线片上,凝胶成像系统扫描分析结果。
1.4 ELISA法测定TGF-β1的分泌水平
采用双抗体夹心ABC-ELISA法检测培养基中TGF-β1的水平。HSCs细胞接种于96孔培养板中,当80%融合时,分别给予不同的条件处理培养基,每组3个复孔。处理完成后,取100μL培养基加入预先用TGF-β1抗体包被的酶标板中,37℃孵育90min,然后吸出培养基,加入TGF-β1抗体继续孵育60min,经TBS漂洗3次,加入生物素标记的Ⅱ抗,反应30min,采用TMB法显色,经终止液终止反应后,用酶标仪(Muhiscan MK3,Thermo Labsystems)记录450nm波长处的吸光度。取3孔标准化处理后的A值进行统计分析。
1.5 统计学方法
实验数据用SPSS 13.0软件进行统计分析。所有结果以均数±标准差(±s)表示,组间比较采用单因素方差分析(one-way ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1 高糖诱导HSCs细胞α-SMA表达上调
高糖处理HSCs细胞48h后,与NG组比较,α-SMA表达显著升高(见图1);α-SMA是肌成纤维细胞的标志之一,该结果提示高糖可以诱导HSCs细胞活化。所有实验重复至少3次。
2.2 高糖引起HSCs细胞MMP-2和I型胶原表达上调
I型胶原是ECM的主要成分,而活化的HSCs细胞是合成I型胶原的主要细胞;HSCs细胞高糖暴露48h后,I型胶原表达明显增加(见图2)。MMP在 HF时表达升高,其中 MMP-2主要由HSCs细胞分泌表达;高糖刺激HSCs细胞48h,MMP-2表达显著升高(见图3)。
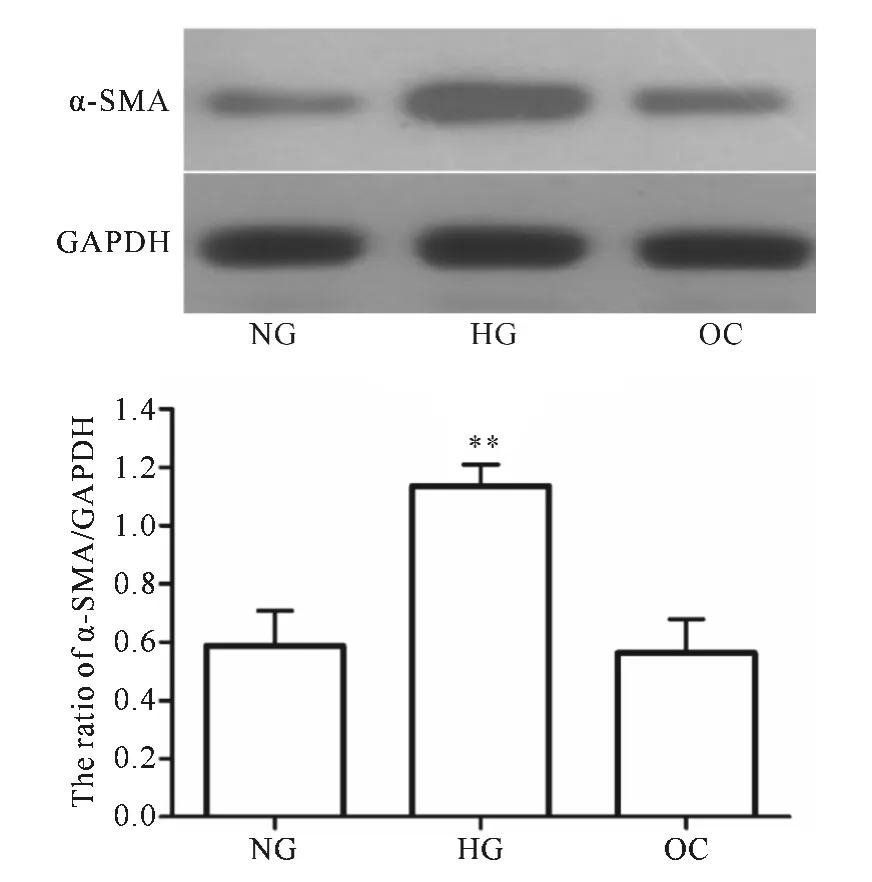
图1 高糖诱导上调HSCs细胞α-SMA的表达
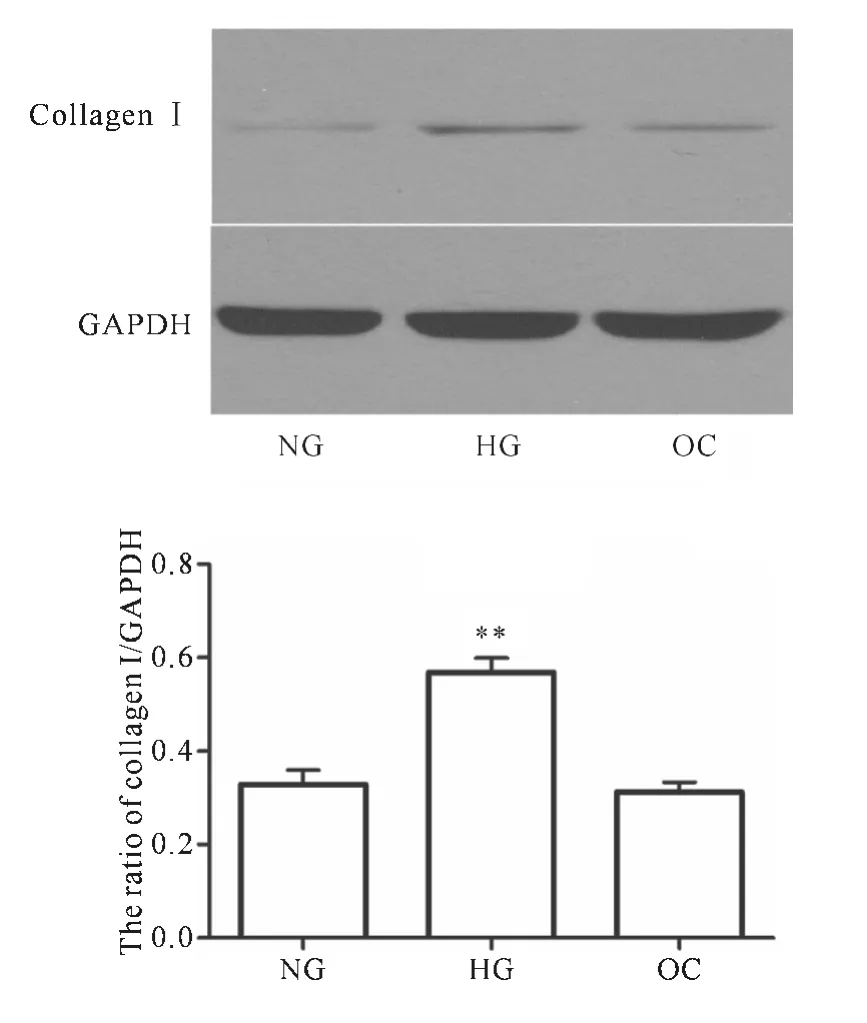
图2 高糖增加HSCs细胞I型胶原的表达
2.3 高糖促进HSCs细胞TGF-β1的分泌
TGF-β1在器官纤维化中有关键性作用,激活的HSCs细胞可以分泌 TGF-β1。本研究发现,HSCs细胞在高糖刺激48h后,培养上清液中TGF-β1的表达明显增加(见图4)。

图3 高糖上调HSCs细胞MMP-2的表达

图4 高糖促进HSCs细胞TGF-β1的产生
3 讨论
慢性肝病和各种因素引起的肝损伤,最终修复创伤的结果是HF,其本质是ECM合成超过降解的病理过程,也是各种肝病和肝损伤导致肝硬化的共同通路[4]。研究证实,糖尿病高血糖有促进肝脏、肾脏和血管等器官纤维化的作用,而HF又影响机体糖代谢,二者互为因果,相互促进[5,6]。糖尿病性肝病作为糖尿病的慢性并发症之一,是指糖尿病引起肝脏组织结构和功能的病理变化(包括HF)。
研究证实,HSCs在HF发生发展中起关键作用,其激活和增殖是HF的中心环节,激活的HSCs表型转变为肌纤维母细胞,特异性表达α-SMA(是HSCs激活的标志,在静止期HSCs中无明显表达,也是HSCs激活程度和HF进展的一个重要指标),合成大量 ECM 促进 HF[7-9]。
本研究结果显示:高糖处理HSCs后可以诱发α-SMA、I型胶原和 MMP-2表达上调,提示高糖可以激活HSCs而促进 HF;此外,TGF-β1在 HF中有重要作用,可以诱导HSCs表型转变为分泌胶原的肌纤维母细胞,而HSCs也可以分泌TGF-β1,进而加重肝细胞损伤[10];高糖刺激可以诱导HSCs分泌TGF-β1增加;高糖激活HSCs可能是通过TGF-β1信号通路。
综上所述,高糖可以激活人HSCs,进而促进HF的发生,其机制可能是通过TGF-β1通路。进一步深入研究高血糖和HF相互影响的内在机制,有助于发现防治糖尿病性HF的新策略,为糖尿病性肝损伤机制提供新的实验依据。
[1]蔡晓波,范建高,田丽艳,等.高血糖大鼠肝纤维肝脏氧化还原状态的影响[J].现代医药卫生,2005,21(20):2725-2726.
[2]范建高,田丽艳,蔡晓波,等.高血糖对四氯化碳中毒大鼠肝纤维化进展的影响[J].中华肝脏病杂志,2006,14(1):58-60.
[3]蔡晓波,范建高,田丽艳,等.高血糖对大鼠肝星状细胞活化及转化生长因子-β1和结缔组织生长因子表达的影响[J].肝脏,2006,11(2):96-97.
[4]李芹,邓存良,陈庄,等.高糖,胰岛素对大鼠肝星状细胞增殖影响[J].中国现代医学杂志,2009,19(11):1669-1672.
[5]罗洁,许辉,刘毅.高糖高脂诱导新西兰兔肝纤维化的实验研究[J].实用预防医学,2007,14(2):311-315.
[6]蔡晓波,范建高.高血糖对肝纤维化发生的影响及其机制[J].国外医学(消化系疾病分册),2005,25(5):281-283.
[7]刘银利,吴涛,毛美绒,等.高血糖对大鼠肝纤维化及肝星状细胞活化的影响[J].胃肠病学和肝病学杂志,2013,22(1):6-9.
[8]李芹,邓存良.高血糖,肝星状细胞与肝纤维化[J].医学综述,2008,14(6):888-889.
[9]樊雪强,陈新华,齐晓艳.靶向结缔组织生长因子的siRNA对于肝星状细胞介导纤维化的研究进展[J].中国医药导报,2012,9(35):55-57.
[10]方瑜洁,苌新明.高血糖对肝纤维化大鼠肝组织α-SMA和CTGF表达的影响[J].中国现代医药杂志,2009,11(7):1-4.
