小麦赤霉病菌拮抗菌AF0907的分离鉴定及其拮抗特性
2013-08-02徐剑宏王建伟胡晓丹史建荣
徐剑宏, 王建伟, 胡晓丹, 祭 芳, 史建荣
(江苏省农业科学院食品质量安全与检测研究所,江苏省食品质量安全重点实验室—省部共建国家重点实验室培育基地,农业部农产品质量安全控制技术与标准重点实验室,江苏省转基因安全评价公共服务中心,江苏 南京 210014)
赤霉病是小麦、玉米等多种禾谷类作物的一种重要病害,广泛分布于世界温暖潮湿地区[1-7],在长江中下游和江淮麦区的发生更为严重。尤其是近年来,由于小麦机械收割程度不断提高,秸秆大量还田,麦糠吹散在田间,使小麦赤霉病发生逐渐加重[8-9]。在赤霉病的防治过程中大多使用化学药剂,但是化学药剂会对人类的身体健康和环境造成严重的危害。生物防治在植物病害的防治过程中发挥了很大的作用[10-11],利用拮抗菌来控制赤霉病具有很好的防治效果[12-13]。芽孢杆菌生防菌不仅具有很强的环境适应性,而且是一种既能抑制植物病原菌生长和繁殖,又对人畜无毒,环境无害,所以具有很好的应用前景[14-15]。在生防菌的使用中,生防菌本身在环境中的适应性也是决定生防效果的关键因素。针对长江流域赤霉病发生严重的状况,本研究从小麦根际土壤中分离到1株对小麦赤霉病菌有高效拮抗作用的芽孢杆菌AF0907,通过对该拮抗菌的分离鉴定、拮抗谱、拮抗特性及其对小麦赤霉病的田间防治效果的研究,以期为该拮抗菌在小麦赤霉病病害防治中的应用提供理论基础。
1 材料与方法
1.1 材料
病原真菌:小麦赤霉病菌(Fusarium graminearum)、小麦纹枯病(Rizoctonia cerealis)、棉花枯萎病菌(Fusarium oxysporium)、葡萄炭疽病菌(Colletotrichum cingulata)、油菜菌核病菌(Sclerotinia sclerotiorum)、水稻稻瘟病菌(Magnaporthe grisea)、水稻恶苗病菌(Gibberella fujikuroi)、烟草赤星病菌(Alternaria alternata)、甜菜褐斑病菌(Cercospora beticola)、花生黑斑病菌(Ceroxpora arachidicola)、烟草灰霉病菌(Alternaria alternata)均为江苏省农业科学院食品质量安全与检测研究所分子技术与生物安全研究室分离并保存。
培养基:LB培养基成分为蛋白胨10.0 g/L、酵母膏 5.0 g/L、NaCl 2.0 g/L(pH 7.0 ~7.5)和琼脂15.0~20.0 g/L,用于拮抗菌的分离培养;PDA培养基成分为马铃薯200.0 g/L、葡萄糖20.0 g/L和琼脂15.0~20.0 g/L,用于拮抗菌的对峙培养筛选。
1.2 土样样品采集及拮抗菌的分离和筛选
于江苏省农业科学院小麦试验地采集小麦根际土壤,采用序列稀释法制备不同浓度的土壤稀释液,分别为1 ×10-7、1 ×10-8、1 ×10-9,取不同稀释度的土壤悬液100 μl涂于LB培养基上,置于30℃培养48 h后,挑取形态、颜色等不同的细菌单菌落经纯化后,采用平板对峙法测定不同菌株对禾谷镰刀菌的抑菌活性[16]:在PDA平板距中心25 mm处的4个对称点接待测细菌,培养1 d后,分别在平板中央接种小麦赤霉病菌菌块(菌块直径为6 mm),每个处理重复3次,在28℃培养5 d后观察有无抑菌带的形成(若有抑菌带的形成,则该测试菌株为拮抗菌)。
1.3 AF0907菌株的鉴定
菌株的生理生化鉴定参照文献[17]。菌株的16S rDNA全序列克隆和序列测定与比较参照文献[18]:采用 CTAB 法提取 AF0907 基因组 DNA[18],并以提取的DNA作为PCR反应模板,利用16S rDNA通用引物:正向引物5'-AGAGTTTGATCCTGGCTCAG-3',反向引物 5-TACCTTGTTACGACTT-3',进行 PCR扩增,琼脂糖电泳验证PCR产物后送上海生工生物工程公司测序。根据16S rDNA测序结果,在http://www.ncbi.nlm.nih.gov 在线查询分析,利用 Blast软件在GenBank中与其他16S rDNA序列进行同源性比较,选择同源性相近的序列用MEGA version 5软件构建AF0907系统进化树。
1.4 拮抗菌AF0907的拮抗特性研究
1.4.1 拮抗谱的测定 选取抑菌能力较强的拮抗菌AF0907,采用对峙培养法对各种不同的植物病原真菌(小麦赤霉病菌、小麦纹枯病菌、棉花枯萎病菌、葡萄炭疽病菌、油菜菌核病菌、水稻稻瘟病菌、水稻恶苗病菌、烟草赤星病菌、甜菜褐斑病菌、花生黑斑病菌、烟草灰霉病菌)进行抑菌活性测定,即在PDA平板距中心25 mm处的4个对称点接AF0907,培养1 d后,分别在平板中央接种各病原真菌菌块(菌块直径为6 mm),每个处理重复3次,上述处理在28℃培养5 d测定抑菌圈的直径。
1.4.2 拮抗菌对小麦赤霉病菌菌丝的影响 在100 ml PD培养基中接入小麦赤霉菌的菌丝后,加入在PD培养基中培养后处于对数生长期(OD值为1.5)的 AF0907 培养液10 ml,28 ℃、180 r/min摇床振荡培养5 d后,观察培养液的颜色变化,抽滤,烘干菌丝,测其质量,每个处理设4个重复,以加入PD培养基作为对照;同时用显微镜观察加入拮抗菌后赤霉菌菌丝的形态,以未加拮抗菌对峙培养的小麦赤霉病菌菌丝作为对照。
1.4.3 拮抗菌对小麦赤霉病菌孢子萌发的影响
参照文献[19],略有改动,利用6%绿豆汤孢子培养液于25℃光照培养禾谷镰刀菌5 d后,用PD培养液调节至1 ml悬浮液中含有1.0×105个孢子;将AF0907发酵液用PD培养液分别稀释10倍、50倍、100倍,然后将孢子悬浮液和不同稀释度的发酵液按照1∶1混合,25℃培养12 h后观察赤霉孢子的萌发率,以孢子悬浮液和PD培养液的混合液作为对照,每个处理4个重复。
1.5 拮抗菌AF0907对田间小麦赤霉病的防治效果
田间试验于2010年在江苏省农业科学院六合基地小麦试验田进行,小麦品种为扬麦158,设6个处理,分别为:喷施赤霉孢子液处理(对照1)、先喷施拮抗菌液再喷赤霉孢子液处理、先喷赤霉孢子液再喷拮抗菌液处理、同时喷施拮抗菌液和赤霉孢子液处理、喷施清水处理(对照2)和喷施拮抗菌液处理,每个处理重复5次,每次50株。在小麦扬花期之前,进行该试验,20 d后,调查小麦赤霉病发病的病小穗率和病情指数。病小穗率=病小穗数/总小穗数×100%;病情指数=∑100(Hi×i)/(H×4)(Hi:各级严重度对应的病穗数;i:病情严重级数;H:调查总穗数;小麦赤霉病分级标准,0级:无病;1级:发病部分占整个麦穗的1/4以下;2级:发病部分占整个麦穗的1/4~1/2;3级:发病部分占整个麦穗的1/2~3/4;4级:发病部分占整个麦穗的3/4以上)。
2 结果
2.1 拮抗菌的分离与筛选
从小麦根系土壤分离到4株小麦赤霉病菌的拮抗细菌,采用平板对峙法测定其对小麦赤霉病菌的抑菌带的宽度(菌边缘到赤霉菌边缘的垂直距离),结果表明,拮抗细菌AF0907的拮抗效果最为明显(表1),因此选择AF0907进行深入研究。
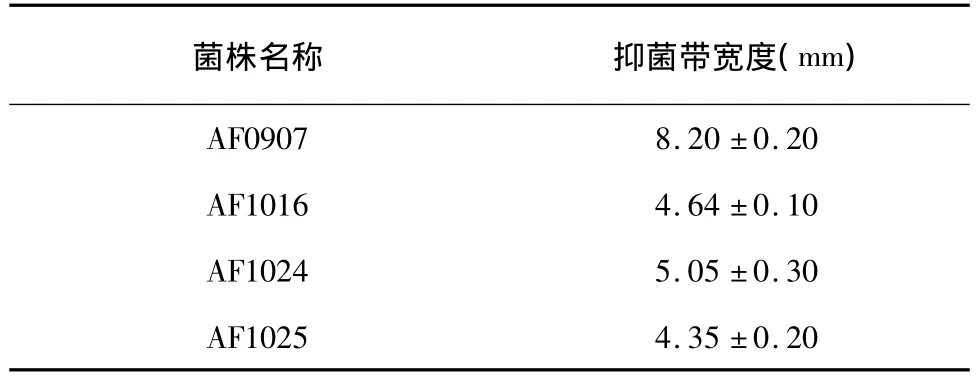
表1 赤霉病菌拮抗菌的拮抗活力Table 1 Antagonistic activity of strains against F.graminearum
2.2 赤霉病菌拮抗菌株AF0907的鉴定
菌株AF0907在LB平板上菌落呈乳白色,直径2 mm左右,形状椭圆,中央凹陷,表面干燥,有褶皱,不透明(图1);生理生化特征结果(表2)显示AF0907为革兰氏阳性,有芽孢、无伴孢晶体的细菌表2示。把AF0907的16SrDNA基因序列在NCBI上使用Blast比对,从 GenBank数据库中获得与 AF0907的16SrDNA序列相近的标准序列数据,采用MEGA中的邻位相连法(Neighbor-joining)构建菌株16SrDNA基因序列的系统发育进化树。由图2可知,AF0907与 Bacillus subtilis DSM 10(NR027552)、Bacillus subtilis SBRh5(HQ443229.1)等菌株位于同一个分支上,同源性达到99%以上,结合遗传距离、形态特征以及生理生化特征,可以把AF0907鉴定为枯草芽孢杆菌(Bacillus subtilis)。把菌株AF0907的16SrDNA基因序列递交GenBank数据库,得到序列的登录号为GU272021。

图2 基于16SrDNA的菌株AF0907的系统发育树Fig.2 Phylogenetic tree based on 16SrDNA sequence of strain AF0907
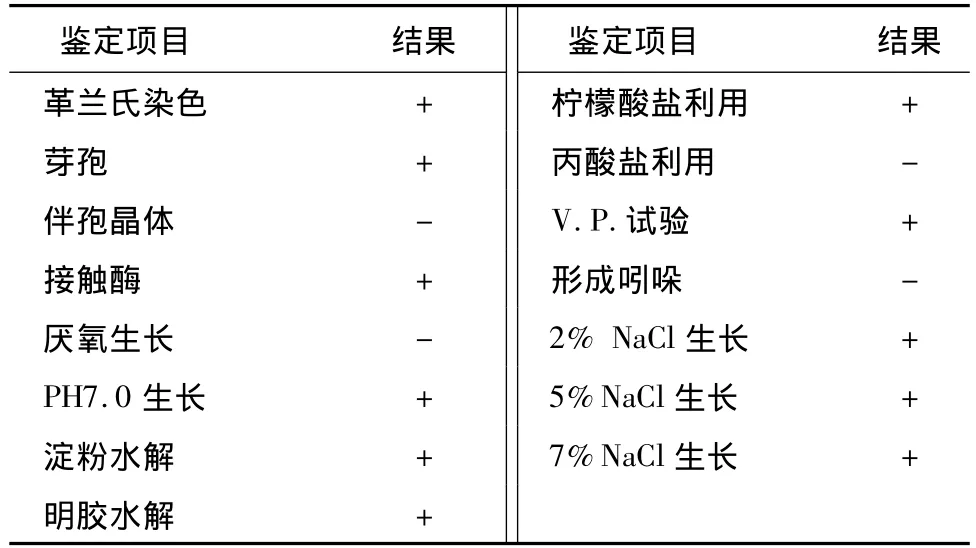
表2 AF0907菌株的生理生化特征Table 2 Physio-biochemical characteristics of strain AF0907

图1 AF0907在LB上的菌落形态Fig.1 The colony morphology of strain AF0907 on LB plate
2.3 拮抗菌AF0907的拮抗特性
2.3.1 拮抗谱 采用对峙培养法测定 Bacillus subtilis AF0907对11种病原菌的拮抗活性,结果显示菌株AF0907具有广谱抗植物病原真菌的特性,除了对小麦赤霉病菌具有很强的拮抗能力外,对其他病原菌,如小麦纹枯病菌、烟草赤星病菌、甜菜褐斑病菌、棉花枯萎病菌等抑菌活性都较强(表3)。
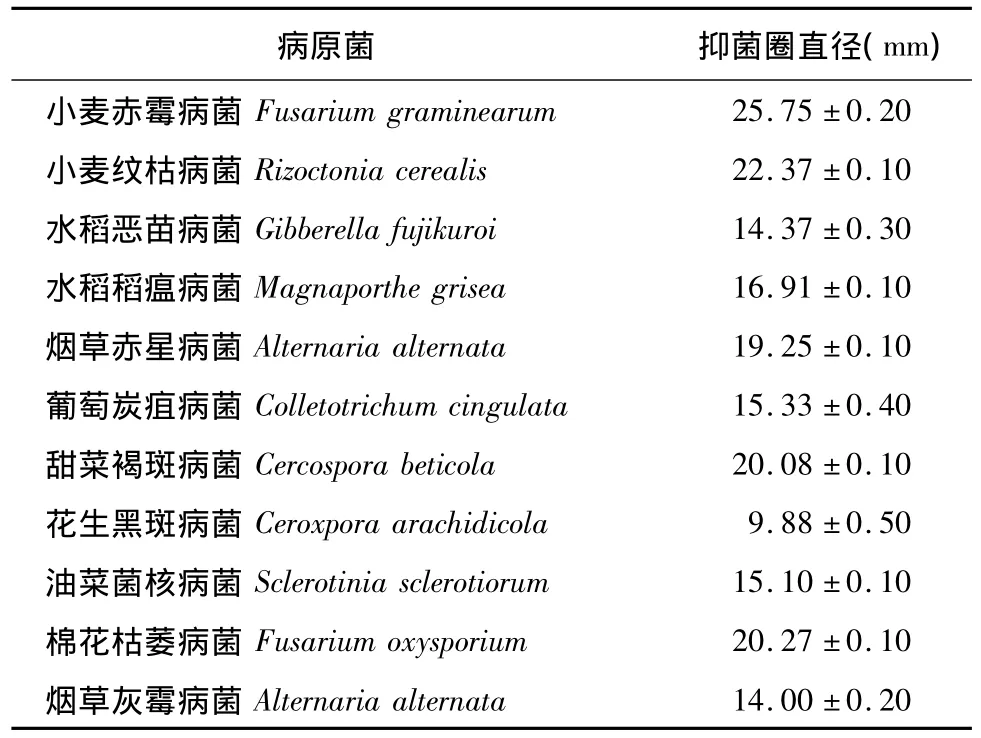
表3 AF0907菌株对不同病原菌的抗菌活性Table 3 Antagonistic activities of strain AF0907 against different plant pathogens
2.3.2 拮抗菌AF0907对小麦赤霉病菌菌丝的影响
在PD培养基中接入小麦赤霉病菌菌丝后,加入拮抗菌AF0907。结果(表4)显示,与对照相比,AF0907对赤霉病菌的菌丝生长影响显著,由对照的0.69 g下降为0.15 g,抑制率达78.26%。用显微镜观察不同处理的赤霉菌的菌丝,和对照相比,加入拮抗菌处理的赤霉病菌菌丝边缘形态异常,不能自由伸展,排列成栅栏状,一些基质菌丝膨大变粗,并且分支增多。
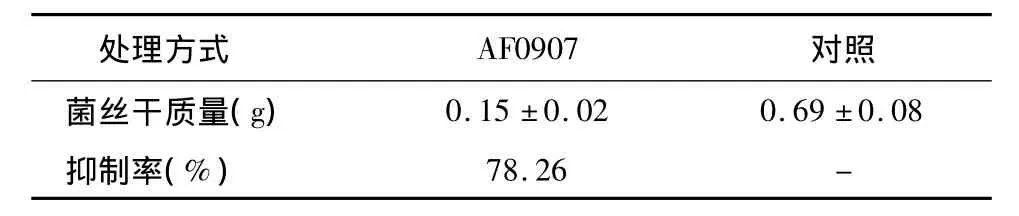
表4 菌株AF0907对小麦赤霉病菌菌丝的影响Table 4 Effect of strain AF0907 on hyphal growth of F.graminearum
2.3.3 拮抗菌AF0907对小麦赤霉菌孢子萌发的影响 用不同稀释度的拮抗菌发酵液处理禾谷镰刀菌的孢子液后,孢子的萌发率受到了严重影响,当拮抗菌液10倍稀释时,对孢子萌发的抑制率达到93.04%,随着稀释度的增加,抑制率有所下降,当拮抗菌液100倍稀释时,抑制率为85.39%(表5)。

表5 AF0907菌液对小麦赤霉菌菌孢子萌发的影响Table 5 Effect of strain AF0907 on the spore germination of F.graminearum
2.4 拮抗菌AF0907对小麦赤霉病的田间防治效果
把拮抗菌AF0907在扬花期喷施到扬麦158上,调查小麦赤霉病的发生情况,由表6可以看出,与喷施清水处理(对照2)相比,直接喷施拮抗菌AF0907的小麦病小穗率由29.24%下降为4.45%,病情指数由24.44%下降为16.67%,防治效果达到31.79%。先喷施拮抗菌液再喷施赤霉孢子液处理可以有效地减轻赤霉病的发病率,对赤霉病的防治效果达到40.37%,而先喷施赤霉孢子液再喷施拮抗菌液处理下的防治效果为29.26%。
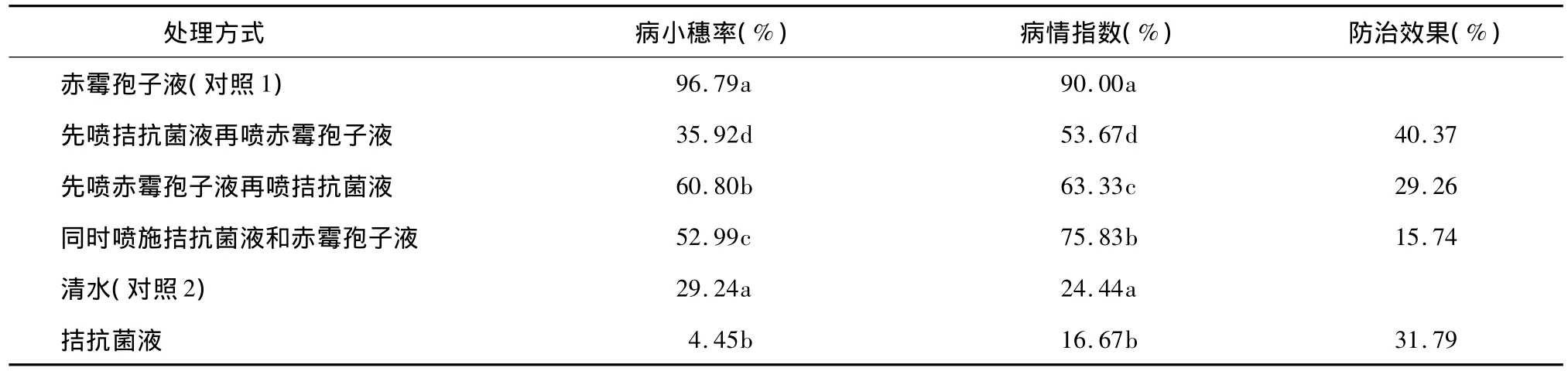
表6 菌株AF0907对小麦赤霉病的田间防治效果Table 6 The field control efficiency of strain AF0907 against F.graminearum
3 讨论
小麦赤霉病的危害近年来日趋严重,尤其是2010年和2012年大面积爆发的小麦赤霉病害对中国的粮食安全造成了很大的危害。对于赤霉病的防治,由于长期使用多菌灵等化学类农药,在中国很多地方出现了抗药性问题[20-21],因此急需一种能控制赤霉病害的替代方法。利用拮抗菌来控制植物病原菌的生长和繁殖具有很好的使用前景,已经有一些成功使用的先例[12,22]。芽孢杆菌由于抗逆性强,容易在环境中定殖,对人畜无害,不污染环境等优点,所以是一种很好的生防菌。本研究从小麦的根系土壤分离到1株对赤霉病菌具有高效抑制作用的拮抗菌AF0907,经过菌株的生理生化特性和系统进化分析被鉴定为枯草芽孢杆菌。该拮抗菌不但对小麦赤霉病菌具有很好的拮抗能力,而且对其他10种常见的植物病原菌都具有很好的拮抗活性。AF0907和小麦赤霉病菌一起培养时,可以抑制小麦赤霉病菌菌丝的生长,使菌丝边缘形态异常,不能自由伸展,一些基质菌丝膨大变粗,并且分支增多,同时AF0907还可以抑制小麦赤霉病菌孢子的萌发,因此在拮抗菌AF0907的作用下,小麦赤霉病菌不能正常生长和繁殖。在田间试验中,喷施拮抗菌AF0907可以降低小麦赤霉病的发病程度,防治效果可以达到15.74%以上,尤其在先喷施拮抗菌,让其在小麦中定殖后,再喷施赤霉孢子液,可以使防治效果提高到40.37%,因此拮抗菌AF0907在小麦赤霉病的防治中,甚至在其他植物真菌病害的防治中将会有广泛的应用前景。对于生防菌的研究,国内外也有不少研究,主要研究拮抗菌的分离鉴定及拮抗特性及拮抗物质的纯化鉴定。枯草芽孢杆菌能产生多种抑制植物病原真菌的拮抗物质,主要为低分子量的多肽类抗生素和一些高分子量的蛋白质类拮抗物质[23]。在研究中已经初步发现拮抗菌AF0907产生的拮抗物质主要在上清液中,且都能够耐受一定的pH、温度等因素的影响,对于具体拮抗物质的特性和结构还有待进一步研究。
[1]ALEXA E,POP G,SUMALAN R M,et al.Fusarium species and Fusarium mycotoxins in cereals from West Romania:preliminary survey[J].Communications in Agricultural and Applied Biological Sciences,2011,76(4):661-666.
[2]JAKSIC S,ABRAMOVIC B,JAJIC I,et al.Co-occurrence of fumonisins and deoxynivalenol in wheat and maize harvested in Serbia[J].Bulletin of Environmental Contamination and Toxicology,2012,89(3):615-619.
[3]VAN DER FELS-KLERX H J,DE RIJK T C,BOOIJ C J,et al.Occurrence of fusarium head blight species and Fusarium mycotoxins in winter wheat in the Netherlands in 2009[J].Food Additives & Contaminants Part A,Chemistry,Analysis,Control,Exposure& Risk Assessment,2012,29(11):1716-1726.
[4]程顺和,张 勇,别同德,等.中国小麦赤霉病的危害及抗性遗传改良[J].江苏农业学报,2012,28(5):938-942.
[5]温明星,陈爱大,杨红福,等.小麦抗赤霉病研究进展[J].江苏农业科学,2012,40(8):113-115.
[6]张 鹏,王 磊,杨学明,等.幼胚培养与标记辅助选择培育抗赤霉病小麦新种质[J].江苏农业科学,2012,40(11):70-71.
[7]陆成彬,张伯桥,范金平,等.2个重组自交系群体的小麦赤霉病抗性与表型性状相关性[J].江苏农业科学,2012,40(12):99-101.
[8]张 旭,邢锦城,马鸿翔,等.江淮流域小麦赤霉病菌的遗传多样性[J].江西农业大学学报,2010,32(6):1146-1151.
[9]马鸿翔,陆维忠.小麦赤霉病抗性改良研究进展[J].江苏农业学报,2010,26(26):197-203
[10]LI S,JOCHUM C C,YU F,et al.An antibiotic complex from Lysobacter enzymogenes strain C3:antimicrobial activity and role in plant disease control[J].Phytopathology,2008,98(6):695-701
[11]ZHAO Z,WANG Q,WANG K,et al.Study of the antifungal activity of Bacillus vallismortis ZZ185 in vitro and identification of its antifungal components[J].Bioresource Technology,2010,101(1):292-297.
[12]彭清忠,张惟材,朱根武.枯草杆菌表达系统的研究进展[J].生物技术通讯,2001,12(3):220-225.
[13]陈志谊,许志刚,陆 凡,等.拮抗细菌B-916培养液对水稻纹枯病菌的抗生活性及其抗菌物质的研究[J].江苏农业学报,2000,16(3):148-152.
[14]管章玲,辛海峰,李建宏,等.小麦赤霉病拮抗菌的筛选及应用[J].江苏农业学报,2012,28(2):309-313.
[15]童有仁,马志超,陈卫良,等.枯草芽孢杆菌B2034拮抗蛋白的分离纯化及特性分析[J].微生物学报,1999,38(4):339-343.
[16]陈年春.农药生物测定技术[M].北京:北京农业大学出版社,1990.
[17]东秀珠,蔡秒英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:59-65.
[18]JOSEPH S,FRITSCH E F,MANIATIS T.Molecular cloning:a laboratory manual[M].2nd ed.New York:Cold Spring Harbor Laboratory Press,1989.
[19]HUANG J,LI G,JING D,et al.Suppression of Magnaporthe oryzae by culture filtrates of Streptomyces globisporus JK-1[J].Biological Control,2011,58(2):139-148.
[20]DMELLO J P,MACDONALD A M,BRIERE L.Mycotoxin production in a carbendazim-resistant strain of fusarium sporotrichioides[J].Mycotoxin Research,2000,16(2):101-111.
[21]MALANDRAKIS A A,MARKOGLOU A N,KONSTANTINOU S,et al.Molecular characterization,fitness and mycotoxin production of benzimidazole-resistant isolates of Penicillium expansum [J].International Journal of Food Microbiology,2013,162(3):237-244.
[22]TAREQ F S,KIM J H,LEE M A,et al.Antimicrobial gageomacrolactins characterized from the fermentation of the marine-derived bacterium Bacillus subtilis under optimum growth conditions[J].Journal of Agricultural and Food Chemistry,2013,61(14):3428-3434.
[23]刘 静,王 军,姚建铭,等.枯草芽孢杆菌JA抗菌物特性的研究及抗菌肽的分离纯化[J].微生物生物学报,2004,44(4):511-514.
