棉花草甘膦抗性基因CP4-EPSPS的初步定位
2013-08-02刘吉焘马晓杰狄佳春陈旭升
刘吉焘, 马晓杰, 狄佳春, 陈旭升
(1.南京农业大学农学院,江苏 南京 210095;2.江苏省农业科学院经济作物研究所/农业部长江下游棉花与油菜重点实验室,江苏 南京 210014)
(责任编辑:汪恒英)
棉花是重要的经济作物,中国是产棉大国,棉农因防除棉田杂草每年都需付出大量的人力与物力。草甘膦是一种性能良好的除草剂,具有广谱除草和土壤中迅速降解的优点[1-3],是棉田使用最普遍的除草剂之一。但草甘膦作为除草剂也具有弊端,由于具有广谱除草,即非选择性除草的效能,故在杀死杂草的同时也会给棉花带来伤害。基于此,为了更好地利用草甘膦,抗草甘膦棉花便应运而生。抗草甘膦棉花品种最早出现于1997年,由美国孟山都(Mansanto)公司推出[4]。他们从土壤农杆菌变种CP4中分离到编码抗草甘膦酶(5-烯醇式丙酮酰莽草酸-3-磷酸合成酶)的基因,并通过农杆菌介导法转化珂字棉312(Coker312),把该基因导入棉花植株,从而使棉花对草甘膦产生抗性[5]。种植抗草甘膦棉花,极大地提高了棉田化学除草的灵活性和机动性,喷药时间不受土壤湿度和天气情况的限制,杂草随时可治。
本试验所采用的抗草甘膦品系G-6是江苏省农业科学院棉花遗传育种项目组从种质系PE-14中筛选纯化而来[6],经刘新民等[7]分子鉴定,确定其基因来源为人工合成的抗草甘膦基因CP4-EPSPS。本研究通过SSR分子标记技术对抗性基因CP4-EPSPS进行定位,确定抗性基因的位置,旨在为下一步的基因精细定位,进而深入了解外源基因在染色体中的插入位点机理提供依据。
1 材料与方法
1.1 供试材料
供试材料为抗草甘膦的陆地棉G-6和不抗草甘膦的海岛棉海7124。
1.2 试验方法
1.2.1 遗传群体的构建和形态标记调查 以G-6为母本,海7124为父本杂交,收获 F1种子。种植F1,通过自交获得F2种子;F1与G-6杂交得 BC1;F1与海7124杂交得BC2。在江苏省农业科学院实验基地种植亲本和 F1、F2、BC1、BC2群体,种植方式为营养钵育苗移栽,行距为80 cm,株距为40 cm。在大田用0.2%的草甘膦喷洒各群体,调查其抗性株与非抗性株;而后对分离群体进行χ2适合性测验。1.2.2 棉花总DNA提取与PCR扩增 取亲本及F2群体单株幼嫩叶片,DNA提取采用CTAB法[8]。PCR 反应体系为 10.0 μl,包括 20 ng/μl模板 DNA 1.0 μl、2 mmol/L DNTP 1.0 μl、10 × PCR buffer(含mg2+)、10 mmol/L Primer F 0.6 μl、10 mmol/L Primer R 0.6 μl、5 U/μl Taq DNA 聚合酶 0.1 μl、ddH2O 5.7 μl。PCR反应在PTC-200(MJ research)上进行。PCR反应程序为:94℃预变性2 min;94℃变性40 s;56℃退火45 s,72℃延伸1 min,30个循环;最后72℃延伸7 min[9-10]。扩增产物在8.0%聚丙烯酰胺凝胶(PAGE)上电泳。电泳缓冲液为1×TBE,200 V恒压电泳。电泳结束后,参照张军等[11]方法进行染色。
1.2.3 抗草甘膦目的基因的分子检测 利用特异引物F:5'-CCATCCTCTACTGCTTTCCC-3';R:5'-GTCTCACCTTCATCGCCATC-3'[12]进行 PCR 扩增,检测F2群体中各单株的抗草甘膦目的基因。在恒压90 V条件下,使用1%浓度的琼脂糖凝胶进行电泳,最后在荧光灯下观察目的片段。
1.2.4 差异标记筛选与目的基因定位 在F2群体中随机选取抗性植株和不抗植株各10株,每单株取等量叶片,将抗性单株和不抗单株的叶片分别混合,提取总DNA作为近等基因池[13]。利用本实验室前期从1 350对引物中筛选获得的分布于棉花26对染色体上的234对SSR核心引物[14],先筛选F2近等基因混池以及两亲本间的多态性差异标记,而后检测F2群体共160个单株的基因型。统计多态性条带,与G-6带型相同的个体基因记为“1”,与海7124带型相同的记为“2”,共显性杂合带型记为“3”,缺失记为“0”。采用Join Map4.0软件进行分子标记的连锁分析和位点排序,确定目的基因在染色体上的位置[15-17]。
2 结果
2.1 抗草甘膦与不抗草甘膦植株的表型特征
草甘膦为内吸传导型慢性广谱灭生性除草剂,主要抑制物体内烯醇丙酮基莽草素磷酸合成酶,从而抑制莽草素向苯丙氨酸、酪氨酸及色氨酸的转化,使蛋白质的合成受到干扰导致植物死亡。大田喷施草甘膦后调查发现,喷施草甘膦10 d后,不抗草甘膦植株顶心开始发黑,叶片从边缘开始枯萎,植株由上至下枯萎直至棉苗整株死亡。而抗性植株则生长正常,没有出现枯萎枯死等现象。
2.2 抗草甘膦性状在海陆杂交群体中的分离规律
调查海陆杂交6个世代群体在大田的抗性分离情况,结果见表1,可以看出:陆地棉抗性亲本G-6全部表现为抗,海岛棉亲本海7124全部表现为不抗。杂交F1代均表现为抗;显性回交群体BC1全部表现为抗;隐性回交群体BC2,其中抗株:不抗株符合1∶1的分离比例;F2代中的抗株:不抗株符合3∶1的分离比例。以上结果表明,抗草甘膦性状是由1对显性基因控制的质量性状。

表1 G-6和海7124杂交后代抗性分离情况Table 1 The segregation of glyphosate-resistant trait in offspring of G-6×Hai 7124
同时,利用特异引物对F2定位群体的单株进行抗性基因分子检测,图1是F2群体部分单株的分子检测结果。由图可见:非抗性单株无PCR扩增条带;抗性单株出现了PCR扩增条带,其扩增长度符合引物设计长度398 bp,显示本研究采用的抗草甘膦棉花品种的抗性基因是人工合成的CP4-EPSPS。

图1 F2群体部分单株的抗草甘膦基因分子检测Fig.1 Glyphosate-resistant gene identification of partial plants from F2population
2.3 CP4-EPSPS基因的分子定位
利用234对核心引物,通过对双亲与F2混池进行差异性标记筛选,共得到27对多态性引物。以这27对多态性引物检测F2作图群体每个单株的基因型,结果得到5个分子标记与目的基因连锁。这5个分子标记分别为 NAU5417、NAU1339、BNL3992、BNL2448、NAU2140,它们都为共显性标记。其中具有代表性SSR引物的PAGE电泳图见图2。
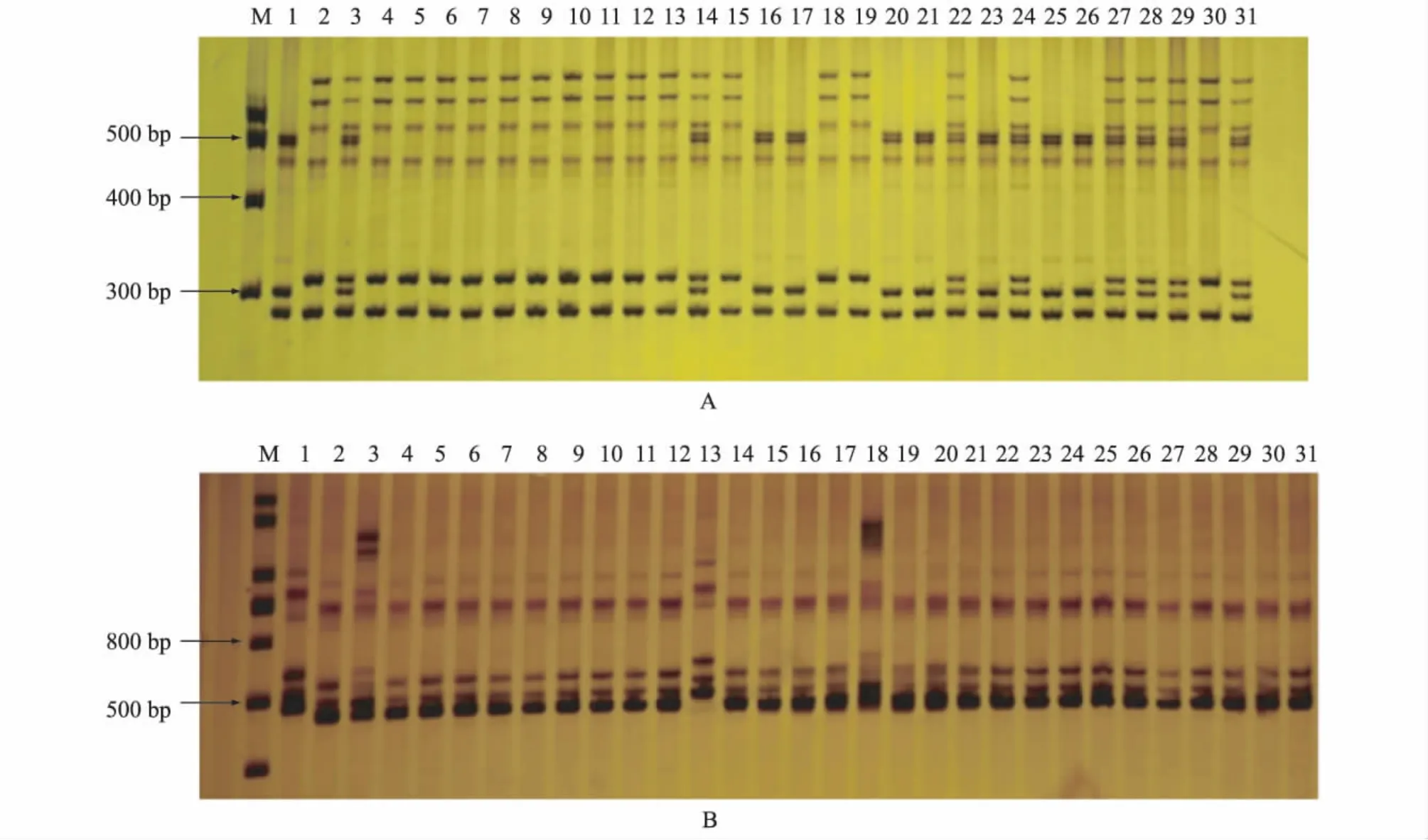
图2 F2作图群体部分单株的PCR扩增图谱Fig.2 PCR amplification profile of partial plants from F2population
查阅Guo等[18]公布的棉花遗传图谱,显示上述5对连锁标记都位于棉花第5染色体上,从而初步推定目的基因CP4-EPSPS在第5染色体上。进一步细筛位于第5染色体上的其他分子标记,共获得15个分子标记与目的基因连锁,而位于目的基因两侧的分子标记分别为 BNL2448、NAU2140(图3)。其中标记BNL2448与目的基因的遗传距离为7.0 cM,标记NAU2140与目的基因的遗传距离为16.2 cM,因此将目的基因定位在棉花第5染色体上。
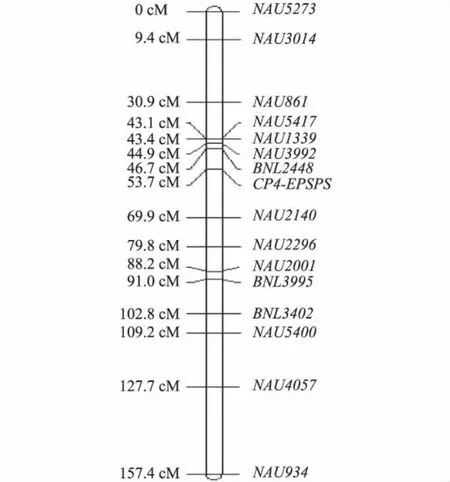
图3 抗草甘膦基因CP4-EPSPS的连锁图Fig.3 The linkage map of glyphosate-resistant gene CP4-EPSPS
3 讨论
3.1 抗草甘膦基因CP4-EPSPS定位的意义
转基因棉花在国内外已得到普遍推广与应用,但有关外源基因在染色体体上的定位工作鲜见报道。由于海陆杂交F2群体可以获得比较多的多态性标记[19],因此本研究采用了G-6与海7124杂交F2群体作为基因定位群体。定位结果发现:在棉花染色体5上共有15个标记与草甘膦抗性基因CP4-EPSPS连锁,从而推断目的基因位于第5染色体上。将本研究获得的连锁图谱与Guo等[18]报道的遗传图谱进行比较,发现本研究获得的15对与目的基因连锁的引物,其中12对引物在染色体上的排序与文献中完全吻合,但其中有 3对引物(NAU3014、NAU861、NAU5417)的排序与文献中有所错位。这可能是本试验采用的定位群体与Guo等并不完全相同所致。
CP4-EPSPS是人工合成的一种抗草甘膦基因,对于转基因作物,外源基因在后代中能否稳定遗传和表达是转基因工作成败的关键。外源基因的拷贝数多少、整合区域碱基组成以及结构特点等对于基因的稳定表达、抑制基因的沉默发生具有重要的影响[20]。本研究将CP4-EPSPS初步定位在第5染色体上,接下来可对该基因进行精细定位,然后利用Tail-pcr等技术来研究该基因的插入热点[21],分析CP4-EPSPS基因的插入位置及周围碱基的特点,将为下一步探究外源基因在染色体上的定向插入机理奠定基础。
3.2 抗草甘膦棉花的育种应用
目前,草甘膦仍是全球使用最广泛的除草剂。该除草剂价格低廉,遇土后迅速分解,无环境污染;但草甘膦对普通棉花具有较强的杀伤作用,在棉花生长期间使用易产生药害。培育抗草甘膦品种是解决药害最经济、最有效的手段[22-23]。G-6对草甘膦的抗性是受1对显性基因控制的质量性状,因此可通过传统的杂交育种手段,将该基因转育到生产上的主推品种中,培育新一代优质、高产、抗除草剂的棉花新品种。其次,由于该抗性性状受显性单基因控制,可将抗除草剂种质系作为杂交配组的父本,配制抗草甘膦杂交棉新组合。通过苗床喷施除草剂即可进行苗床去杂,还可以在苗期快速鉴定杂交棉的制种纯度,从而降低群体去杂与杂交制种纯度鉴定的成本,显示其在杂种优势利用方面具有广阔的应用前景。
[1]魏松红,张景远,李 斐,等.应用组织培养法筛选抗草甘膦水稻愈伤组织[J].江苏农业科学,2012,40(11):37-39.
[2]赵锦慧,赖 颖,郭 婕,等.不同草甘膦筛选方式对玉米抗性愈伤组织继代与分化的影响[J].江苏农业科学,2011,39(4):87-89.
[3]黄艳芳,刘志军,王建伟,等.催化氧化法合成草甘膦工艺条件研究[J].江苏农业科学,2011,39(2):202-205.
[4]MAY O L,BOURLAD F M,KOCH E,et al.Challenges in testing transgenic and nontransgenic cotton cultivars[J].Crop Sci,2003,43:1594-1601.
[5]NIDA D L,KOLACZ K H,LEEMAN M,et al.Glyphosate-tolerant cotton:genetic characterization and protein expression[J].Agric Food Chem,1996,44(7):1960-1966.
[6]陈旭升,刘新民,狄佳春,等.陆地棉抗草甘膦性状的遗传规律分析[J].江苏农业科学,2009(1):76-78.
[7]刘新民,马晓杰,周益军,等.陆地棉抗草甘膦种质系的抗性基因分子鉴定[J].江苏农业学报,2010,26(2):437-439.
[8]PARTERSON A H,BRUBAKER C,WENDEL J F.A rapid method for extraction of cotton(Gossypium spp.)genomic DNA suitable for RFLP or PCR analysis[J].Plant Mol Biol Rep,1993,11(2):122-127.
[9]朱岩芳,祝水金,王 洋,等.均匀设计优化棉花ISSR-PCR反应体系[J].棉花学报,2010,22(3):202-208.
[10]宋国立,崔荣霞,王坤波,等.改良CTAB法快速提取棉花DNA[J].棉花学报,1998,10(5):273-275.
[11]张 军,武耀廷,郭旺珍,等.棉花微卫星标记的PAGE/银染快速检测[J].棉花学报,2000,12(5):267-269.
[12]潘良文,陈家华,沈禹飞,等.进口转基因抗草甘膦油菜籽和大豆中CP4-EPSPS基因的检测比较研究[J].生物技术通讯,2001,12(3):175-177.
[13]MICHELMORE R W,PARAN I,KESSELI R V.Identification of markers linked to disease-resistance genes by bulked segregant analysis:a rapid method to detect markers in specific genomic region by using segregating populations[J].Proc Natl Acad Sci USA,1991,88:9828-9832.
[14]景 超,马晓杰,狄佳春,等.陆地棉超矮杆突变体基因的初步定位[J].遗传,2011,33(12):1393-1397.
[15]倪西源,王学德,程超华,等.棉花分子标记图谱的构建和一些重要性状的定位[J].棉花学报,2007,19(1):71-73.
[16]GONZALO M J,OLIVER M,GARCIA-MAS J,et al.Simple-sequence repeat markers used in merging linkage maps of melon[J].Theor Appl Genet,2005,110:802-811.
[17]马海财,马 雄,柳剑丽,等.利用SSR分子标记构建甜瓜遗传图谱[J].福建农林大学学报,2010,39(1):47-52.
[18]GUO W Z,CAI C P,WANG C B,et al.A microsatellite-based,gene-rich linkage map reveals genome structure,function and evolution in Gossypium[J].Genetics,2007,176(1):527-541.
[19]YIN J M,CHEN X S,XIAO S H,et al.Molecular mapping of a new red mutant gene(Rs)in upland cotton[J].Plant Breeding,2009,128(4):416-419.
[20]左开井,张献龙,聂以春,等.转基因抗虫棉Bt基因插入碱基组成分析[J].遗传学报,2002,29(8):735-740.
[21]LIU Y G,WHITTER R F.Thermal asymmetric interlaced PCR:automatic amplification and sequencing of insert and fragments from Pl and YAC clones for chromosome walking[J].Genomics,1995,25:674-681.
[22]陈旭升.抗除草剂棉花研究进展[J].江西农业学报,2006,18(1):94-98.
[23]华水金,袁淑娜,邵明彦,等.抗草甘膦棉花研究进展[J].分子植物育种,2007,5(4):534-539.
