硫化钠沉淀法处理含铅废水研究
2013-07-31李静文
李静文
(中国矿业大学(北京) 化学与环境工程学院,北京 100083)
硫化钠沉淀法处理含铅废水研究
李静文
(中国矿业大学(北京) 化学与环境工程学院,北京 100083)
本实验采用硫化钠沉淀法处理模拟含铅废水,考察了反应时间、硫化钠投加量、反应初始p等因素对废水中铅离子去除效率的影响,以及反应过程中硫化铅沉淀的粒径分布特征,初步分析了硫化钠沉淀法去除废水中铅离子的作用机理.试验结果表明:在反应时间为20min,硫化钠投加量与铅离子的物质量之比为5:1,反应初始pH为8的条件下,硫化钠沉淀法对废水中铅离子的去除效果最佳,铅离子的去除率为99.72%,处理出水能满足国家污水综合排放标准(GB8978-1996)中对铅离子的排放浓度要求.反应过程中所形成的硫化铅沉淀粒径主要分布在0.809~132.22um范围,沉淀沉降性能良好,能够通过后续的沉淀处理较好地从水中分离.
铅离子;硫化钠;沉淀;粒径分布;重金属
现如今,废水中重金属的污染较为常见,我们国家的重金属废水主要来自于医药、农药、矿山、电解、电镀、冶炼、油漆、颜料等企业工厂排出的废水.不同生产企业所排放的废水中的重金属含量、种类和存在形式都各不相同.重金属污染的毒性非常大,对环境的污染以及人类身体健康都有非常大的危害.其中,重金属铅污染的来源较为广泛,主要产生于工业生产过程排放的废水和汽车尾气的排放,毒性较大.铅污染一旦产生就很难被微生物分解,但较易被生物吸收,吸收后会通过食物链累积起来,同时铅在水体中也较难实现转化,其过程相当复杂[1].因此化学工作者应对废水中铅的处理给予高度重视.
目前,国内含铅重金属废水主要采用石灰中和+混凝沉淀工艺进行处理,该方法主要存在污泥产量大、操作条件复杂等问题.与该方法相比,硫化钠沉淀法处理含铅重金属废水具有更广阔的研究应用前景.首先,硫化铅沉淀比氢氧化铅沉淀的溶度积常数更低,采用硫化钠沉淀法对废水中铅离子的去除效率更高.其次,硫化铅沉淀易于污泥浓缩与脱水处理.再次,硫化钠沉淀法能回收重金属废水中的有价金属元素.国内外对硫化钠沉淀法去除废水中的Zn2+、Cu2+、Hg2+等重金属离子的效果进行了初步试验研究,但尚未对该方法去除废水中铅离子的工艺条件、金属硫化物沉淀粒径分布特征进行系统的研究.因此,有必要对其进行更为全面深入研究,为硫化钠沉淀法处理含铅重金属废水的工程应用提供科学依据和理论基础.
本研究采用硫化钠沉淀法处理含铅重金属废水,通过考察反应时间、Na2S投加量、反应初始pH等影响因素对铅离子去除效率的影响,确定硫化钠沉淀法处理含铅重金属废水的最佳操作条件,并分析了处理过程中形成的硫化铅沉淀的粒径分布特征,为硫化钠沉淀法处理含铅重金属废水的工程应用优选出最佳的工艺参数.
1 实验材料与方法
1.1 实验材料
1.1.1 实验试剂
含铅量为1000 mg/L的硝酸铅溶液;Pb2+浓度为35 mg/L的模拟含铅废水;0.042 mol/L的Na2S溶液;0.1 mol/L的稀HNO3溶液.
1.1.2 试验装置
本试验的装置主要由硫化钠沉淀法反应装置;电动磁力搅拌器;硫化氢气体吸收装置;ACO系列电磁式空气泵四部分组成.
1.2 实验方法
1.2.1 最佳反应时间的选择
取一定量的模拟含铅废水置于反应器内,根据Na2S投配比为1:1和1:3以及1:5来分别加入一定量的Na2S溶液,启动磁力搅拌器,将三组反应液分别在反应时间为0 min、10 min、20 min、30 min、40 min、50 min、60 min时取10 ml水样,将取得的水样用0.45 um滤膜过滤后,装入离心管,酸化保存.待用ICP测定其铅离子浓度后,确定最佳反应时间.
1.2.2 最佳Na2S加药量的选择
取一定量的模拟含铅废水置于反应器内,分别加入投配比为1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1的Na2S溶液,启动磁力搅拌器,在最佳反应时间时取水样,用0.45 um滤膜过滤,装入离心管,酸化保存.测定后确定最佳Na2S投加量.
1.2.3 最佳反应pH的选择
取一定量的模拟含铅废水置于反应器内,分别用HNO3与NaOH溶液调节废水pH值至2、3、4、5、6、7、8,按最优投配比加入Na2S溶液,启动磁力搅拌器,在最佳反应时间时,取水样用0.45 um滤膜过滤后,装入离心管,酸化保存.测定后确定最佳pH值.
1.2.4 硫化铅沉淀粒径分布
借助激光粒度分析仪测定沉淀物的中值粒径,从而可知沉淀的粒径范围以及滤膜对于硫化铅沉淀的滤除效果,以便对沉淀物的去除方法进行改进.
2 试验结果及分析
2.1 反应时间对铅离子去除效果的影响
由图1可以看出,前三十分钟内,水样在20 min左右的含铅量最低,达到19 mg/L.虽然反应在进行到40~50 min时水样的含铅量比20 min时的要低,但仅仅低了0.3 mg/L左右,所以,选取20 min作为最佳反应时间.
图2的变化趋势与图1基本一致,水样在20 min时的含铅量为8.565 mg/L,在30 min时的含铅量最低,达到8.345 mg/L.虽然反应在30 min时水样的含铅量比20 min时的要低,但含铅量仅仅低了0.22 mg/L,因此,依旧将20 min作为最佳反应时间.
由图3可知:反应在进行到10 min时铅去除率已经达到了99.84%,20 min时铅去除率达到了99.97%,当反应时间过短时,反应进行的不够充分,硫化钠对重金属铅的去除率没有达到国家含铅废水的排放标准:Pb 2+≤1 mg/L,因此,选取20分钟作为安全反应时间,在这一反应时间内,基本可以保障铅去除率符合去除要求,而30 min时的铅去除率虽然达到了100%,但30分钟的反应时间过长,溶液中的硫化钠容易被氧化成单质硫,影响去除效果.所以,最佳的反应时间为20分钟.

图1 反应配比为1:1时,0~60分钟水样的含铅量

图2 反应配比为1:3时,0~60分钟水样的含铅量

图3 配比为1:5条件下的0~30 min的铅去除率变化柱状图
综上所述,在三种不同Na 2 S投加量条件下,反应的最佳时间为20 min.
2.2 Na2S投加量对铅离子去除效果的影响
由图4可以看出,20分钟时水样的剩余铅含量呈现降低—升高—降低—基本不变的趋势:配比为1:1~1:4时,水样的剩余含铅量会随着硫化钠投配比的升高而降低,反应过程中硫化钠的投配量过低,使得模拟含铅废水中铅离子和硫化钠未发生充分反应而残留;当投配比为1:6~1:8时,投配量又过高,溶液中的硫化钠过量,会产生硫代酸盐PbS22-,而此硫代酸盐是可溶性的,使得溶解度低的硫化铅又被溶解,此时模拟水样的剩余含铅量又随着硫化钠投配比的增加而升高,而且与配比在1:5时候的含铅量相比,去除效果变差;当投配比为1:9~1:10时,模拟水样的剩余含铅量基本保持不变,此时硫化钠的投配量已经达到饱和,再继续加入,反应产生的硫化铅也基本保持不变.
在铅离子与硫化钠投配比为1:1~1:10时,模拟水样的剩余含铅量是在不断降低的,其中当反应配比为1:10,反应进行到20 min时,水样的剩余铅含量达到最低,为0.0339 mg/L,其值符合国家对于含铅废水的排放标准:Pb2+≤1 mg/L,铅去除率达到最高,为99.89%,所以,我们选取含铅废水中铅含量与硫化钠的投加配比为1:5作为最佳投配量.
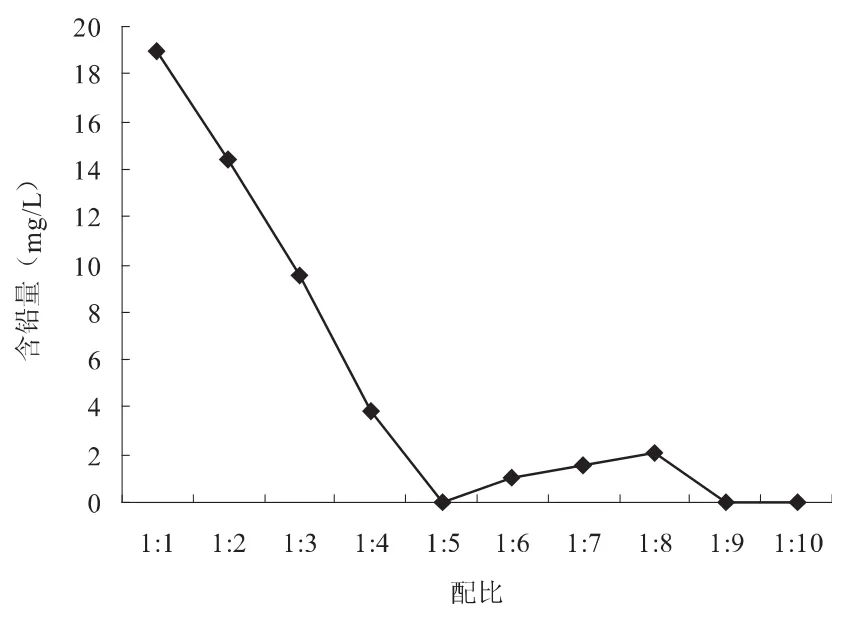
图4 不同配比下,20 min水样的剩余铅含量变化曲线
2.3 反应pH对铅离子去除效果的影响
由图5可知,在pH=2~4条件下,pH=4时的总去除率最高,达到97.62%,此时的剩余含铅量最低,达到0.766 mg/L,符合国家的含铅废水排放标准:Pb2+≤1 mg/L;pH=5~8条件下,pH=8时的剩余含铅量最低,为0.0807 mg/L,也符合国家的含铅废水排放标准.将氢氧化铅过滤后,仅考虑硫化钠对废水中铅含量的影响时,可得出pH=8过滤沉淀后的去除率最高为99.52%,而包括氢氧化钠对废水中铅离子的去除作用在内时,总去除率在pH=8是达到最高,为99.72%.由图5可以看出,模拟含铅废水的去除率是随着pH的升高而增大的.分析这一变化趋势,可知:当pH=7时,PbS的电位等于0,可知当pH>7之后,PbS处于稳定状态,更有利于硫化铅沉淀的生成,详见图6[2].

图5 配比为1:5,20 min,pH=2~8时水样的铅去除率

图6 PbS在25℃下的E-pH图
综上所述,可以确定反应的最佳pH值为8.
2.4 硫化钠沉淀粒径分布
从表1可看出,随着投配量的增加,遮光度略有升高,但投配比对颗粒吸光度的影响不大;投配比在1:6条件下时,沉淀的粒径最小,为0.809 um,而投配比在1:5、1:10时的中值粒径分别为11.451 um、24.112 um,沉淀的粒径随着投配量的升高而增大,这一现象的原因,可能是在最佳投配比1: 5条件下,由于铅的去除率高,所以其沉淀的效果要优于1:6时的,而1:10条件下的沉淀粒径大于1:5时的,由于过量的硫化钠水解生成HS-,亲水性的HS-会吸附在硫化铅沉淀物表面而形成粒径更大的沉淀物.

表1 不同配比下的沉淀粒径分布特征
3 结论
3.1 实验是以试样中的剩余含铅量作为指标进行分析研究的,本课题的研究结果如下:模拟含铅废水中铅含量与硫化钠投加配比为1:5;最佳反应时间为20分钟;反应的最佳pH值为8,在上述三个反应条件下,剩余含铅量为0.0807 mg/L,符合国家含铅废水排放标准:Pb2+≤1 mg/L,而且铅的去除效率最高,为99.72%,其值接近100%.
3.2 硫化钠沉淀法去除重金属过程中会产生H2S气体,这一气体是剧毒性气体,虽然有空气泵将其通入吸收液中,但吸收效果并不理想,因此,还应对尾气吸收装置进行改进;
3.3 硫化钠的实际投加量显著高于理论值,投加量低时,出水重金属浓度无法达标;而投加量高时,硫化钠过量也会对环境产生危害;
3.4 通过粒径分析试验可知:当投配比为1:5、1:10时,大多数沉淀颗粒物的粒径在10~25 um之间,因此滤膜对于的硫化铅沉淀的过滤效果较好,而当投配比为1:6时,多数颗粒的粒径在0.8 um左右,因此,0.45 um水系的滤膜对于这一粒径范围的沉淀颗粒物滤除效果不理想.而在不同投配比条件下都存在着Pb S沉淀颗粒物粒径极小,甚至低于0.45 um水系滤膜孔径的情况,因此,我们应该进一步研究如何增大沉淀物的粒径,使去除效果更明显.
〔1〕蔡宏道.环境污染与卫生监测[M].北京:人民卫生出版社,1979.55-62.
〔2〕朱福良,华一新.用硫化钠与乙酸铅制备硫化铅[J].云南冶金,2002,31(5):25-28.
〔3〕李秀芬.硫化钠从稀土矿中淋出液中除重金属离子[J].矿产综合利用,2000(3):46-47.
〔4〕Gaspar Banfalvi.Removal of insoluble heavy metal sulfides from water[J].Chemosphere,2006,63:1231-1234.
X 703
A
1673-260X(2013)02-0008-03
