NR4A1基因的克隆及真核表达载体的构建
2013-07-27王良国黄晓燕林素潘嘉林戴晓春王本极吴漪浩杨德业
王良国,黄晓燕,林素,潘嘉林,戴晓春,王本极,吴漪浩,杨德业
(温州医学院附属第一医院 心内科,温州医学院 心血管生物和基因研究所,浙江 温州 325000)
室间隔缺损(ventricular septal defect,VSD)是一种常见的先天性心脏病,但至今对其致病因素及发病机制仍知之甚少。转化生长因子β(transforming growth factor-β,TGF-β)在胚胎发育和细胞分化中起重要作用,骨形态形成蛋白受体IA(bone morphogenetic protein receptor IA,BMPIA又名ALK3)属于TGF-β超家族,在心脏发育及心肌细胞分化中起重要作用[1-2]。美国Schneider教授创建了心脏特异的ALK3基因敲除的小鼠模型,仅在心脏敲除ALK3基因[3],发现纯合子小鼠死于胚胎中期,并伴有VSD,心内膜垫和肌小梁发育不全[4]。ALK3基因在调控心脏发育和心肌细胞凋亡过程中起重要作用。杨德业教授实验室利用基因芯片筛选ALK3的下游基因,发现转录因子Pax-8在ALK3基因敲除的纯合子小鼠胚胎心脏中下调了7.1倍[5],周希等[6]已证明Pax-8基因参与了心脏的发育,并通过抑制心肌细胞的凋亡而参与胚胎心脏的发育,而黄晓燕等[7]利用基因芯片检测小鼠基因表达水平,筛选出差异表达的基因,找到了Pax-8的下游基因NR4A1,其受Pax-8基因调控,在Pax-8保护细胞凋亡途径中发挥作用。为了进一步研究Pax-8下游基因NR4A1与心肌细胞凋亡之间的联系,本研究通过克隆NR4A1全长序列,构建含NR4A1基因的真核表达载体,为探讨NR4A1在心肌细胞凋亡过程中的功能做准备。
1 材料和方法
1.1 材料和试剂 Pax-8基因敲除小鼠模型由德国Peter Gruss和Ahmed Mansouri教授惠赠;Trizol、LipofectamineTM2000转染试剂、DEPC水(RNase-free and DNase-free)及各个PCR引物均购自Invitrogen公司;FBS、DMEM(low glucose)、0.05%胰酶/EDTA、Hanks均购自Gibco;RT试剂盒(RevertAidTM First Strand cDNA Synthesis Kit)、Dnase I(Rnasefree 1 U/μL)购自MBI Fermantas公司;大鼠H9C2心肌细胞株购自中科院上海细胞库;高保真DNA聚合酶Prime STARTM HS DNA Poly-merase购自TAKARA公司;限制性内切酶购自NEB公司;DH5a菌种、超级感受态细胞制备试剂盒购自碧云天生物技术研究所;质粒抽提试剂盒购自Omega;T4连接酶购自Promega;PCR试剂盒(SYBR Green Realtime PCR Master Mix)、封板膜及96孔板购自ABI公司;兔抗鼠NR4A1(NUR77)多克隆抗体购自abcam公司。
1.2 方法
1.2.1 Pax-8敲除小鼠的基因型鉴定:用雌性Pax-8 KO+/-(杂合型)小鼠与雄性Pax-8 KO+/-(杂合型)小鼠交配可获得Pax-8 KO-/-(纯合子型)和Pax-8 KO+/-(杂合子型)以及Pax-8 KO+/+(野生型)小鼠。并利用PCR鉴定出Pax-8 KO-/-(纯合子型)。引物为5’-GGATGTGGAATGTGTGCGAGG-3’,5’-GCTAAGAGAAGGT GGATGAGAG-3’,和 5’-GATGCTGCCAGTCTCGTAG-3’。PCR条件:第一步:94 ℃预变性 5 min,94 ℃变性15 s, 60 ℃退火15 s,72 ℃延伸30 s,10个循环。第二步:94 ℃变性15 s,57 ℃退火15 s,72 ℃延伸30 s,25个循环,最后72 ℃延伸5 min。
1.2.2 NR4A1基因的cDNA克隆:用TRIzol试剂提取Pax-8 KO-/-(纯合子型)小鼠心脏组织总RNA,并经琼脂糖凝胶电泳鉴定RNA质量,以此为模板,oligo dT为引物逆转录合成cDNA。依据GeneBank中小鼠NR4A1的基因序列设计引物,上游(S1):5’-ATGCCCTGTATTCAAGCTCAATA-3’,下游(A1):5’-TCAG AAAGACAATGTGTCCATAA-3’,用高保真DNA聚合酶Prime STARTM HS DNA Polymerase扩增NR4A1序列,NR4A1 PCR反应条件:94 ℃预变性变性5 min后,98 ℃变性10 s,56.4 ℃退火15 s,72 ℃延伸2 min,循环36次,最后延伸5 min。将PCR产物进行1.2%琼脂糖凝胶电泳,并回收NR4A1条带,利用LATaqDNA酶在3’端加上poly A尾,然后与pGEM-T Easy载体连接后,转化到DH5α,经过蓝白斑筛选,挑取数个阳性克隆菌落摇菌后,测序鉴定,鉴定序列比对后正确。

1.2.4 脂质体转染:转染前1 d,将1×105/孔细胞接种至6孔板中,然后按Lipofectamine 2000说明书进行转染。转染6 h后,用含有10% FBS的DMEM换液,在培养箱中培养48 h。实验分3组:①实验组(PZ-NR4A1组):细胞转染1.2μg pIERS2-ZsGreen1-NR4A1重组载体为实验组;②阴性对照组(NC组):细胞转染1.2μg pIERS2-ZsGreen1空载体作为阴性对照组;③空白对照组(BC组):给予常规培养液,未做其他处理。
1.2.5 荧光实时定量PCR检测转染后NR4A1的mRNA表达水平:细胞转染48 h后,用TRIzol试剂提取各组细胞总RNA,然后用RevertAidTM First StrandcDNA Synthesis Kit逆转录合成cDNA,以此为模板进行荧光实时定量PCR。荧光实时定量PCR引物,NR4A1:上游SSS1:5’-GGGTGACCCCACTATTTGTC’-3’,下游SSA1:5’-CGGAAGAGATCTCGAGTTGG-3’,GAPDH:上游:5’-TGCACCACCAACTGCTTAGC-3’,下游:5’-GGC ATGGACTGTGGTCATGAG-3’。再利用ABI 7500 FAST 型荧光实时定量PCR仪进行定量检测。PCR条件:95 ℃15 s,60 ℃ 60 s,共40个循环,以GAPDH作为内参,进行归一化,各组生物学重复三次。数据分析利用美国Biosystems公司的Sequence Detec-tion system(SDS)2.2.2软件进行。样本目的基因的相对表达率(relativeexpression,RQ)采用△△CT方法计算,RQ=2-△△CT(CT表示PCR 扩增过程中荧光信号强度达到阈值所需要的循环数),△CTsample=CTsample-CT /GAPDHsample,△CTcontrol=CTcontrol-CT/GAPDHcontrol,△△CT=△CTsample-△CTcontrol)
1.2.6 Western blotting法检测转染后NR4A1蛋白表达水平:转染48 h后,用RIPA裂解细胞提取总蛋白,BCA法测定蛋白浓度,各组上样30μg,然后进行电泳,转膜,5%脱脂牛奶封闭2 h。一抗(NUR77 antibody 1:1000),4 ℃孵育过夜,TBST溶液洗膜3次,每次10 min。室温下加入IgG抗体(1:4000)孵育1.5 h,洗膜3次,每次10 min,用Odyssey近红外双色激光成像系统选择800通道进行扫描条带,以GAPDH作为内参标化NR4A1蛋白质表达,各组技术、生物学各重复三次。用Quantity One凝胶成像分析系统进行半定量分析。
1.3 统计学处理方法 采用SPSS 17.0软件完成统计学分析。计量资料以±s表示,实验数据经过方差齐性检验,多组间均数比较采用单因素方差分析,独立的两组间比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 Pax-8基因敲除小鼠基因型的鉴定 Pax-8纯合子型为约370 bp的条带,Pax-8杂合型为390 bp和370 bp两条条带,Pax-8野生型为约390 bp的条带。见图1。
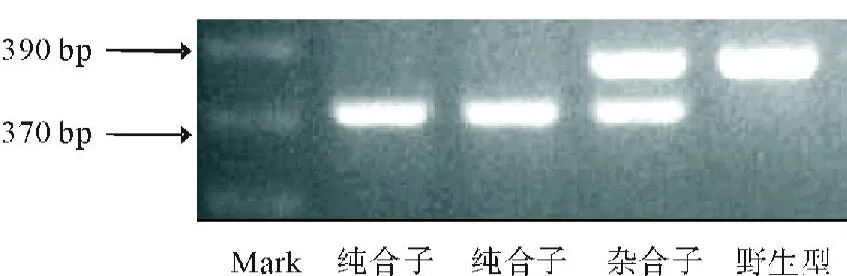
图1 Pax-8基因敲除小鼠基因型的鉴定
2.2 NR4A1基因的cDNA克隆 从Pax-8基因敲除小鼠中取出心脏组织,提取mRNA后用Fermantas逆转录试剂盒逆转录合成cDNA,在PCR仪上进行扩增后,在1.2%的琼脂糖凝胶上分离,在1800 bp处可以见到特异性条带(见图2),用QIAquick胶回收试剂盒回收后,与pGME-T Easy载体连接,转化到DH5α感受态细菌,在含X-Gal-IPTG的LB培养板上挑取阳性单克隆,经16 h摇菌后,将菌液送至华大基因公司测序,测序结果与pubmed上公布的NR4A1序列一致。

图2 NR4A1基因扩增
2.3pIERS2-ZsGreen1-NR4A1真核表达载体的初步构建 以pGME-T Easy-NR4A1为模板,在PCR仪上进行扩增,扩增后在1.2%的琼脂糖凝胶上分离,在1800 bp处可以见到明显特异性条带(见图3),与设计相符。再次进行胶回收,与pIERS2-ZsGreen1载体连接后,转化到感受态细菌,经蓝白斑筛选后,挑取阳性克隆进行快速PCR鉴定,在300 bp左右见到明显条带。见图4。

图3 NR4A1基因再扩增
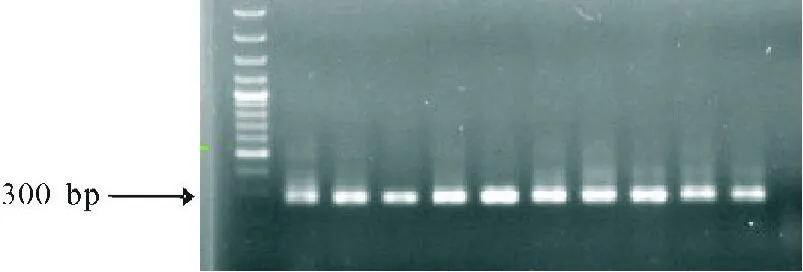
图4 NR4A1基因初步鉴定
2.4 NR4A1真核表达载体的酶切与测序鉴定 将阳性克隆菌液扩增后,提取质粒,经EcoRI、BamHI进行双酶切后,在琼脂糖凝胶上分离,预期切出约1800 bp的NR4A1片段带和约5.3 kb的载体带。结果如图5所示,与预期一致。将阳性克隆送到华大基因公司测序,将测序所得的序列和GeneBank中NR4A1基因片段序列进行比对,显示构建序列与预计碱基序列一致,因此pIERS2-ZsGreen1-NR4A1构建成功。

图5 pIERS2-ZsGreen1-NR4A1双酶切

图6 实时定量PCR检测NR4A1 mRNA的表达水平
2.5 荧光实时定量PCR检测转染后NR4A1的mRNA表达水平 与BC组(1.00±0.00)相比,PZ-NR4A1组(2.62±0.21)NR4A1 mRNA表达水平明显升高(P<0.05),与NC组(0.99±0.16)相比,PZ-NR4A1组NR4A1 mRNA表达水平明显升高(P<0.05),而BC组和NC组 mRNA表达水平差异无统计学意义(P>0.05)。见图6。
2.6 Western blotting法检测转染后NR4A1蛋白表达水平 PZ-NR4A1组(0.72±0.11)与BC组(0.17±0.07)相比,NR4A1的蛋白表达量明显升高(P<0.05),PZ-NR4A1组(0.72±0.11)与NC组(0.21±0.08)相比,NR4A1的蛋白表达量也明显升高(P<0.05),而BC组和NC组相比,NR4A1的蛋白表达量差异无统计学意义(P>0.05)。见图7。
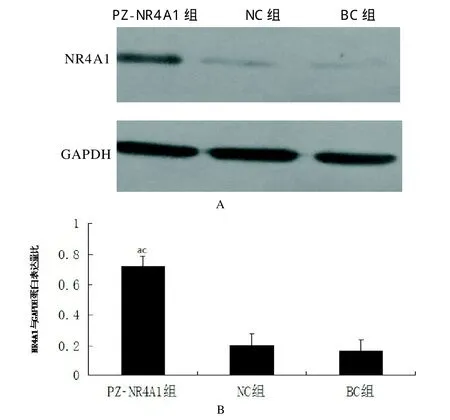
图8 Western blotting法检测NR4A1蛋白的表达水平
3 讨论
先天性心脏病是由于胎儿时期心脏血管发育异常所导致的心血管畸形。其发病率大约占出生婴儿的0.8%,研究表明其主要原因可分为遗传因素和环境因素两类,包括染色体易位与基因畸变、大剂量放射性射线接触、宫内感染以及药物等因素。心脏发育是一个既复杂又连续的过程,是一系列生长分化因子和转录因子参与调节的。先天性心脏病轻者无症状,在查体时可被发现,重者则有紫绀、活动后呼吸困难、晕厥等。随着年龄的增长,可有生长发育迟缓。 根据血液动力学以及病理生理的变化,可将先天性心脏病分为三类:①无分流类。②左至右分流类。③右至左分流类。VSD是常见的先天性心脏病,约为先心病总数30%,而先天性VSD是否与某一特定基因异常有关,为此杨德业教授实验室利用基因芯片筛选ALK3的下游基因,发现转录因子Pax-8,而Pax-8基因参与胚胎心脏的发育。再利用基因芯片筛选了Pax-8基因敲除小鼠的下游基因,发现了NR4A1的高表达。NR4A1又称Nur77、GFRP1、NGFI-B等,是一种转录因子,是核受体超家族一员,目前未发现其配体,故又称为孤儿核受体,从氨基端到羧基端,一共有4个结构域组成。NR4A1在多种组织中表达,具有比较复杂的生物学功能。NR4A1不仅参与细胞周期调控,还与类固醇激素的生成、肿瘤以及动脉硬化的形成密切相关,故NR4A1的作用比较广泛, 在细胞凋亡、细胞增殖、甾体激素合成等诸多方面发挥作用[8]。其与不同的辅助因子相互作用,可使下游的基因表达激活或者抑制。国内外研究表明,若细胞受到促进生长分裂的分子信号刺激,NR4A1能调节各种促进细胞增殖的基因表达;若细胞受到促进细胞凋亡的分子信号刺激时,NR4A1通过磷酸化,从细胞核内转移至线粒体,并与Bcl-2相互作用,可使Bcl-2分子由一个保护因子变为杀伤因子,并触发细胞色素C释放,而激活细胞凋亡[9]。在Pax-8基因敲除的小鼠模型中,其心肌细胞凋亡明显增高。
NR4A1与Pax-8基因敲除小鼠心肌细胞的凋亡相关,在心肌细胞凋亡的模型中,NR4A1的表达量明显升高。由此可以推断当Pax-8基因敲除后,保护心肌细胞的因素减弱,而促进细胞凋亡的因素增强,从而使NR4A1磷酸化,而导致心肌细胞的凋亡,继而出现VSD,导致先天性心脏病的发生。我们的研究目的就是想找寻与引起VSD密切相关的通路,当这条通路上的基因被激活或抑制后,心肌细胞会出现怎样的生长情况,从而为基因治疗先天性心脏病奠定基础。本实验通过基因重组技术,成功构建了含NR4A1基因全长的真核表达载体,并且能在细胞中成功表达蛋白,这为进一步探索NR4A1的生物学功能及确定与先天性心脏病的相关程度奠定了基础。此外实验中的真核表达载体pIERS2-ZsGreen1携带有GFP,在质粒转化后,通过荧光显微镜观察转染是否成功及转染效率,为之后进一步的稳定转染实验研究提供了方便。
[1] Bernstein E, Caudy AA, Hammond SM, et a1. Role for a bidentate ribonuclease in the initiation step of RNA interference[J]. Nature, 2001, 409(6818):363-366.
[2] Tuschl T, Borkhardt A. Small interfering RNAs:a revolutionary tool for the analysis of gene function and gene therapy[J]. Mol Interv, 2002, 2(3):158-167.
[3] Liu D, Scholze A, Zhu Z, et al. Increased transient receptor potential channel TRPC3 expression in spontaneously hypertensive rats[J]. Am J Hypertens, 2005, 18(11):1503-1507.
[4] Liu DY, Thilo F, Scholze A, et al. Increased store-operated and 1-oleoyl-2-acetyl-sn-glycerol-induced calcium influx in monocytes is mediated by transient receptor potential canonical channels in human essential hypertension[J]. J Hypertens, 2007, 25(4):799-808.
[5] 杨德业, 宋后燕, 张怀勤, 等. 心肌组织Pax8基因的研究[J].中华儿科杂志, 2003, 41(10):770-772.
[6] 周希, 黄晓燕, 杨德业, 等. Pax-8基因真核表达载体的构建及其功能的初步研究[J]. 中国病理生理杂志, 2011, 27(3):430-436.
[7] 黄晓燕, 高瞻, 杨德业, 等. Pax-8 基因敲除小鼠心脏中NR4A1基因表达上调[J]. 温州医学院学报, 2011, 41(3):205-208.
[8] Bonta PI, Pols TW, de Vries CJ. NR4A nuclear receptors in atherosclerosis and vein-graft disease[J]. Trends Cardiovasc Med, 2007, 17(3):105-111.
[9] Li H, Kolluri SK, Gu J, et al. Cytochrome c release and apoptosis induced by mitochondrial targeting of nuclear orphan receptor TR3[J]. Science, 2000, 289(5482):1159-1164.
