布拉氏酵母菌预防婴儿抗生素相关性腹泻临床分析
2013-07-27李云芳黄开宇
李云芳,黄开宇
(温州医学院附属第二医院、育英儿童医院 儿童消化科,浙江 温州 325027)
婴儿肺炎是儿科呼吸系统常见疾病,一般需应用抗生素治疗,随之而来可发生抗生素相关性腹泻(antibiotic-associated diarrhea,AAD),研究显示使用广谱抗生素的患儿AAD发生率高达1l%~40%[1-3]。减少AAD的发生有非常重要的意义,鉴于布拉氏酵母菌对机体有其较多的生理作用,我院应用布拉氏酵母菌口服预防婴儿期AAD,取得良好效果。
1 资料和方法
1.1 一般资料 2010年12月至2011年12月在我院住院诊治的237例肺炎患儿,男132例,女105例,年龄1~12个月,其中年龄<6个月136例,6~12个月101例。所有患儿均符合第7版《诸福棠实用儿科学》的诊断标准[4]。除外:痰呼吸道病毒抗原阳性,严重感染或全身性细菌感染,发病前2周内应用抗生素治疗,发病前存在急慢性胃肠道感染,发病前使用过微生态制剂治疗用药,存在先天性心脏病、消化道畸形、免疫缺陷等基础疾病的患儿。将患儿随机分为两组, 预防组120例, 男67例,女53例,男女比例为1.26:1;年龄<6个月70例,6~12个月50例,平均(5±0.8)个月。对照组117例,男65例,女52例,男女比例为1.25:1,年龄<6个月66例,6~12个月51例,平均(6±0.3)个月。两组患儿在性别、年龄以及病情严重程度上差异无统计学意义, 具有可比性。
1.2 诊断标准 AAD定义为抗生素治疗48 h后发生的,连续24 h内出现3次以上水样便或不成形便的患儿[5]。腹泻病情分类[6]:轻型:腹泻不伴脱水、电解质紊乱、酸中毒,无中毒症状;重型:腹泻伴脱水、电解质紊乱、酸中毒或有明显中毒症状。
1.3 治疗方法 预防组、对照组均给予静脉抗生素及对症支持治疗,其中预防组同时加用布拉氏酵母散剂(商品名:亿活,每袋250 mg,布拉氏酵母活菌含量不少于5×109cfu,法国BIOCODEX药厂生产),250 mg/次,2次/d,口服治疗,出现继发腹泻后仍继续使用。对照组在出现腹泻后在原有基础上加用布拉氏酵母菌散剂治疗。出现腹泻后两组均同时加用思密达散及适当补液,有电解质紊乱、酸中毒者予纠正。两组患儿在治疗前后均检查肝、肾功能、电解质,有脱水或中毒症状者查血气分析。
1.4 临床观察指标 观察记录腹泻出现的时间及例数、大便次数及性状、腹泻治愈时间、有无全身中毒症状、脱水、电解质紊乱。腹泻患儿均取新鲜大便标本送大便常规、细菌培养(沙门菌、志贺菌和O157大肠埃希菌)和轮状病毒抗原检测。
1.5 疗效判断标准[6]显效:治疗72 h内粪便性状及次数恢复正常,全身症状消失;有效:治疗72 h内粪便性状及次数明显好转,全身症状明显改善;无效:治疗72 h内粪便性状及次数与全身症状均无好转甚至恶化。
1.6 统计学处理方法 数据均采用SPSSl2.O统计软件进行分析。计量资料以±s表示,采用t检验,计数资料采用x2检验。P<0.05为差异有统计学意义。
2 结果
2.1 腹泻临床表现 预防组腹泻大便为水样或稀便,4例伴脱水体征或电解质紊乱或酸中毒;大便常规正常、大便细菌培养阴性;对照组腹泻大便水样或稀便,13例伴脱水体征或电解质紊乱或酸中毒;大便常规检测5例见白细胞,均<10个/HP,1例见少量红细胞,大便细菌培养阴性。两组大便轮状病毒抗原检测结果均阴性。
2.2 两组腹泻发生率、腹泻病情比较 预防组腹泻发生率为17.50%,较对照组(36.75%)低,差异有统计学意义(x2=11.137,P=0.001)。腹泻患儿中,预防组和对照组相比,轻型腹泻、重型腹泻发生率差异无统计学意义(x2=0.91,P=0.34),见表1。
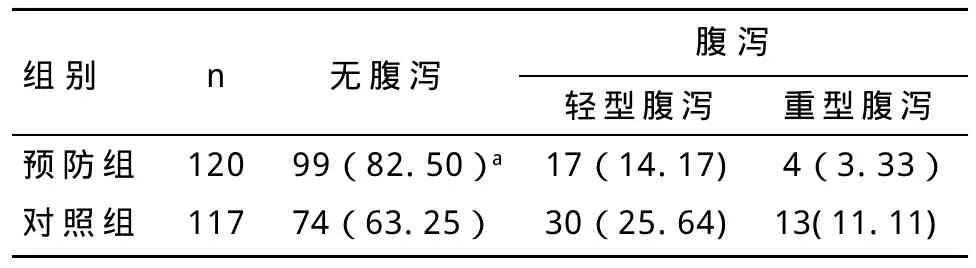
表1 两组腹泻发生率及严重程度比较 n(%)
2.3 两组腹泻疗效比较 预防组腹泻患儿总有效率为95.24%,较对照组69.77%高,差异有统计学意义(x2=4.0,P=0.046),见表2。
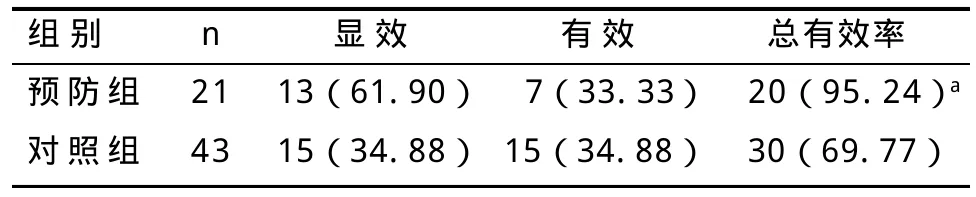
表2 两组腹泻患儿疗效比较 n(%)
2.4 腹泻持续时间比较 预防组腹泻持续时间短于对照组,差异有统计学意义(t=2.96,P=0.004)。预防组轻型患儿腹泻持续时间短于对照组,差异有统计学意义(t=2.83,P=0.007)。而预防组与对照组重型患儿腹泻持续时间差异无统计学意义(t=1.22,P=0.242),见表3。
表3 两组腹泻患儿腹泻持续时间比较(±s,d)
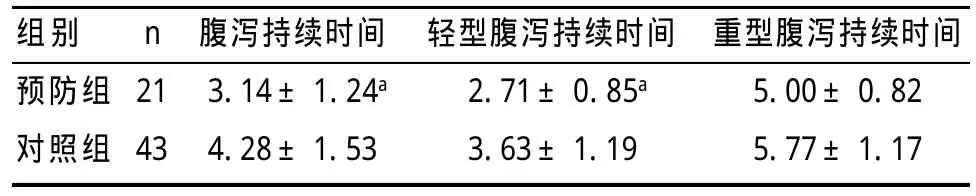
表3 两组腹泻患儿腹泻持续时间比较(±s,d)
与对照组比:aP<0.05
组别预防组对照组n 21 43腹泻持续时间3.14±1.24a 4.28±1.53轻型腹泻持续时间2.71±0.85a 3.63±1.19重型腹泻持续时间5.00±0.82 5.77±1.17
2.5 不良反应 两组患儿在治疗过程中未见不适,肝肾功能正常。
3 讨论
腹泻是儿科的常见病、多发病。其中肠道菌群失调是婴幼儿腹泻的主要易感因素之一。肺炎是婴幼儿常见呼吸系统疾病,特别是婴儿肺炎,往往病情较重,需要较长疗程的静脉抗生素治疗,有时需二联抗生素或三线抗生素治疗,容易发生AAD,不利于患儿病情恢复。有国外学者统计发现,年龄小于2岁是AAD发生的危险因素[7]。亦有研究表明年龄愈小,AAD的发生率越高,可能是由于小儿免疫及消化功能发育不完善,致使机体免疫力较弱,消化功能易受到疾病本身的影响,加上抗生素的应用,引起肠道正常菌群破坏,导致肠道抵抗力的下降,极易出现AAD[8]。随着抗生素的广泛应用和滥用,AAD发病率呈增高趋势,也越来越受到重视,已经有许多研究应用双歧杆菌、乳酸杆菌等微生态调节剂预防AAD的发生[9],但很多益生菌易受胃酸、胆酸、抗生素等影响,而布拉氏酵母菌不受上述因素影响,且具有多种生理作用:①刺激肠黏膜合成释放分泌型免疫球蛋白,提高肠道局部抗感染能力;②代谢释放各种短肽蛋白酶,能中和或钝化致病菌释放的毒素;③释放多胺类物质(精胺和亚精胺),提高小肠绒毛膜处代谢酶的活性;④提高寡聚氨基肽酶活性,深度降解多肽蛋白为氨基酸,促进营养物质代谢和受损黏膜的再生修复。故本研究将布拉氏酵母菌应用于预防AAD的发生。
此次研究对象为婴儿,结果显示对照组AAD的发病率为36.75%,与国外报道抗生素治疗的住院患者中ADD的发生率最高为26%~60%[10]相近。表1显示预防组腹泻发生率明显低于对照组,表明布拉氏酵母菌具有较好的预防AAD发生的作用。表2及表3显示预防组腹泻持续时间低短于对照组,预防组疗效高于对照组,表明应用布拉氏酵母菌预防AAD取得良好疗效。国外McFarland[11]基于25项2810例AAD患者的Meta分析,结果显示微生态制剂可有效预防AAD,并且证明3种微生态制剂产品(布拉氏酵母菌、鼠李属乳酸杆菌、多种菌种的混合制剂)可显著降低AAD的发生率;其另一项随机双盲对照研究表明布拉氏酵母菌可以有效安全地降低AAD的发生[12]。Szajewska等[13]一项5个中心的研究Meta分析,亦有一致结果。近年来国内已有关于布拉氏酵母菌预防AAD发生的研究,结果亦显示效果良好。国内外研究均发现AAD的病原以难辨梭状芽孢杆菌、产气荚膜梭菌、金黄色葡萄球菌等多见,一般腹泻表现较重,可出现黏液脓血便,但本研究发现预防组患儿大便常规均未见白细胞、红细胞,而对照组部分患儿出现大便白细胞,个别出现红细胞,说明应用布拉氏酵母菌可能可减轻AAD引起的肠黏膜损害。此外,本研究中发现预防组与对照组腹泻程度方面差异无统计学意义,与贾黎红等[14]报道的结果有差异,可能与研究对象的年龄差异有关,本研究对象为婴儿,消化系统发育、黏膜屏障功能等较幼儿更为不成熟,机体自身调节能力较差,容易出现水电解质酸碱平衡紊乱。另此次研究亦发现预防组与对照组重型患儿腹泻持续时间上差异无统计学意义,亦可能与上述因素有关。
综上所述,布拉氏酵母菌在预防AAD的发生及总疗效均有良好效果,研究中未发现不良反应,临床上抗生素治疗婴儿肺炎时,应用这种微生态制剂可作为有效预防AAD的手段。但对小年龄患儿尤其婴儿注意加强对症支持治疗,防止及尽快纠正水电解质酸碱平衡紊乱。
[1] Wistrfim J, Norrby SR, Myhre EB, et a1. Frequency of antibiotic associated diarrhoea in 2462 antibiotic-treated hospitalized patients:a prospective study[J]. J Antimicmb Chemother, 2001, 47(1):43-50.
[2] McFarland LV, Epidemiology. Risk factors and treatments for antibiotic-msociated diarrhea[J]. Dig Dis, 1998, 16(5):292-307.
[3] Tuwk D, Bemet JP, Marx J, et al. Incidence and risk factors of oralantibiotic-associated diarrhea in an outpatient pediatric population[J]. J Pediatr Gastroenteml Nutr, 2003, 37(1):22-26.
[4] 胡亚美, 江载芳, 诸福棠. 实用儿科学[M]. 7 版. 北京:人民卫生出版社, 2002:1171-1299.
[5] 周正任. 细菌的耐药性与控制策略[M]//龙北国, 江丽芳. 高级医学微生物学. 北京:人民卫生出版社, 2003:129-142.
[6] 中华人民共和国卫生部. 中国腹泻病诊断治疗方案[J]. 中国实用儿科杂志, 1998,13(6):381-384.
[7] Alam S, Mushtaq M. Antibiotic associated diarrhea in children[J]. Indian Pediatrics, 2009, 46(6):491-496.
[8] 马芬芳. 应用培菲康预防小儿肺炎继发腹泻[J]. 现代医院,2009, 9(6):62.
[9] 马红玲, 郑跃杰, 罗宏英, 等. 益生菌对婴幼儿肺炎并发腹泻的治疗作用[J]. 中国微生态学杂志, 2005, 17(2):122-123.
[10]Levy DG, Stergechisa A, McFarland LV, et al. Antibiotics and C lostridium difficile diarrhea in the ambulatory care setting[J]. Clin Ther, 2000, 22(1):91-102.
[11]McFarland LV. Meta analysis of probiotics for the prevention of antibiotic associated diarrhea and the treatment of clostyidium difficile disease[J]. Am J Gastroenterol, 2006,101(4):812 -822.
[12]McFarland LV. Can Saccharomyces boulardii prevent antibiotic-associated diarrhea in children?[J]. Nat Clin Pract Gastroenterol Hepatol, 2005, 2(6):262-263.
[13]Szajewska H, Mrukowicz J. Meta-analysis:non-pathogenic yeast Saccharomyces boulardii in the prevention of antibiotic-associated diarrhoea[J]. Aliment Pharmacol Ther, 2005,22:365-372.
[14] 贾黎红, 杨世炳. 布拉氏酵母菌预防婴幼儿抗生素相关性腹泻临床研究[J]. 中国新药杂志, 2010, 19(14):1234-1236.
