广州市青春期女生血清邻苯二甲酸二丁酯水平与初潮年龄相关性研究的初步观察
2013-07-18何展明马蒙蒙陈清谭炳炎
何展明马蒙蒙陈清谭炳炎
广州市青春期女生血清邻苯二甲酸二丁酯水平与初潮年龄相关性研究的初步观察
何展明1★马蒙蒙2陈清2谭炳炎3
目的 了解广州市发育正常青春期女生(12~15岁)血清中邻苯二甲酸二丁酯(DBP)暴露水平,并初步探讨其与初潮年龄的关系。 方法 2012年3月,选择广州市白云区某中学30名健康体检的女生作为研究对象,采集静脉血样本,利用气相色谱-质谱联用(GC-MS)分析方法检测其血清中DBP水平,以广东地区汉族女孩2005年初潮年龄的均值12.4岁为准,将调查对象分为初潮年龄<12.4岁组和初潮年龄≥12.4岁组,比较不同初潮年龄组女生血清DBP检出率及浓度分布的差异。 结果 30例女生的血样中,19例可检出DBP,检出率为63.3%,DBP的浓度范围为0~740 μg/L,浓度中位数为60 μg/L,且无年龄差异,其中初潮年龄<12.4岁组检出率为75.0%,初潮年龄≥12.4岁组检出率为86.4%,且前者血清DBP浓度分布的平均秩次高于后者,但两组检出率及浓度分布差异均无统计学意义。 结论 30名发育正常青春期女生血清DBP检出率和浓度中位数均处于较高水平,但无年龄差异,尚不能说明青春期女生血清DBP检出率及浓度分布与初潮年龄的相关性,但值得进一步加大样本量研究。
邻苯二甲酸二丁酯;青春期女生;血清;气相色谱-质谱法
邻苯二甲酸酯(phthalates esters,PAEs)主要作为增塑剂,添加到高分子聚合物如聚氯乙烯(polrvinyl chloride,PVC)中以增强材料的柔韧性和拉伸性,涉及食品加工,装修材料,儿童玩具,婴儿用品,个人护理产品以及医学用途等。PAEs在适当的条件下(如加热)会从材料中缓慢浸出、迁移或蒸发入室内空气或大气,饮用水,食品以及其它介质中[1],造成人类生活环境的普遍污染。美国有毒物质和疾病登记机构(Agency for Toxic Substances and Disease Registry,ATSDR)[2]报告指出布丁、棒冰、华夫饼、鸡蛋蔬菜汉堡的食品包装中均检出邻苯二甲酸二丁酯(Di-nbutyl phthalates,DBP),最高为5 860 mg/kg。PAEs可通过包括消化道、呼吸道、皮肤、静脉和宫内扩散在内的多种途径进入人体并分解成相应的代谢产物,具有抗雄激素作用和可能的类雌激素样作用,是一类公认的环境内分泌干扰物(endocrine disrupting chemicals,EDCs),能够造成机体内分泌、生殖功能的改变,处于生长发育期的儿童尤为敏感[3]。月经初潮是女性性功能发育的最重要的指标,初潮年龄的早晚反映了青春期性功能发育的早晚。为探讨DBP是否影响女孩的性发育,本研究选择广州市某中学30名女生作为研究对象,利用气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)的分析方法检测其血清中DBP水平并探讨其与初潮年龄的相关性。
1 对象与方法
1.1 研究对象及采样
按目的抽样法选取2012年2月广州市白云区某中学健康体检的无超重、肥胖、发育不良、遗传病、代谢性疾病、长期服药等因素的女生作为研究对象,共30人,年龄范围12~15岁,中位数为12岁(单样本KS拟合优度检验显示年龄不服从正态分布),其中已有月经初潮者17人,尚未月经初潮者13人。
早晨空腹静脉采血5 mL,用玻璃针筒和玻璃试管采样和收集,不抗凝,常温存放,送回检验室后冷藏-10℃左右保存。
1.2 气相色谱-质谱分析
1.2.1 仪器与试剂
仪器:QP2010 Plus型气相色谱-质谱联用仪,N-EVAP型氮吹仪,Synergy UV型超纯水系统,漩涡振荡器,离心机。
试剂:DBP标准品(农残级),正己烷(分析纯),并配置成标准储备液待用,于-4℃冰箱中保存,临用时稀释。
1.2.2 定性及定量分析
用DBP 标准品测定其保留时间,样品的定性分析采用与标准品保留时间相对照的方法进行。样品处理后上机分析,根据SIM 模式扫描定量离子149 m/z所得的离子峰面积与样品的标准曲线相比较,通过计算得出样品中含DBP的实际浓度。DBP标准品扫描图谱保留时间为5.46 min。
1.2.3 标准曲线绘制
取正常人血浆6份,每份0.5 mL,分别加入DBP标准品0、0.05、0.25、1.0、2.5、5 μg,使之成为浓度为0、0.1、0.5、2.0、5.0、10.0 μg/mL的系列标准。按样品处理方法处理后进样分析。以149 m/z离子峰面积与浓度进行回归处理。
1.3 统计方法
将GC-MS法所测得的血样DBP的实际浓度,连同体检表上登记的学生的出生日期、初潮日期、身高、体重等人口学信息录入SPSS13.0 进行数据分析,以体检日期(2012年2月27日)为准,计算出学生年龄、初潮年龄及BMI值,使用秩和检验分析不同年龄组以及不同初潮年龄组DBP浓度分布的差异,用t检验比较不同初潮年龄组人口学信息的差异,使用χ2检验确定不同年龄组及不同初潮年龄组DBP的检出率是否存在差别,以P<0.05为差异有统计学意义。
2 结果
2.1 DBP标准曲线
DBP标准曲线为:Y(mg/L)=1.6×10-4X-0.077,r=0.9996。在本实验条件下,HP-5毛细管柱对DBP的最低检出浓度为0.05 μg/mL。标准曲线和样品扫描色谱图见图1、图2。
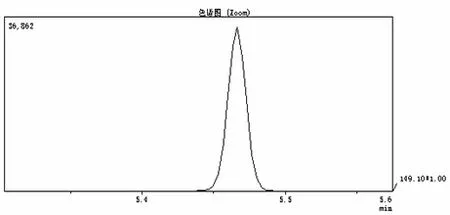
图1 DBP标准曲线SIM扫描色谱图(保留时间:5.46 min)Figure 1 The standard curve of DBP SIM scanningchromatogram (retention time: 5.46 min)

图2 血清样品SIM扫描色谱图(保留时间:5.46 min)Figure 2 Serum samples of SIM scanning chromatogram (retention time: 5.46 min)
30例血清样品中,19例可检出DBP,检出率为63.3%,DBP的浓度中位数为60 μg/L根据研究对象的年龄特征,将其分为两组(12岁和13~15岁),全部样品及不同年龄组血清DBP 的浓度范围、中位数(M)及检出率见表1。从表中可看出,13~15岁组血清DBP浓度中位数及检出率均高于12岁组,但利用两独立样本秩和检验和χ2检验比较组间差异,结果显示差异无统计学显著性(P分别为0.808和0.466)。
2.3 不同初潮年龄组女生血清DBP检出率及浓度分布的差异
2.3.1 初潮年龄组分组依据
有调查显示[4],广东地区汉族女孩2005年初潮年龄的均值为12.4岁,因此本研究据此将调查对象分为两组,初潮年龄<12.4岁,提示青春期性功能发育时间在正常范围内但偏早;初潮年龄≥12.4岁,提示青春期性功能发育时间在正常范围内但偏晚或等于均值。本研究调查对象涉及到已有月经初潮者(17人)和尚未月经初潮者(13人),其中已有月经初潮者的初潮年龄范围为10.8~14.0岁,均值为12.2岁,尚未月经初潮者的预期初潮年龄以体检日期为准估算,均大于12.4岁。因此初潮年龄<12.4岁组8人,初潮年龄≥12.4岁组22人。
2.3.2 不同初潮年龄组女生人口学特征比较
利用两独立样本t检验比较两个初潮年龄组女生的年龄、身高、体重、BMI值是否存在统计学差异,由表2可知,两个初潮年龄组女生的年龄和BMI值无显著性差异(P>0.05),而身高和体重存在显著性差异(P<0.05),且初潮年龄<12.4岁组身高和体重均大于另一组。
表2 不同初潮年龄组女生人口学特征比较(±s)Table 2 Compared of demographic characteristics at different menarche age groups(x±s)
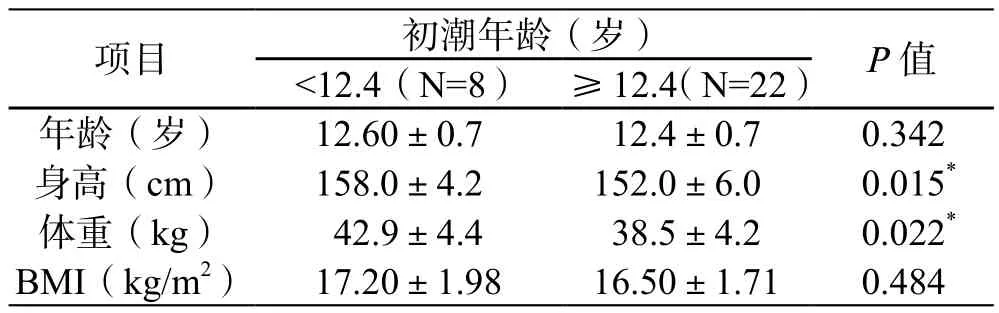
表2 不同初潮年龄组女生人口学特征比较(±s)Table 2 Compared of demographic characteristics at different menarche age groups(x±s)
*表示经t检验,P<0.05
项目初潮年龄(岁)P值<12.4(N=8)≥12.4(N=22)年龄(岁)12.60±0.712.4±0.70.342身高(cm)158.0±4.2152.0±6.00.015*体重(kg)42.9±4.438.5±4.20.022*BMI(kg/m2)17.20±1.9816.50±1.710.484
2.3.3 不同初潮年龄组女生血清DBP检出率及浓度分布的差异
利用χ2检验比较不同初潮年龄组女生血清DBP检出率的差异,结果显示初潮年龄<12.4岁组检出率为75%,初潮年龄≥12.4岁组检出率为86.4%,两组检出率差异无统计学意义(P=0.672)。利用两独立样本秩和检验对不同初潮年龄组DBP浓度分布进行比较,结果显示初潮年龄<12.4岁组血清DBP浓度的平均秩次(15.63)高于初潮年龄≥12.4岁组(15.45),但差异无统计学意义(P=0.962),结果见表3。
示踪剂通常情况选取与工作介质互溶的NaCl或KCl[6],本次模拟采用NaCl作为示踪剂,其相关属性如表1所示。

表1 全部样品及不同年龄组血清DBP浓度分布Table 1 All the samples and the concentrations distribution of serum DBP in different age group
3 讨论
3.1 30名中学女生血清DBP水平
国外关于人群血清DBP水平的文献报道较少,本研究采用GC-MS方法分析30名发育正常青春期女生(12~15岁)血清DBP水平,检出率为63.3%(19/30),浓度中位数为60 μg/L,低于Colón等[5]在PT女童中测定的水平(115 μg/L),但显著高于乔丽丽[6]和李玲[7]等报告的数值(差3个数量级)。
可能有两个方面的原因造成结果的差异,一方面可能与本研究采样地点的选取有关,被调查的中学位于广州市白云区太和镇,处于城乡结合处,且研究对象基本上为本镇居民,周边塑料机械厂、服装厂、包装制品厂、制鞋厂等与塑料橡胶相关的制造业密集,使得该地区环境本底(大气,水,土壤)中有较高浓度的PAEs负荷,因此在女童血清中检出较高水平的DBP。另一方面,不同研究所使用的分析方法、操作条件以及质控效果的不同也会对结果造成影响,使得相互之间的可比性降低。例如在Colón等[5]的研究中,研究者分别选用GC-MS方法的全扫描和SIM两种模式对PT组的34~41号样品进行分析,发现SIM模式具有更高的选择性和较低的检测和定量限,使得检出率和检出的浓度值与全扫描模式相比都有所增加。
此外,由于塑料制品的广泛使用,本研究利用正常人血清加入标准品配置成标准溶液来绘制标准曲线,虽然扣除了空白血清的背景值,但在采血和分析过程(如空气中的塑料粉尘,气相色谱进样瓶使用的橡胶隔片等)中仍然无法避免潜在的样品污染,可能对实验结果造成一定的影响,尽管如此,由于空白血清的采集和分析条件全部与样品保持一致,这在一定程度上减小了影响的程度,提高了结果的可靠性。
另外,对不同年龄组血清DBP水平及检出率进行比较,发现13~15岁组血清DBP浓度中位数和检出率均高于12岁组,因为样本量较小,所以未能发现有无统计学差异,但提示高年龄组血清DBP水平和检出率可能高于低年龄组,确切结论尚需更大样本和年龄跨度的人群调查予以证明。
3.2 青春期前及青春期女生PAEs暴露水平与性发育的关系
EDCs是环境中存在的一类天然或人工合成的化学物,它们能够模仿或阻断激素,从而改变机体内正常的激素水平和内分泌功能。PAEs是公认的EDCs,主要表现为抗雄激素效应[2]。很多动物毒理学试验试图揭示PAEs暴露与雌性生殖系统效应的关系。
在本研究中,以广东地区汉族女孩2005年初潮年龄的均值12.4岁为准,将调查对象分为两组(初潮年龄<12.4岁组和初潮年龄≥12.4岁组),利用χ2检验比较不同初潮年龄组女生血清DBP检出率的差异,结果显示初潮年龄<12.4岁组检出率为75%,初潮年龄≥12.4岁组检出率为86.4%,且前者血清DBP浓度的平均秩次(15.63)高于后者(15.45),提示初潮年龄越早,血清DBP检出率及浓度越高,但两组检出率及浓度分布的差异均无统计学意义,因此尚不能说明青春期女生血清DBP检出率及浓度分布与初潮年龄的相关性,而月经初潮是女性性功能发育的最重要的指标,主要由雌激素引发,初潮年龄的早晚反映了青春期性功能发育的早晚,因此本研究尚不能证明PAEs暴露与女生青春期发育的相关性,尚需更大样本量和初潮年龄跨度的人群研究。
本研究未能证实PAEs暴露与性发育无相关性,笔者认为有以下可能的解释或假设:(1)与近年来动物毒理学试验所观察到的结果一致,PAEs在体内条件下可能并没有显著的临床拟雌激素效应,而EDCs主要表现为抗雄激素效应。(2)与PT和CPP产生机制有关。PT是不完全性中枢性性早熟的一种,属CPP的变异,是HPG轴的部分提前激活,多呈自限病程,大多数患儿乳房可于数月内自行消退。但近年研究发现部分PT患儿可转化为CPP,转化率为14.0%~18.4%,转化率因发病年龄而异,2岁以后起病者转化的风险性增加,因此需定期随访[8]。PAEs可能通过某种机制导致HPG轴的部分活化而引起自限性的PT而不引起进展性的CPP,而这种机制可能与类雌激素效应无关。(3)台湾的吴喻敏[9]关于PAEs暴露和Kisspeptin-54的释放与女生性发育关系研究表明,PAEs可能通过刺激Kisspeptin-54的释放影响女生青春期的启动,并且涉及到HPG轴的活化,笔者认为这有可能成为研究PAEs与青春期性发育关系的一个新的切入点。本研究虽然因为样本量小而未能确定DBP与女孩青春期发育的关系,但是结果仍提示DBP可能与女孩青春期发育有关。

表3 不同初潮年龄组女生血清DBP检出率及浓度分布的差异Table 3 DBP detection rate and concentration distribution in different menarche age groups
3.3 进一步研究的建议
3.3.1 本研究的局限性
本研究属于横断面调查,DBP是非持久性化学物,在体内迅速被水解为DMP及其葡糖苷酸结合物,进而从尿液排出,消除半衰期小于24 h[10], 而暴露的测量仅依赖于单次采血,且不清楚采样对象暴露来源相对贡献的大小(不同暴露来源的接触途径不同,DBP水解和吸收率不同),这就使得血清DBP水平在个体内以及个体间存在较大的变异,尽管在本研究中两组间的差异并不显著,这种变异可能导致研究组与对照组的差异,形成虚假关联,影响结果评价。
本研究的研究对象虽然涵盖已有月经初潮者和尚未月经初潮者,但均属正常女生,为了探究血清DBP水平与初潮年龄的相关性,将研究对象以广东地区汉族女孩2005年初潮年龄的均值12.4岁分为两组,但初潮年龄跨度不大,且尚未月经初潮者的初潮年龄不易确定,只能粗略估计,可能使研究对象缺乏代表性,这一定程度上影响了比较的结果。
由于经费的限制,本研究样本量较小(30例),结果显示13~15岁组血清DBP浓度中位数和检出率均高于12岁组,初潮年龄<12.4岁组血清DBP浓度的平均秩次(15.63)高于初潮年龄≥12.4岁组(15.45)且检出率前者为75%,后者为86.4%,但均无统计学差异。推知我们招募的研究对象可能不足以发现不同年龄组及不同初潮年龄组间PAEs水平的差异。
两个初潮年龄组女生的年龄和BMI值无显著性差异,而身高和体重存在显著性差异,且初潮年龄<12.4岁组身高和体重均大于另一组,而文献显示[5]初潮年龄与女性的营养状况相关,可能使得初潮年龄<12.4岁组检出率(75%)高于初潮年龄≥12.4岁组(86.4%)无统计学差异,这一定程度上干扰了PAEs与初潮年龄的真实关联。
不同初潮年龄组女生血清DBP检出率及浓度分布的差异均无统计学意义(P分别为0.672和0.962),因此尚不能说明青春期女生血清DBP检出率及浓度分布与初潮年龄的相关性,而月经初潮是女性性功能发育的最重要的指标,初潮年龄的早晚反映了青春期性功能发育的早晚,因此本研究尚不能证明暴露PAEs与女生性发育的相关性。今后的研究中应当根据横断面调查的需要扩大样本量,以尿液中几种PAEs代谢物作为暴露生物学标志物,进行更大规模的人群PAEs暴露水平监测,并从中选取有代表性的研究对象(如细分为不同的初潮年龄组,并匹配其他与初潮年龄相关的因素)分析PAEs暴露与性发育的关系。
3.3.2 人群PAEs暴露水平监测
近年来国外关于人群PAEs暴露评价首选的生物样品是尿液,测定其代谢物的浓度作为暴露标志物并用肌酸酐标化后进行比较,这是因为尿液中代谢物水平往往比在其他介质如血清中发现的母体化合物更高,因此也更容易准确测定。Koch等[11]研究德国人群尿样中PAEs二级代谢物,发现研究人群均能测出。再者,通过测定代谢物,在样品采集、保存和分析过程中发生意外污染的风险也大大降低,且代谢物一般被认为是生物活性分子。虽然这样仍无法避免DBP代谢物半衰期较短的特性,但假定PAEs暴露的来源和形式是不变的,单一的测量还是能够反映6个月内的典型暴露[10]。本研究由于经费限制,只测定了血清中一种PAEs(DBP)的浓度,在今后的研究中可以选用尿液中几种PAEs代谢物作为暴露标志物,如Lorber等[12]在DEHP的PBPK模型中,以MEHO/50HMEHP为标志物进行监测,更为准确可靠,同时易于与国际间结果进行比较。同时,可以加强对分析方法的优化,提高回收率和精密度,比较不同分析方法(如高效液相色谱法和GC-MS)检出水平的差异。
PAEs与塑料的结合不是一种化学结合,而是物理结合,在使用过程中通过直接释放、迁移、淋溶和磨损被不断释放到环境中,成为全球性的重要环境污染物,导致人群广泛、持续暴露于PAEs[13~14]。通过与国内其他研究小组的结果进行比较发现,本研究所测得的女生血清DBP水平较高,在今后的研究中应该注意对血清DBP水平影响因素的分析,例如通过问卷调查女生的生活习惯(如洗发液等个人护理品的使用情况,是否有涂指甲油的习惯)、饮食习惯(如是否经常食用塑料包装食品和饮用软饮料)等,并结合环境本底资料进行综合分析。
在今后的研究中需要注意扩大样本量,按照现况调查样本量计算方法,欲达到本研究63.3%的检出率,样本量需要达到232人,考虑可能出现的失访、不应答等因素,应适当增加10%样本量,因此最终样本量应该大约为260~300人,并结合实际情况采用分层整群抽样的方法进行抽样。
3.3.3 与性发育关系的研究
从横断面调查抽取的人群中选取有代表性的研究对象,即选定为已有月经初潮者,通过调查问卷准确询问其初潮时间,考虑初潮年龄的跨度,并将其分为三组或以上,同时匹配组间的年龄、身高、体重、BMI值、母亲初潮年龄等可能与初潮年龄相关的因素,进而比较组间PAEs水平的差异,发现初潮年龄与PAEs暴露的真实关联。
[1] Heudorf U, Mersch-Sundermann V, Angerer J. Phthalates: toxicology and exposure[J]. Int J Hyg Environ Health, 2007, 210(5): 623-634.
[2] ATSDR. Toxicological profile for di(2-ethylhexyl) phthalate[R]. U.S. Departmen of Health and Human Services, Public Health Service, Agency for Toxic Substances and Disease Registry, 2002, 147(3): 198-200.
[3] Main K M, Mortensen G K, Kaleva M M, et al. Human breast milk contamination with phthalates and alterations of endogenous reproductive hormones in infants three months of age[J]. Environ Health Perspect, 2006, 114(2): 270-276.
[4] 赵继. 我国女孩月经初潮年龄影响因素的循证分析及其近二十年来的变化趋势[D]. 苏州大学, 2011.
[5] Colón I, Caro D, Bourdony C J, et al. Identification of phthalate esters in the serum of young Puerto Rican girls with premature breast development[J]. Environ Health Perspect, 2000, 108(9): 895-900.
[6] 乔丽丽, 蔡德培, 申建伟, 等. 正常儿童血清中邻苯二甲酸二丁酯和邻苯二甲酸-2-乙基己酯水平的测定[J]. 卫生研究, 2010, 39(4): 501-503.
[7] 李玲, 田晓梅, 张霞, 等. 育龄期妇女血清中4种邻苯二甲酸酯类暴露水平的研究[J]. 环境与健康杂志, 2011, 28(9): 792-794.
[8] Swan S H. Environmental phthalate exposure in relation to reproductive outcomes and other health endpoints in humans[J]. Environ Res, 2008, 108(2): 177-184.
[9] 吴喻敏. 邻苯二甲酸酯暴露程度与Kiss-1、GPR54基因多型性对性早熟女童之影响研究[D]. 成功大学环境医学研究所, 2010.
[10] Wilson V S, Lambright C, Furr J, et al. Phthalate esterinduced gubernacular lesions are associated with reduced insl3 gene expression in the fetal rat testis[J]. Toxicol Lett, 2004, 146(3): 207-215.
[11] Koch H M, Rossbach B, Drexler H, et al. Internal exposure of the general population to DEHP and other phthalatesdetermination of secondary and primary phthalate monoester metabolites in urine[J]. Environ Res, 2003, 93(2): 177-185.
[12] Lorber M, Angerer J, Koch H M. A simple pharmacokinetic model to characterize exposure of Americans to di-2-ethylhexyl phthalate[J]. J Expo Sci Environ Epidemiol, 2010, 20(1): 38-53.
[13] Guo Y, Alomirah H, Cho H S, et al. Occurrence of phthalate metabolites in human urine from several Asian countries[J]. Environ Sci Technol, 2011, 45(7): 3138-3144.
[14] Ferguson K K, Loch-Caruso R, Meeker J D. Urinary phthalate metabolites in relation to biomarkers of inflammation and oxidative stress: NHANES 1999-2006[J]. Environ RES, 2011, 111(5): 718-726.
A pilot survey on correlation between serum di-n-butyl phthalate level and menarche age among 30 puberty girls in Guangzhou
HE Zhanming1★, MA Mengmeng2, CHEN Qing2, TAN Bingyan3
(1.Center for Disease Prevention and Control of Baiyun District Guangzhou, Guangdong, Guangzhou 510445, China; 2.School of Public Health and Tropical Medicine, Southern Medical University, Guangdong, Guangzhou 510515, China; 3. Experimental Center, School of Public Health, Sun Yat-Sen University, Guangdong, Guangzhou 510080, China)
Objective To determine the exposure level of serum di-n-butyl phthalate (DBP) in healthy puberty girls aged 12 to 15 years in Guangzhou and study the relationship between DBP exposure and menarche age. Methods The serum samples were collected intravenously from 30 puberty girls who were identified as normal in their school physical examination in March 2012 in Baiyun District of Guangzhou City, aged 12 to 15. For serum DBP level determination, gas chromatography-mass spectrometry method was established. Girls were divided into two groups using menarche age 12.4 which was the mean of the Guangdong Han nationality girls in 2005 as a cut-point, one was the group with menache age early than 12.4 and the rest belonged to the other one. Then detection rate and concentration distribution of DBP between the two groups were analyzed. Results DBP could be detected in 19 serum samples from total 30 samples and the rate of detection was 63.3%. The concentrations of DBP ranged from non detectable to 740 μg/L with the median of 60 μg/L while no variation was found by age. The rate of detection in group with menache age early than 12.4 was 75% while the other one was86.4% and the former had a higher mean rank of DBP concentration. However, the differences showed no statistical significance between the two group (P=0.672 andP=0.962, respectively). Conclusion The detectionrate and serum median concentration of DBP of the 30 normal puberty girls were both in high level with no variation by age and no association was found between serum DBP exposure and menarche age in puberty girls.
Di-n-butyl phthalate; Puberty girls; Serum; Gas chromatography-mass spectrometry
广州市医药卫生科技(2012A011183)
1.广州市白云区疾病预防控制中心,广东,广州 510445 2.南方医科大学公共卫生与热带医学学院,广东,广州 510515 3.中山大学公共卫生学院实验教学中心, 广东,广州 510080
★通讯作者:何展明,E-mail:2370943@qq.com