FTO基因单核苷酸多态性与2型糖尿病发病风险的相关性研究
2013-07-18胡嘉乐黄婉娴高洋朱安娜孙敏英杨学习
胡嘉乐黄婉娴高洋朱安娜,孙敏英,杨学习★
•论 著•
FTO基因单核苷酸多态性与2型糖尿病发病风险的相关性研究
胡嘉乐1黄婉娴1高洋1朱安娜1,2孙敏英1,2杨学习1★
目的探讨FTO(fat mass and obesity associated)基因单核苷酸多态性(single nucleotide polymorphism, SNP)与中国人群Ⅱ型糖尿病(Type Ⅱ Diabetes Mellitus, T2DM)易感性的关系。方法利用Sequenom MassArray®iPLEX系统对238例T2DM患者及239例健康对照的FTO基因单核苷酸多态性位点rs8050136进行基因分型,并对检测结果根据共显性、显性模型、超显性和隐性模型进行χ2检验和非条件Logistic回归分析。结果FTO基因rs8050136位点在病例组和对照组的基因型频率分布差异在显性模型和超显性模型中有显著性(χ2= 8.603,P= 0.003;χ2= 5.428,P= 0.02)。相对CC基因型而言,CA杂合型和CA-AA基因型均能增加T2DM发病的危险性,(OR=1.751, 95%CI: 1.129~2.717,P=0.012;OR=1.915, 95%CI: 1.241~2.954,P=0.003);而两组间等位基因频数分布也有显著性差异(χ2= 10.614,P= 0.001),相对于C位点而言,A位点是T2DM的危险等位位点,(OR=1.933, 95%CI: 1.298~2.880,P=0.001)。结论FTO基因单核苷酸多态性rs8050136与T2DM的发病风险相关,CA杂合型和CA-AA基因型可显著增加T2DM的发病风险。
FTO;单核苷酸多态性;Ⅱ型糖尿病;易感性
无论是在发达国家还是发展中国家,糖尿病正以迅速发展的势头成为现代社会的流行病,是继肿瘤、心脑血管疾病之后第三位威胁人类健康的非传染性重大疾病。WHO公布,至2000年全世界约有1.71亿糖尿病患者,预计2030年全球的糖尿病患者总数将达到3.66亿[1]。目前全球糖尿病患者已超过1.2亿人,我国患者人群居世界第二[2],据国家卫生部调查显示,我国每天约新增3000例,每年约增加120万糖尿病患者,其中约95.00%为Ⅱ型糖尿病(Type ⅡDiabetes Mellitus, T2DM)患者[3]。
T2DM具有发病的隐匿性,相当多的患者是因为出现并发症的临床表现才被确诊有糖尿病。多数患者病程较长,随着病情的进展常出现全身多个脏器的损害,严重者则因糖尿病并发症而致残和死亡。糖尿病不仅给患者造成痛苦,也给家庭和社会带来沉重的负担。
T2DM是胰岛素抵抗和β细胞分泌缺陷导致高血糖的代谢性疾病,是一种典型的多基因遗传性疾病,是环境因素和遗传因素共同作用的结果。至今,T2DM还没有充分明确的致病机制。家族聚集性、同卵双生子发病的一致性较高以及在某些种族人群中的高发病率均提示T2DM具有明显的遗传易感性。
作为第三代遗传标记,单核苷酸多态性(single nucleotide polymorphism,SNP)高密度存在于全基因组范围。SNP是指基因组内某一特定核苷酸位置上存在2种(或2种以上)不同的碱基,其中最少一种在群体中的频率不小于1%。在人类基因组中,绝大多数SNP在一个位点仅有2种等位基因,因此通常所说的SNP是指在某一核苷酸位置上的双等位基因(biallelic)改变。SNP与第一、第二代遗传标记相比,其数量丰富,稳定性强,更有利于自动化和规模化分析。随着人类基因组计划和国际HapMap计划的相继完成,为包括T2DM在内的复杂疾病易感基因的发现提供了新的更有效的手段和技术。全基因组关联研究(genome-wide association study,GWAS)是其主要代表。GWAS仅用简单的频率检验便可发现与特定复杂疾病相关联的遗传变异[4]。通过GWAS研究,已在欧洲人群中发现多个易感基因和易感位点与T2DM具有显著关联性[5,6],主要的易感基因有TCF7L2、FTO、CDKAL1、IGF2BP2、SLC30A8等。但中国人群与欧洲人群具有不同的遗传背景、生活习惯及文化习俗,在糖尿病的病因发病机制方面与欧洲人群存在差异。虽然也有应用日本人群的GWAS研究,然而中国成人Ⅱ型糖尿病的胰岛功能特点不仅不同于欧洲患者,和日本等亚洲患者也不尽相同[7]。因此,在中国人群中进行易感基因多态性位点与T2DM发病风险关系的探索,不仅有助于揭示糖尿病的致病机制,也为制定区域化的防治策略和个体化治疗方案提供数据基础。
FTO(fat mass and obesity associated)基因又称为肥胖基因,位于第16 条染色体(16q12.2),含有9个外显子,基因长度为410.50 kb,广泛表达于人体组织的各发育阶段,且在下丘脑、骨骼肌及脂肪等组织中高度表达[8]。根据GWAS文献报道,FTO基因多态性在芬兰和英国人群中与T2DM有显著关联[9,10],而在国内对FTO基因与T2DM患病风险的相关性研究较少。本文选取了FTO基因rs8050136 SNP位点,利用Sequenom MassArray®iPLEX系统,对238例糖尿病患者及239例健康对照者进行基因分型,旨在通过病例对照研究,在中国人群中探讨FTO基因单核苷酸多态性与Ⅱ型糖尿病发病风险的相关性,为T2DM提供数据支持和奠定理论基础。
1 材料和方法
1.1 材料和试剂
确诊T2DM患者血液样本238例,平均年龄为58.27岁。同期该地区体检健康者血液样本239例,无糖尿病相关病史,无其他代谢性疾病病史,平均年龄为56.12岁。样本为外周静脉血200 μL,置于-20℃保存。DNA提取试剂盒购自OMEGA公司,基因分型试剂盒购自美国Sequenom公司。
1.2 方法
1.2.1 DNA的提取
用DNA提取试剂盒(OMEGA Bio-TeK,E.Z.N.A. Blood DNA Kit)提取DNA,步骤参照说明书,提取的DNA保存于-70℃备用。
1.2.2 引物的设计
针对FTO基因SNP位点rs8050136,利用Sequenom MassArray®Assay Design 3.1软件设计PCR扩增及延伸引物。其中特异性扩增引物序列为5'-ACG TTGGATGAAGGCAAAAACCACAGGCTC-3'和5'-AC GTTGGATGTGACAGTGCCAGCTTCATAG -3',单碱基延伸引物为5'-GGGCAACCACAGGCTCAGATATT -3'。
1.2.3 基因分型
利用Sequenom MassArray质谱阵列技术(美国,Sequenom公司)对FTO基因rs8050136位点进行基因分型。方法如下:①多重PCR反应扩增DNA样本;②虾碱性磷酸酶(shrimp alkaline phosphatase,SAP)反应,去除未反应完的dNTP;③单碱基延伸反应(single base extension, SBE)在SNP位点处延伸单个碱基;④将所得反应产物用树脂脱盐后经自动点样仪点样于SpectroCHIP芯片上;⑤将点制后的芯片用基质辅助激光解析电离飞行时间质谱(MALDI-TOF MS)检测,根据单碱基延伸的等位基因的分子质量差异进行基因分型。
1.2.4 数据分析
分别统计病例组和对照组基因型分布频率,经Hardy-Weinberg平衡检验后,用SPSS13.0软件进行分析,应用χ2检验分析病例组和对照组基因型的分布差异,计算其相应的OR值及P值,检验水准为0.05。
2 结果
2.1 rs8050136多态性与T2DM易感性的关系
rs8050136位点在病例组和对照组中有CC、CA和AA三种多态性(图1)。rs8050136位点的基因型分布及统计结果见表1。CC、CA和AA三种基因型在病例组的分布频率分别为70.6%(n=168)、26.9%(n=64)和2.5%(n=6),而在对照组分布频率分别为82.0%(n=196)、18.0%(n=43)和0.0%(n=0);等位位点A和C的分布频率在病例组分别为0.16和0.84,而在对照组的分布频率分别为0.09和0.91。统计结果显示2组间基因型频率分布差异在显性模型和超显性模型中有显著性(χ2= 8.603,P= 0.003;χ2= 5.428,P= 0.02)。在显性模型中,相对CC基因型而言,CA-AA基因型均可能增加Ⅱ型糖尿病发生的危险性(OR =1.915, 95% CI: 1.241~2.954, P =0.003);在超显性模型中,相对CC-AA基因型而言,CA基因型可能增加T2DM发生的危险性(OR =1.689, 95% CI: 1.090~2.615, P =0.019)。而2组间等位基因频数分布有显著性差异(χ2=10.614, P=0.001)。
3 讨论

图1 FTO基因rs8050136多态位点CC、CA和AA基因型的特征质谱图Figure 1 Schematic of the CC, CA and AA polymorphism of rs8050136 in FTO
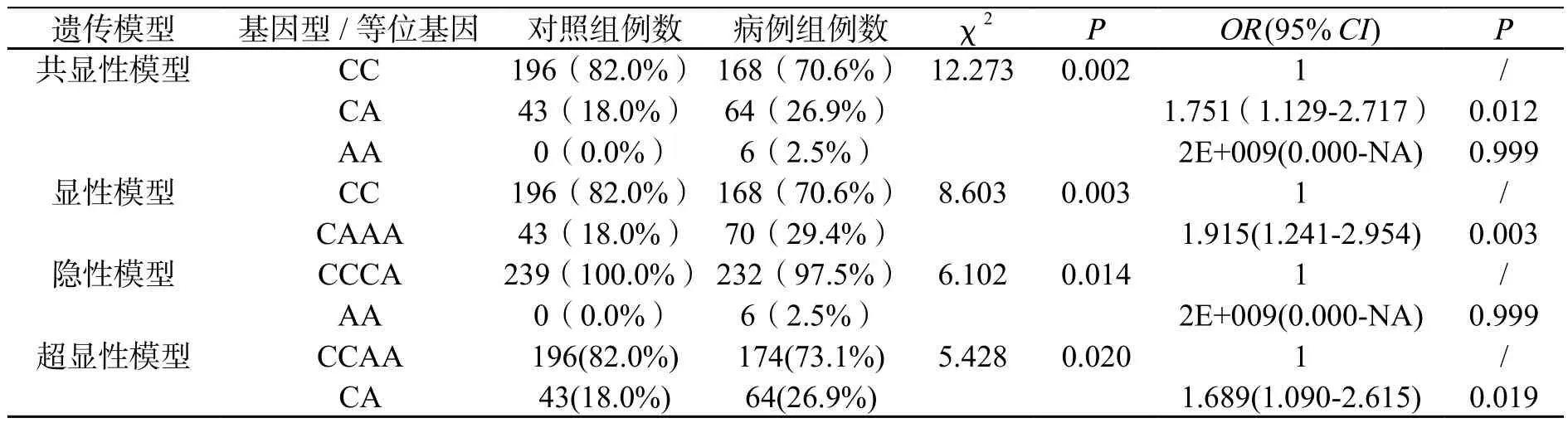
表1 rs8050136 SNP位点多态性及其与T2DM风险的关系Table 1 The relationship between SNP of rs8050136 and susceptibility of T2DM
FTO基因编码一种酮戊二酸(2-oxoglutarate, 2OG)依赖的核酸去甲基化酶。Fawcett和Barroso[11]认为FTO所具有的这种去甲基化作用可能调节了某些代谢相关基因,而这些作用的失调可能与T2DM有关,但其确切的分子机制尚不清楚。较早调查发现FTO多态性与其他众多肥胖并发症存在关联,在众多并发症中,FTO多态性与T2DM的关系最引人关注。Frayling[12]等发现FTO多态性可以通过作用身体质量指数(Body Mass Index,BMI)使T2DM风险增加,一旦调整BMI后FTO多态性与T2DM即失去关联,提示T2DM可能仅仅因为是肥胖并发症而与FTO多态性相关联的。相反,Yajnik等[13]在对印度人群的研究中发现,SNP位点rs9939609风险等位位点A与T2DM有很强的独立相关性,即使在对BMI进行校正后FTO多态性与T2DM的关联仍显著。
本研究采用病例-对照的研究,选取FTO基因上的SNP位点rs8050136,通过对238例T2DM患者和239例健康对照者进行基因分型,发现位点rs8050136与T2DM的发病风险显著相关。对rs8050136位点来说,相对于基因型CC而言,CA杂合型和CA-AA基因型均能显著性增加患病的危险性,而其等位基因在病例组和对照组间的频数分布也有显著性差异。该结果与Scott等[9]的GWAS研究结果相似。此外,根据Han等[14]的研究显示,rs8050136位点的多态性与BMI有显著的关联,在rs8050136位点上带有1个或2个等位位点A的个体,比不带有等位位点A的个体有更高的BMI。同时,Hotta等[15]的研究也显示,在日本人群中rs8050136位点的多态性能显著性增加个体患代谢综合征的风险,提示rs8050136的多态性可能通过改变机体整体代谢能力,从而影响糖的代谢作用,引起T2DM。而根据Jowett等[16]的研究,rs8050136位点的多态性与T2DM患病风险有直接的关联,但rs8050136位点的多态性本身并不影响FTO基因的有效表达,而是与距离FTO基因270 000个碱基对的RBL2(retinoblastoma-like protein 2)的表达有直接的关联。GWAS研究发现RBL2与T2DM的发病有着密切的关系[17],但其具体机制仍不清楚。Stratigopoulos等[18]研究发现CUTL1影响FTO基因的表达,而FTO基因rs8050136位点刚好位于CUTL1调控蛋白的结合位点上。rs8050136位点的单核苷酸多态性则会直接影响CUTL1与FTO基因的结合效率,从而影响FTO基因的表达而间接改变机体的整体代谢能力,其中等位位点A比等位位点C在CUTL1与FTO基因的结合效率更强。
综上所述,通过对中国人群238例T2DM患者和239例健康对照者FTO基因SNP位点rs8050136的基因分型及统计分析,发现在中国人群中FTO基因多态性位点rs8050136与T2DM的发病风险相关。其中rs8050136位点CA基因型和CA-AA基因型可显著增加T2DM的发病风险。
[1]Wild S, Roglic G, Green A, et al. Global prevalence of diabetes: estimates for the year 2000 and projections for 2030[J]. Diabetes Care, 2004, 27(5): 1047-1053.
[2]代庆红, 王忠东. 中国糖尿病的现状调查[J]. 中国医药指南, 2011, 9(13): 206-208.
[3]People's Daily Online. China has annual increase of 1.2 million diabetes patients [EB/OL]. http://english.peopledaily. com.cn/200011/14/eng20001114_55162.html, 2008-02-29.
[4]丁晓慧, 杨泽. 2型糖尿病易感基因研究进展[J]. 中国糖尿病杂志, 2010, 18(4): 311-313.
[5]Zeggini E, Scott L J, Saxena R, et al. Meta-analysis of genome-wide association data and large-scale replication identifies additional susceptibility loci for type 2 diabetes[J]. Nat Genet, 2008, 40(5): 638-645.
[6]Tsai F J, Yang C F, Chen C C, et al. A genome-wide association study identifies susceptibility variants for type 2 diabetes in Han Chinese[J]. PLoS Genet, 2010, 6(2): e1000847.
[7]蔡梦茵. 亚洲糖尿病遗传研究的特色[J]. 国际学术动态, 2010, 1: 23-24.
[8]杨曦, 沈沭彤, 郭军. 肥胖症易感基因-FTO的研究进展[J].生命科学, 2011, 23(5): 459-464.
[9]Scott L J, Mohlke K L, Bonnycastle L L, et al. A genomewide association study of type 2 diabetes in Finns detects multiple susceptibility variants[J]. Science, 2007, 316(5829): 1341-1345.
[10]Zeggini E, Weedon M N, Lindgren C M, et al. Replication of genome-wide association signals in UK samples reveals risk loci for type 2 diabetes[J]. Science, 2007, 316(5829): 1336-1341.
[11]Fawcett K A, Barroso I. The genetics of obesity: FTO leads the way[J]. Trends Genet, 2010, 26(6): 266-274.
[12]Frayling T M, Timpson N J, Weedon M N, et al. A common variant in the FTO gene is associated with body mass index and predisposes to childhood and adult obesity[J]. Science, 2007, 316 (5826): 889-894.
[13]Yajnik C S, Janipalli C S, Bhaskar S, et al. FTO gene variants are strongly associated with type 2 diabetes in South Asian Indians[J]. Diabetologia, 2009, 52(2): 247-252.
[14]Han X, Luo Y, Ren Q, et al. Implication of genetic variants near SLC30A8, HHEX, CDKAL1, CDKN2A/B, IGF2BP2, FTO, TCF2, KCNQ1, and WFS1 in type 2 diabetes in a Chinese population[J]. BMC Med Genet, 2010, 11: 81.
[15]Hotta K, Kitamoto T, Kitamoto A, et al. Association of variations in the FTO, SCG3 and MTMR9 genes with metabolic syndrome in a Japanese population[J]. J HUM Genet, 2011, 56(9): 647-651.
[16]Jowett J B, Curran J E, Johnson M P, et al. Genetic variation at the FTO locus influences RBL2 gene expression[J]. Diabetes, 2010, 59(3): 726-732.
[17]Wellcome trust case control consortium. Genome-wide association study of 14 000 cases of seven common diseases and 3,000 shared controls[J]. Nature, 2007, 447(7145): 661-678.
[18]Stratigopoulos G, Padilla S L, LeDuc C A, et al. Regulation of Fto/Ftm gene expression in mice and humans[J]. Am J Physiol Regul Integr COMP Physiol, 2008, 294(4): 1185-1196.
The association study between single nucleotide polymorphisms of FTO and susceptibility of T2DM
HU Jiale1, HUANG Wanxian1, GAO Yang1, ZHU Anna1,2, SUN Minying1,2, YANG Xuexi1★
(1. Institute of Antibody Engineering, School of Biotechnology, Southern Medical University, Guangdong Guangzhou 510515, China;2. DAAN Gene Co., Ltd. of Sun Yat-sen University, Guangdong, Guangzhou 510665, China)
Objective To evaluate the association between single nucleotide polymorphism (SNP) ofFTO(fat mass and obesity associated) and susceptibility of Type Ⅱ Diabetes Mellitus (T2DM). Methods
The single nucleotide polymorphism rs8050136 ofFTOwas detected via Sequenom MassArray®iPLEX System in 238 T2DM patients and 239 healthy controls for the frequencies of their alleles and genotypes. Data were analyzed via Chi-square test and Logistic regression analysis by codominant, dominant, overdominant, and recessive model. Results The frequencies of genotypes of rs8050136 in both dominant and overdominant model shown significant difference in the distribution between T2DM patients and healthy controls (χ2= 8.603,P= 0.003; χ2= 5.428,P= 0.02). The odds ration (OR) of CA and AA-CA were 1.751 (95%CI: 1.129~2.717,P=0.012), and 1.915 (95%CI: 1.241~2.954,P=0.003), shown significantly increased the risk of developing T2DM in comparison with CC genotype. The frequencies of alleles (C and A) of rs8050136 shown significantly difference (χ2= 10.614,P= 0.001). TheORof A was 1.933 (95%CI: 1.298~2.880,P=0.001), shown that the A allele maybe the risk allele of T2DM in comparison with C allele. Conclusions The CA and CA-AA genotypes of rs8050136 inF
TOwere associated with increased the risk of T2DM in Chinese population, and the A allele of rs8050136 were the risk allele of T2DM.
FTO; Single nucleotide polymorphism; T2DM;Susceptibility
广州市科技攻关计划(2008A1-E4151)
1. 南方医科大学生物技术学院抗体工程研究所,广东,广州 510515 2. 中山大学达安基因股份有限公司,广东,广州 510665
★通讯作者:杨学习,E-mail: yxxzb@sohu.com
