母体来源人胎盘间充质细胞的分离培养及其分化能力的研究
2013-07-07马晓娜金毅然王立斌
马晓娜 刘 婷 金毅然 王立斌 魏 军*
(宁夏医科大学总医院宁夏人类干细胞研究所,宁夏 银川 750004)
母体来源人胎盘间充质细胞的分离培养及其分化能力的研究
马晓娜 刘 婷 金毅然 王立斌 魏 军*
(宁夏医科大学总医院宁夏人类干细胞研究所,宁夏 银川 750004)
目的 探讨胎盘母体来源间充质细胞的分离、培养方法及其向脂肪和成骨诱导分化潜能。方法 采用酶消化获得母体来源胎盘间充质干细胞;体外扩增后,利用流式细胞仪检测其表面标志物;进行诱导分化后,采用油红O及茜素红染色鉴定其向脂肪和成骨诱导分化潜能。结果 体外培养的母体来源胎盘间充质干细胞呈长梭形,细胞形态均一;细胞表面标志鉴定:CD73、CD90和CD105呈阳性表达,而CD14、CD34、CD45和HLA-DR呈阴性表达;细胞诱导分化后,经油红O、茜素红染色证实其可分化为脂肪细胞和成骨细胞。结论 建立了母体来源胎盘间充质干细胞的分离培养方法;证实其具有成脂、成骨分化潜能,有望成为细胞治疗及组织工程更为理想的种子细胞。
母体来源胎盘间充质细胞;脂肪细胞;成骨细胞
间充质细胞(mesenchymal stem cells,MSCs)是来源于成熟组织中的多能干细胞,具有高度自我更新能力和多向分化潜能,是细胞移植和组织工程的新型种子细胞,其中研究最为广泛的MSCs来源于骨髓[1],与骨髓取材相比胎盘在胎儿娩出后即成为“废弃”物,取材方便,同时胎盘易于分离,征得同意后不涉及伦理道德问题,因而可能成为一种理想的再生医学资源。
本文利用产妇生产后的胎盘,分离出与产妇本人组织配型相同的间充质细胞,并通过定向诱导分化确定其多能性,将使产妇保存其自身的干细胞成为可能。
1 材料与方法
1.1 实验材料
胎盘组织取自宁夏医科大学总医院产科临床足月剖宫产胎盘,产妇及其家属知情同意,并签署知情同意书。
1.2 主要仪器及试剂
流式细胞仪(BD),倒置显微镜(Olympus) ,鼠抗人单克隆抗体IgG2a-FITC、IgG1-PE、CD73- PE、CD105-PE、CD14-FITC、CD34-FITC、CD45-FITC、CD90-FITC和HLA-DR-FITC(BD),FBS、L-DMEM,collagenase A、DNase I(ROCHE),脂肪细胞诱导分化培养基(DMEM 加入10%FBS、10μg/mlinsulin、1uM dexamethasone、1mM 3-isobutyl-1-methylxanthine、60uM indomethacin);成骨细胞诱导分化培养基(DMEM 加入10%FBS,100nM dexamethasone、10mM beta-glycerophosphate、0.05mM ascorbic acid-2-phosphate)。
2 实验方法
2.1 母体来源胎盘间充质细胞的分离提取
剪取胎盘母体侧蜕膜组织,PBS漂洗数次后,将组织剪碎转于50mL离心管中,加入0.1%collagenase A在37℃水浴消化2h,消化后的细胞悬液过100目细胞筛网,离心后重悬于培养基中,培养48h后换液。当细胞融合率达80%时消化传代。
2.2 细胞生长曲线的测定
设定检测时间点为:0h、12h、24h、36h、48h、60h、72h、84h、96h、108h、120h。选取第三代对数期的细胞,以1×105个/孔的密度接种于96孔板中,设6个平行孔。MTT测定细胞生长曲线。
2.3 流式细胞仪检测细胞表面标志物的表达
选取第三代细胞,以细胞浓度为1×107/mL,0.1mL/管,分别加入鼠抗人单克隆抗体 CD73-PE、CD90-PE、CD105-PE、CD14-PE、CD34-FITC、CD45-PE、HLA-DR-PE、IgG2a-FITC、IgG1-PE,流式细胞仪检测。
2.4 母体来源胎盘间充质细胞向脂肪和向成骨细胞诱导分化及鉴定
选取第三代细胞,当细胞融合率达80%时将培养基更换为脂肪细胞诱导分化培养基,每3d换液,诱导12d后油红O染色鉴定。选取第三代细胞,当细胞融合率达80%时将培养基更换为成骨细胞诱导分化培养基,每3d换液,诱导14d后茜素红染色鉴定。
3 结 果
3.1 母体来源胎盘间充质细胞形态学特征
原代细胞接种48h换液后仅有少量贴壁细胞生长,10d后可见许多细胞克隆,细胞呈漩涡状生长,细胞绝大多数为长梭形成纤维样细胞,当细胞融合率达到80%时,按1∶3消化传代,2d后细胞密度达80%。传代至第8代可见细胞形态均一,状态良好(图1)。
3.2 母体来源胎盘间充质细胞细胞生长曲线测定
对第三代细胞的生长曲线进行了观察,细胞传代后潜伏期约为24~36h,36~72h细胞增殖较快进入对数增殖期,72h后进入平台期(图2)。
3.3 母体来源胎盘间充质细胞表面抗原表达
流式细胞仪检测母体来源间充质细胞第三代细胞表面抗原,结果显示高表达CD73、CD90和CD105,CD14、CD34、CD45和HLA-DR呈阴性,具有典型的间充质干细胞表面标志(图3)。

图1 母体来源胎盘间充质细胞的形态特征

图2 母体来源胎盘间充质细胞生长曲线

图3 母体来源胎盘间充质细胞表面标志分子检测结果
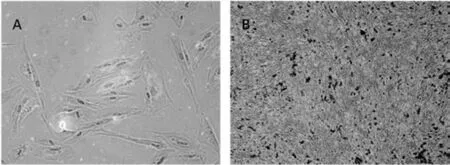
图4 母体来源胎盘间充质细胞向脂肪和成骨细胞定向诱导分化鉴定结果
3.4 母体来源胎盘间充质细胞向脂肪和成骨细胞定向诱导分化
加入脂肪诱导培养基后,细胞停止增殖,体积变大,逐渐从长梭形变为方形或椭圆形,10d左右细胞内出现脂肪滴,诱导12d后经油红O染色可见细胞内红色脂滴。表明按母体来源胎盘间充质细胞有向脂肪细胞诱导分化的潜能(图4 A)。
加入成骨诱导培养基后可见细胞呈漩涡状重叠生长,逐渐聚集成团,诱导14d后经茜素红染色可见多个分布不均,大小形态各异的红色钙结节。表明按母体来源胎盘间充质细胞有向成骨细胞诱导分化的潜能(图4 B)。
4 讨 论
胎盘作为胚胎发育中维系母体和胎儿氧气及营养物质交换的重要暂时性器官,是一种由起源于胚胎滋养层和胚外中胚层的胎儿组织与母体子宫蜕膜组织共同组成的器官,其细胞组成包含了较为原始的胚胎干细胞和活化的母体干细胞。美国学者KvainaiA[2]发现胎盘中含有丰富的间充质细胞,提出了将胎盘作为再生组织工程的细胞资源的设想。In’t Anker等人的研究分别从胎盘的胎儿侧和母体侧组织分离出间充质干细胞,鉴定了所得的间充质干细胞分别为胎儿来源和母体来源的干细胞[3],胎盘作为分娩后的废弃物,在材料获得方面更加方便,对其研究不会涉及伦理道德问题,可能成为组织工程新的细胞来源。
该研究结果显示,从胎盘中分离提取到的母体来源间充质细胞有很强的增殖能力,流式细胞仪检测结果表明其抗原标具有典型的间充质干细胞表面标志,且培养的细胞具有成脂和成骨分化能力,经多次传代后仍状态良好[4-5]。分离出的母体来源的间充质细胞是与产妇本人组织配型相同的间充质干细胞,将使产妇保存其自身的干细胞成为可能,同时可以为组织工程提供潜在的理想种子细胞。
[1] 罗飞.间充质干细胞在组织工程中的研究进展[J].第三军医大学学报,2003,25(2):176.
[2] Kaviani A,Perry TE,Barnes CM,et al.The placenta as a cell source in fetal tissue engineering [J].J Pediatric Surgery,2002,37(7):995-999.
[3] In’t Anker PS,Scherjon SA,Kleijburg-van der KeurC,et al.Isolation of mesenchymal stem cells of fetal ormaternal origin from human placenta[J].Stem Cells,2004,22(7):1338-1345.
[4] Yen BL,Huang HI,Chien CC,et al.Isolation of multipotent cells from human term placenta[J].Stem Cells,2005,23(1):3-9.
[5] Kaviani A,Perry TE.The placenta as a cell source in fetal tissue engineering[J].J Pediatric Surg,2002,37(7):995-999.
Isolation and Culture of Human Maternal Placenta Original Mesenchymal Stem Cells and Identification of its Differentiated Potential into Adipocytes and Osteoblasts
MA Xiao-na, LIU Ting, JIN Yi-ran, WANG Li-bin, WEI Jun*
(General Hospital of Ningxia Medical University, Ningxia Human Stem Cell Institute, Yinchuan, 750004, China)
Objective To search the suitable isolation and culture method of human maternal placenta original mesenchymal stem cells, and identify their differentiated potential into adipocytes and osteoblasts. Methods The mesenchymal stem cells were isolated from human maternal placenta by digested with collagenase; the expression of the specific cell surface marks was examined by flow cytometry; and the differentiated potential into adipocytes and osteblasts were identified by Oil Red O staining and Alizarlin Red staining. Results The human maternal placenta original mesenchymal stem cells exhibited homogeneous spindle shape; and they were positive expressed the cell surface marks of CD73, CD90and CD105, but they negative expressed the cell surface marks of CD14, CD34, CD45and HLA-DR. After induced in differentiation, the cells were positive stained by Oil Red O staining and Alizarlin Red staining, which were the markers of adipocyte and osteoblast. Conclusion The isolation and culture methods of human maternal placenta original mesenchymal stem cells were established; the differentiated potential of human maternal placenta original mesenchymal stem cells into adipocytes and osteoblasts were confirmed, which may provide an ideal alternative source for cell therapy and tissue engineering.
Human maternal placenta original mesenchymal stem cells; Adipocytes; Osteoblasts
R329
B
1671-8194(2013)34-0003-03
宁夏医科大学面上项目资助(XM200940)
*通讯作者
