不同浓度肿瘤坏死因子-α对肺腺癌A549细胞的影响
2013-06-15徐采云袁伟锋黄文杰
徐采云,李 理,袁伟锋,黄文杰
(1南方医科大学,广州510515;2广州军区广州总医院)
肿瘤坏死因子-α(TNF-α)常用于复制炎症、凋亡相关的动物和细胞模型。近年研究发现,TNF-α能促进活性氧(ROS)的产生[1,2],其产生量的多少反映了氧化应激水平的高低。以往我们研究发现,ROS与TNF-α存在浓度依赖,随TNF-α浓度增加,细胞内ROS产生的量随之增加。Tonks等[3]研究发现,ROS含量低的氧化应激编码抗氧化酶的Nrf-2活化,细胞受到保护;ROS含量较高的氧化应激通过活化NF-κB和AP-1诱导炎症反应;而ROS含量更高的氧化应激主要导致细胞的凋亡。基于此,我们提出了不同浓度TNF-α可能产生保护、促炎、促细胞凋亡等不同细胞效应。2012年2~12月,我们观察了不同浓度TNF-α对肺腺癌A549细胞的影响。现报告如下。
1 材料与方法
1.1 材料 肺腺癌A549细胞由广州军区总医院医学实验科保存,人重组TNF-α购于以色列Prospec公司,引物由英潍捷基生物技术有限公司合成,逆转录试剂盒及PCR酶购于宝生物工程(大连)有限公司,DAPI试剂购于碧云天生物技术有限公司,MTT及ROS检测试剂购于南京建成生物工程研究所。
1.2 方法
1.2.1 细胞培养 用RPMI 1640培养基加10%小牛血清培养肺腺癌A549细胞,置37℃ 5%CO2孵箱中孵育。细胞生长至80%时融合传代。选择传3~5代细胞用于实验,调整细胞密度至5×105/mL,接种于6孔板中,培养基中加入终浓度为100 U/mL青霉素和100 U/mL链霉素。
1.2.2 细胞存活率检测 采用MTT比色法。根据TNF-α 诱导浓度不同,设 TNF-α 0(对照组)、1、10、25、50、100 ng/mL组,每组设3个复孔。将细胞密度调整为1×105/mL接种至96孔板,100μL/孔,生长24 h后更换无血清培养基,2 h更换相应TNF-α终浓度的培养基,继续培养6 h。每孔加入 10μL MTT(终浓度为5 mg/L)。继续培养4 h后,每孔加入100μL Formanzan溶解液在细胞培养箱孵育4 h,用酶标仪检测570 nm光吸收值(OD)。细胞存活率=(实验组OD-空白组OD)/(对照组OD-空白组OD)。
1.2.3 ROS检测 取对数生长期肺腺癌A549细胞,接种于 24 孔板,分别以 0、1、10、25、50 ng/mL TNF-α处理6 h,PBS洗涤3次,加入无血清培养基稀释成1∶1 000 DCFH-DA探针继续孵育1 h,PBS洗涤3次后,萤光酶标仪观察各组ROS强度。
1.2.4 Nrf-2、NF-κB mRNA 表 达 检 测 采 用RT-PCR法。取对数生长期肺腺癌A549细胞,接种于25 cm2培养瓶中,分别以 0(对照组)、1、10、25、50 ng/mL TNF-α处理6 h。裂解细胞提取RNA进行逆转录。人 NF-κB[4]:上游引物:5'-GGGAAGGAACGCTGTCA-3',下游引物:5'-TAGCCTCAGGGTACTCCAT-3',片段长204 bp;人 Nrf-2:上游引物:5'-ATTGCCTGTAAGTCCTGGTCA-3',下游引物:5'-ACTGCTTTGGACACATTTCG-3',片段长 180 bp;人β-actin:上游引物:5'-AGGGAAATCGTTGCGTGACATCA-3',下游引物:5'-ACTCATCGTACTCCTGCTTGCTGA-3',片段长 476 bp。按照 95 ℃ 30 s、52 ℃30 s、72℃ 30 s进行35个循环后,行凝胶电泳,用BIO-RAD凝胶成像系统采集图像,Gel-Pro Analyzer 32进行灰度值测定。
1.2.5 细胞凋亡观察 在24孔板中放置灭菌玻片,取细胞密度1×105/mL的肺腺癌 A549细胞1 mL接种至孔板中,分别设 TNF-α0(对照组)、1、10、25、50 ng/mL组,每组设3个复孔。培养24 h后更换无血清培养基,2 h后更换相应TNF-α终浓度的培养基,继续培养6 h。按照DAPI细胞核荧光染色法处理细胞,荧光显微镜下观察细胞凋亡情况。
1.2.6 统计学方法 采用SPSS13.0统计软件,计量资料以¯x±s表示,多重比较用One-Way-ANOVA检验,方差齐用LSD检验,方差不齐用Tamhane检验。P≤0.05为差异有统计学意义。
2 结果
2.1 不同浓度TNF-α对肺腺癌A549细胞存活率的影响 TNF-α 1、10、25、50 ng/mL组细胞存活率分别为(113.3 ±2.0)%、(94.7 ±1.8)%、(93.8 ±0.3)%及(90.0±2.0)%,与对照组比较差异均无统计学意义(P均>0.05)。TNF-α100 ng/mL组细胞存活率为(78.0±1.3)%,与对照比较差异有统计学意义(P<0.05)。说明TNF-α0~50 ng/mL对肺腺癌A549细胞无毒性作用,故后续实验不再设100 ng/mL组。
2.2 不同浓度 TNF-α对肺腺癌 A549细胞产生ROS的影响 DCFH-DA染色后,荧光酶标仪检测结果显示,对照组ROS平均荧光强度(MFI)为177.0±10.6;TNF-α 诱导后,ROS MFI较对照组均有升高,其中1 ng/mL 组 MFI为 183.3 ±7.6、10 ng/mL组为361.3 ±36.0、25 ng/mL 组为 525.0 ±25.0、50 ng/mL组为693.0±19.3。表明肺腺癌 A549细胞ROS的产生随 TNF-α浓度增加而升高(P均 <0.05)。
2.3 不同浓度 TNF-α 对 Nrf-2、NF-κB mRNA 表达的影响 Nrf-2的表达随TNF-α浓度增加表达下调(P 均 <0.05),NF-κB 的表达随 TNF-α 浓度的增加而增加(P均<0.05)。见表1。

表1 不同浓度TNF-α对Nrf-2、NF-κB mRNA表达的影响(¯x ±s)
2.4 不同浓度TNF-α对肺腺癌A549细胞凋亡的影响 DAPI染色后,荧光显微镜观察显示,随着TNF-α刺激浓度的增加,细胞核染色加深,出现核浓缩(25 ng/mL组)等早期凋亡的特征,甚至出现核碎裂成大小不等的圆形小体(50 ng/mL组)等晚期凋亡的表现。说明TNF-α诱导肺腺癌A549细胞凋亡的能力也存在浓度依赖性。见图1。
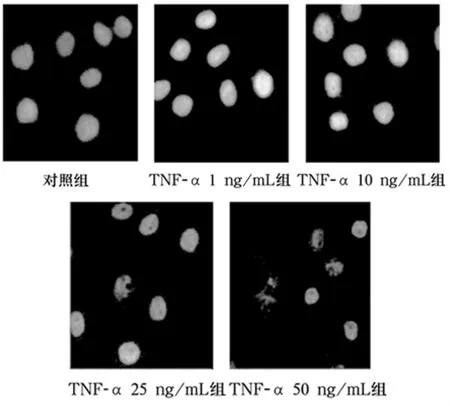
图1 TNF-α对肺腺癌A549细胞凋亡的影响(n=3)
3 讨论
TNF-α是由巨噬细胞分泌的一种具有复杂生物活性的细胞因子,对多种体外培养的肿瘤细胞具有细胞毒活性,已经作为抗肿瘤药物应用于临床。临床已证实,TNF-α进入肿瘤细胞是沿微管移动与溶酶体结合,使溶酶体破裂,释放出溶酶体酶导致细胞自溶,且对正常组织细胞无影响。目前,TNF-α作为一种多功能的细胞因子,应用于急慢性炎症、肿瘤等疾病中。
关于TNF-α信号通路的研究表明,TNF-α能通过活化编码抗氧化酶基因抑制JNK活化,增强细胞存活能力[5];TNF-α 能诱导 ROS的产生,使 MKPs失活,从而导致JNK活化及细胞凋亡[6]。本实验室用TNF-α复制急性肺损伤细胞模型过程中也发现,TNF-α处理细胞后,既能活化编码抗氧化酶的Nrf-2基因,产生细胞保护作用;又能活化炎症因子NF-κB,甚至促进凋亡。
NF-κB是炎症反应中被激活的重要转录因子,其激活后迅速从胞质转位于细胞核内,启动和调控多种蛋白的表达[7]。本研究中,随着TNF-α刺激浓度增加,NF-κB mRNA表达增强,提示 TNF-α浓度增加能导致细胞炎症水平增加,这与Kim等[8]研究结果相同。Nrf-2是编码抗氧化酶的基因,它的活化能促进细胞抗氧化能力,保护细胞免受过度的氧化损伤。本实验中,Nrf-2 mRNA表达随TNF-α浓度增加而降低,提示细胞抗氧化损伤的能力下降。
本研究还发现,TNF-α刺激浓度与细胞胞内ROS生成量呈正相关,TNF-α浓度越高,ROS的生成量越高。Kim等[9]研究也有相同的结论。有关ROS作用的研究提示,细胞产生的ROS超过其抗氧化能力时,氧化应激状态会导致细胞损伤和疾病的产生;产生的量不多时,ROS作为第二信使调控基因的表达[10,11]。由此可知,ROS 生成量的不同,产生的生物学效应也不同,而TNF-α与ROS之间存在浓度依赖关系。因此,TNF-α处理后的肺腺癌A549细胞产生了不同的细胞效应,可能与ROS的产生量不同有关。
综上所述,不同浓度TNF-α对肺腺癌A549细胞有不同的细胞效应,其机制可能与不同浓度TNF-α使肺腺癌A549细胞产生ROS的量不同有关。
[1]Di Tomo P,Canali R,Ciavardelli D,et al.β-Carotene and lycopene affect endothelial response to TNF-a reducing nitro-oxidative stress and interaction with monocytes[J].Mol Nutr Food Res,2012,56(2):217-227.
[2]Kim JH,Jeong SJ,Kwon TR,et al.Cryptotanshinone enhances TNF-a-induced apoptosis in chronic myeloid leukemia KBM-5 cells[J].Apoptosis,2011,16(7):696-707.
[3]Tonks NK.Redox redux:revisiting PTPs and the control of cell signaling[J].Cell,2005,121(5):667-670.
[4]王殿忠,谢敏,潘一明,等.RNA干扰下调NF-κB/p65基因表达诱导胰腺癌细胞株 PANC-1的凋亡[J].肝胆胰外科杂志,2008,20(2):184-187.
[5]Kanaji N,Nelson A,Wang X,et al.Differential roles of JNK,ERK1/2,and p38 mitogen-activated protein kinases on endothelial cell tissue repair functions in response to tumor necrosis factor-a[J].JVasc Res,2012,50(2):145-156.
[6]Tobiume K,Matsuzawa A,Takahashi T,et al.ASK1 is required for sustained activations of JNK/p38 MAP kinases and apoptosis[J].EMBO Rep,2001,2(3):222-228.
[7]Li Q,Verma IM.NF-kappaB regulation in the immune system[J].Nat Rev Immunol,2002,2(10):725-734.
[8]Kim JH,Gupta SC,Park B,et al.Turmeric(Curcuma longa)inhibits inflammatory nuclear factor(NF)-κB and NF-κB-regulated gene products and induces death receptors leading to suppressed proliferation,induced chemosensitization,and suppressed osteoclastogenesis[J].Mol Nutr Food Res,2012,56(3):454-465.
[9]Kim JJ,Lee SB,Park JK,et al.TNF-alpha-induced ROSproduction triggering apoptosis is directly linked to Romo1 and Bcl-X(L)[J].Cell Death Differ,2010,17(9):1420-1434.
[10]Hensley K,Robinson KA,Gabbita SP,et al.Reactive oxygen species,cell signaling,and cell injury[J].Free Rad Biol Med,2000,28(10):1456-1462.
[11]Gloire G,Legrand-Poels S,Piette J.NF-kappaB activation by reactive oxygen species[J].Biochem Pharmacol,2006,72(11):1493-1505.
