糖尿病足患者并发骨质疏松的相关影响因素分析
2013-06-15张在慧吴石白林凯关小宏
张在慧,吴石白,林凯,关小宏
(1安徽医科大学空军临床学院,北京100142;2中国人民解放军空军总医院)
糖尿病足为继发于糖尿病周围血管病变和周围神经病变的足部感染、溃疡或深部组织破坏。Singh等[1]通过研究估计,约25%的糖尿病患者在病程中继发糖尿病足,其中2%患者最终导致截肢。Lavery等[2]研究表明,平均每年约有6.8%糖尿病患者继发糖尿病足,其截肢的发生率为0.6%。糖尿病并发骨质疏松症(OP)因其易致病理性骨折[3]、致残致死率高等原因日益受到重视。单纯糖尿病与OP的关系已基本明确,与血糖水平、胰岛素、微循环改变、BMI等方面有关,而糖尿病足与OP的相关性尚未明确。2012年7~10月,我们对糖尿病足住院患者的临床生化及骨代谢指标进行检测,并分析了糖尿病足与OP的关系。现报告如下。
1 资料与方法
1.1 临床资料 选择同期在空军总医院住院的糖尿病患者85例,其中糖尿病足患者41例(糖尿病足组)、单纯糖尿病患者44例(单纯糖尿病组),所有患者符合2000年WHO制订的糖尿病诊断标准,糖尿病足诊断标准采用 Wagner分级法,且均选取Wagner 3级以上患者。同期选择在该院住院的非糖尿病患者22例(对照组)。所有患者排除其他内分泌疾病、骨髓疾病、白血病、严重肝肾功能不全、服用糖皮质激素类药物者。其中,糖尿病足组男29例、女12例,年龄(57.56±9.16)岁,糖尿病病程(13.41 ±6.47)岁,BMI(24.25 ±3.53)kg/m2;单纯糖尿病组男31例、女13例,年龄(55.45±10.59)岁,糖尿病病程(11.86 ±5.55)岁,BMI(24.74 ±4.05)kg/m2;对照组男 13例、女 9例,年龄(57.59±10.31)岁,BMI(25.62 ±2.82)kg/m2。三组性别、年龄、BMI具有可比性。
1.2 方法
1.2.1 血、尿生化指标检测 抽取糖尿病患者空腹静脉血6 mL,分离血清并保存于-20℃冰箱,采用葡萄糖氧化酶法测定空腹血糖(FPG)、化学发光免疫法测空腹C肽、高压液相色谱法测HbA1c、免疫浊度法测C反应蛋白(CRP)、比测法测血钙。行OGTT试验抽取静脉血用葡萄糖氧化酶法测餐后2 h血糖(2 h PG)、化学发光免疫法餐后2 h C肽。
1.2.2 骨代谢指标及骨密度(BMD)检测 取所有研究对象静脉血2 mL,采用ELISA法测25羟维生素D(25-OHVD)。微循环积分采用徐州光学仪器厂生产的BF微循环显微镜和微循环显微分析系统对患者左手无名指甲襞微循环进行测量、分析,加权所得的积分称微循环积分。肌电图采用美国尼高力公司生产的肌电诱发电位仪测定患者双上肢正中神经、尺神经和双下肢胫神经、肺总神经的传导速度,低于正常者为肌电图异常。BMD采用意大利L'acn公司生产的双能X线骨密度仪测定患者腰椎(L1~4)和双侧股骨颈、大转子区BMD,低于同性别峰值BMD平均值1.0标准差(-1.0≤T-score≤ -2.5)诊断骨量减少,低于同性别峰值BMD平均值2.5 标准差(T-score≥ -2.5)诊断为 OP。
1.2.3 统计学方法 采用SPSS17.0统计软件,计量资料以¯x±s表示,结果比较采用t检验;计数资料比较采用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 糖尿病足组、单纯糖尿病组血生化指标、微循环积分、肌电图异常情况比较 糖尿病足组肌电图阳性率为38.6%,明显高于单纯糖尿病组的4.9%(P<0.01)。两组生化指标及微循环积分比较见表1。
2.2 三组不同部位BMD比较 糖尿病足组骨质疏松13例,骨量减少21例;单纯糖尿病组骨质疏松3例,骨量减少16例;对照组骨质疏松1例,骨量减少4例。糖尿病足组OP发病率高于单纯糖尿病组和对照组(P均<0.05)。三组BMD情况见表2。

表1 两组血生化指标、微循环积分比较(¯x±s)
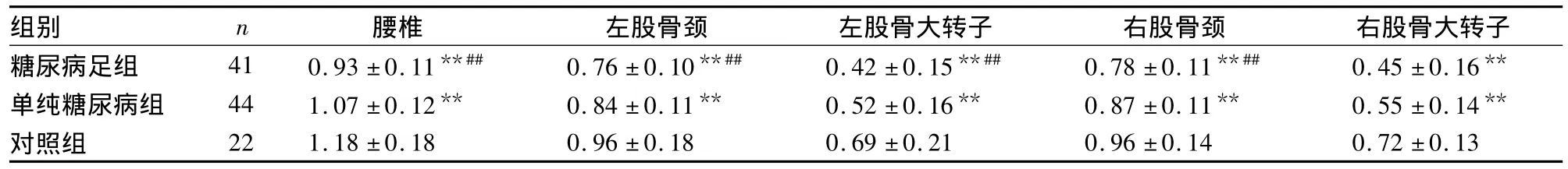
表3 三组不同部位BMD比较(g/cm2,¯x±s)
3 讨论
糖尿病与OP的发病关系已基本明确,随着糖尿病病情进展,1型糖尿病OP发病率增高,2型糖尿病早期因胰岛素抵抗可出现BMD正常或增高,但随病程延长,OP发病率升高[4]。糖尿病致OP的发病机制目前并不十分明确,可能与高葡萄糖毒性、胰岛素缺乏、BMI、血循环异常以及使用某些降糖药物等因素有关。糖尿病足是糖尿病的严重并发症之一,近年来其与OP的关系受到国内外学者的重视。
本研究中的41例糖尿病足患者均为Wagner 3级以上,病程和性别比例与其他两组无明显差异,排除了糖尿病病程和性别因素的干扰。结果显示,单纯糖尿病组的BMD与正常对照组相比,腰椎、股骨颈及大转子部位BMD明显降低;糖尿病足组各部位BMD均低于单纯糖尿病组,这与陈超等[5]的研究结果相一致。钙作为骨形成基础物质,各组间血钙存在明显差异,表明糖尿病足组构成骨组织原料严重不足,导致骨质疏松更加严重。25-OHVD为维生素D的活性形式,经肾脏1-α羟化酶作用转化为具有更强生物学活性的1,25-(OH)2D3,Del Pino-Montes等[6]通过给糖尿病小鼠补充1,25-(OH)2D3证实,补充1,25-(OH)2D3可以改善骨质疏松,恢复BMD水平。1,25-(OH)2D3主要通过促进肠道钙吸收、抑制成骨细胞凋亡、促进破骨细胞成熟等途径促进骨吸收[7]。本研究中,糖尿病足组25-OHVD水平明显低于单纯糖尿病组,表明25-OHVD在糖尿病足OP发病过程中起不可或缺的作用。
本研究结果显示,糖尿病足组BMD较单纯糖尿病组和对照组偏低,OP发病率较单纯糖尿病组及正常对照组增高,这与既往文献报道[8]一致。其原因分析如下:①有实验研究显示,糖尿病血糖升高患者BMD下降系由于高血糖毒性导致过多葡萄糖从肾脏排出,引起渗透性利尿,钙、磷排出增多、重吸收减少,血钙浓度降低,为维持血钙平衡,骨钙入血,导致BMD下降[9]。同时,高血糖还可以与体内多种自由氨基发生糖基化反应,生成糖基化终末产物。骨组织中的骨胶原与葡萄糖反应生成的糖基化终末产物使骨基质产生变化,影响骨胶原的建立,导致骨质疏松[10]。糖尿病患者胰岛素水平相对或绝对不足,导致葡萄糖、蛋白质、脂肪三大营养物质的代谢紊乱,蛋白质消耗增加,骨组织合成原料蛋白减少、分解增加,骨形成减少,BMD降低。成骨细胞表面的胰岛素受体与胰岛素结合后可促进成骨细胞的合成和代谢,以增加BMD,当胰岛素缺乏时,上述作用受抑制,成骨细胞数目减少,骨分解大于合成,终至OP[11]。本研究中糖尿病患者空腹及餐后血糖水平明显高于对照组,而空腹及餐后C肽水平明显低于对照组,与上述研究结果一致。本研究还显示,糖尿病足患者比单纯糖尿病患者血糖控制水平更差和胰岛素水平更低,高血糖的毒性作用和胰岛素进一步缺乏导致糖尿病足患者BMD较单纯糖尿病患者更低。②本研究中,各组微循环积分和肌电图阳性率之间存在明显差异,反映了糖尿病足作为糖尿病晚期并发症,糖尿病微血管病变、周围神经病变导致骨组织微循环不良,影响骨组织对矿物质和非矿物质原料的摄取,最终影响BMD。Pasaoglu等[12]研究证实,糖尿病出现微血管并发症的患者骨丢失较未出现微血管病变患者明显;而Yamaguchi等[13]研究证实,糖尿病神经病变影响骨转换,促进OP的发生,本研究结果与其一致。③糖尿病足是由糖尿病周围血管病变、周围神经病变和局部感染三因素相互作用的结果,本研究中糖尿病足组CRP与糖尿病组相比存在明显差异,表明感染与OP可能存在相关性。但该相关性在国内外既往文献中未提及,需进一步探索。④糖尿病足由于足部溃疡,下肢活动不便,甚至长期卧床[14],造成肌肉、神经失用性萎缩,同时日晒减少,故更易发生OP。
综上所述,糖尿病足患者更容易发生OP,血糖控制不佳、胰岛素绝对或相对缺乏、微血管神经病变、感染均可加重OP的发生、发展。糖尿病足并发OP患者血钙、25-OHVD均呈明显下降趋势,表明对糖尿病足患者需早期补充钙剂和25-OHVD,以预防发生OP。
[1]Singh N,Armstrong DG,Lipsky BA.Preventing foot ulcers in patients with diabetes[J].JAMA,2005,293(2):217-228.
[2]Lavery LA,Armstrong DG,Wunderlich RP,et al.Diabetic foot syndrome:evaluating the prevalence and incidence of foot pathology in Mexican Americans and non-Hispanic whites from a diabetes management cohort[J].Diabetes Care,2003,26(5):1435-1438.
[3]Vestergaard P.Discrepancies in bone mineral density and fracture risk in patients with type 1 and type 2 diabetes—a meta-analysis[J].Osteoporos Int,2007,18(4):427-444.
[4]Dennison EM,Syddall HE,Aihie Sayer A,et al.Type 2 diabetes mellitus is associated with increased axial bone density in men and women from the Hertfordshire Cohort Study:evidence for an indirect effect of insulin resistance[J].Diabetologia,2004,47(11):1963-1968.
[5]陈超,邢学农,叶山东,等.老年2型糖尿病合并糖尿病足患者骨密度的临床分析[J].中华老年医学杂志,2009,28(5):383-387.
[6]Del Pino-Montes J,Benito GE,Fernandez-Salazar MP,et al.Calcitriol improves streptozotocin-induced diabetes and recovers bone mineral density in diabetic rats[J].Calcif Tissue Int,2004,75(6):526-532.
[7]夏维波,苏华,周学瀛.维生素 D缺乏与骨质疏松[J].中华骨质疏松和骨矿盐疾病杂志,2009,2(3):145-154.
[8]Petrova NL,Foster AV,Edmonds ME.Caleaneal bone mineral density in patients with Charcot neuropathic osteoarthropathy:differences between Type l and Type 2 diabetes[J].Diabet Med,2005,22(6):756-761.
[9]黄国良,张莹.糖尿病性骨质疏松的评价与对策[J].实用糖尿病杂志,2006,2(4):4-6.
[10]Schwartz AV.Diabetes Mellitus:Dose it affect bone[J].Calcif Tissue Int,2003,73(6):515-519.
[11]Einhorn TA,Boskey AL,Gundberg CM,et al.The mineral and mechanical properties of bone in chronic experimental diabetes[J].J Orthop Res,1998,6(3):317-323.
[12]Pasaoglu H,Kumandas S,Kelestimur F.Serum osteocalcin levels in type1 diabetes mellitus[J].Turk JPediatr,1995,37(4):323-329.
[13]Yamaguchi T,Kanazawa I,Yamamoto M,et al.Associations between components of the metabolic syndrome versus bone mineral density and vertebral fractures in patients with type 2 diabetes[J].Bone,2009,45(2):174-179.
[14]王亮,马远征,杨帆,等.男性糖尿病足患者骨密度临床研究[J].中国骨质疏松杂志,2010,16(7):498-500.
