脓毒症患者行炎症、凝血指标动态监测的意义
2013-06-14叶宁,钟荣,黄巍
叶 宁,钟 荣,黄 巍
(桂林医学院附属医院,广西桂林541001)
研究表明,危重患者的感染和凝血功能异常存在相关性,炎症反应和凝血激活相互促进,相互影响,促进了脓毒症的进一步恶化。同时,生理性抗凝系统和纤溶系统受到不同程度的抑制,使血液处于高凝状态,导致微血栓形成和微循环障碍,进一步发展为多器官功能障碍综合征(MODS)[1]。动态监测炎症—凝血功能的变化趋势有助于评估临床预后,并为治疗方案的选择提供依据。我们通过监测脓毒症患者治疗期间炎症—凝血指标的变化,分析其与感染部位及预后的关系。现报告如下。
1 资料与方法
1.1 临床资料 选取2011年2月~2012年7月入住我院ICU 1周以上的脓毒症患者72例,男44例、女28例,年龄54~76(60.73 ±6.72)岁。均符合美国胸科医师协会和危重病协会(ACCP/SCCM)制定的脓毒症诊断标准[2]。患者均存在感染及器官功能损害,其中肺部感染47例,腹腔感染8例,混合感染(肺部+血源感染6例,肺部+尿路感染9例,肺部+腹腔感染2例)17例。排除近期有出血或血管梗死、近期手术及外伤、使用抗凝药物和患有血液疾病的患者。入院4周内死亡26例(死亡组),存活46例(存活组),两组临床资料具有可比性。
1.2 方法
1.2.1 检测方法 患者于入住 ICU 后第1、3、5、7天清晨抽取空腹静脉血,分离血清,使用 Sysmex CA7000凝血四项分析仪检测凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、C反应蛋白(CRP)和纤维蛋白原(FBG)。比较不同预后、不同感染部位患者的炎症、凝血指标,比较不同感染部位患者MODS(器官损伤数≥3个)的发生率和病死率。
1.2.2 统计学方法 采用SPSS13.0统计软件,计量资料以±s表示,组间比较采用t检验,多组比较采用方差分析,计数资料采用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 不同预后患者的炎症、凝血指标比较 见表1。存活组与死亡组比较,CRP在治疗后第5、7天有统计学差异(P 均 <0.01),PT 在治疗第3、5、7 天有统计学差异(P均 <0.01),FBG、APTT在治疗全程均有统计学差异(P均<0.05)。组内治疗前后比较,FBG 均无统计学差异(P 均 >0.05),CRP、PT、APTT在存活组中第5、7天与第1天比较有统计学差异(P均<0.01),其中PT的差异性在第3天即出现;死亡组APTT治疗前后比较无统计学差异(P均>0.05),CRP在第7天才出现统计学差异(P<0.01),PT在第5、7天出现统计学差异(P均 <0.05)。
2.2 不同感染部位患者的炎症—凝血指标及预后比较 见表2。三组CRP、PT及MODS发生率比较均无统计学差异(P均 >0.05)。混合感染组的APTT较其他两组显著升高(P均<0.05),病死率较其他两组明显增高(P均<0.01)。
表1 不同预后患者的炎症、凝血指标比较±s)

表1 不同预后患者的炎症、凝血指标比较±s)
注:与存活组比较,*P <0.05;与同组入院1 d比较,△P <0.05
组别 n CRP(mg/L) FBG(g/L) PT(s) APTT(s)存活组46入院 1 d 119.79 ±68.88 4.47 ±1.27 14.37 ±4.02 33.47 ± 8.53入院 3 d 112.34 ±74.64 4.44 ±1.11 12.67 ±1.94△ 31.04 ± 6.27入院5 d 72.48±46.74△ 4.36±1.27 12.54±1.67△ 29.60± 4.30△入院7 d 65.63±47.39△ 4.14±1.16 12.17±1.42△ 29.77± 4.76△死亡组 26入院1 d 106.29 ±55.41 3.10 ±1.20* 15.01 ±2.19 40.45 ±12.65*入院 3 d 99.59 ±55.54 3.20 ±1.22* 15.90 ±3.70* 39.29 ± 9.00*入院5 d 118.65 ±76.13* 3.23 ±1.47* 16.81 ±3.82*△ 40.28 ± 9.14*入院7 d 155.21 ±81.73*△ 3.23 ±1.51* 17.94 ±6.72*△ 40.97 ±11.06*
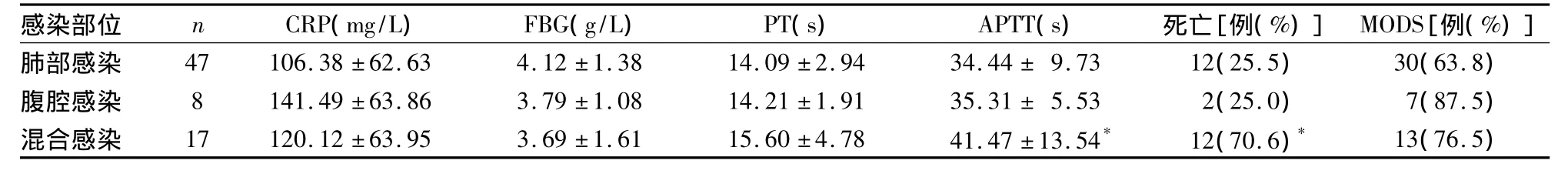
表2 不同感染部位患者的炎症、凝血指标及预后比较
3 讨论
脓毒症是由感染引起器官功能损伤的全身炎性反应综合征,可发展为脓毒性休克、MODS。在其致病机制中,炎症—凝血网络的过度激活起着重要作用,炎症反应激活了凝血系统,抗凝血因子消耗,纤溶系统受抑,血液处于高凝状态,微血栓广泛形成,导致微循环障碍和弥漫性血管内凝血(DIC)形成;同时血栓形成中的产物也促进炎症的发展,二者相互影响,导致脓毒症患者多器官功能损害[3]。
本研究共纳入4个炎症、凝血功能指标,其中CRP反映炎症的程度;FBG既是急性期反应蛋白,也是凝血因子;PT反映外源性凝血途径;APTT反映内源性凝血途径。在连续1周的动态监测中,生存组与死亡组的4项指标大部分有统计学差异,其中CRP和PT在入院当天无统计学差异。治疗前后比较,存活组的CRP和PT逐步下降,而死亡组逐步增高,两者在动态曲线上与预后的相关性较好,其中PT的显著性变化在两组中均出现较早(存活组第3天、死亡组第5天)。APTT在存活组中逐步降低,在死亡组中无明显变化,这种动态差异性表明,脓毒症患者随着炎症感染的加重,外源性凝血途径被大量激活,而内源性途径变化不明显。考虑其原因为:感染是患者的致病病因,其病原体及代谢产物(如内、外毒素)引起内皮损伤和组织因子(TF)释放,而TF是外源性凝血途径的启动因子。既往研究证实,早期阻断重症感染患者内源性凝血途径时,对凝血活化并无显著影响[4]。在对DIC动物模型使用组织因子抑制物时可以阻断凝血途径的活化,而抑制Ⅻ因子却无此作用,提示TF引起的外源性凝血途径才是凝血紊乱的主要途径[5]。脓毒症患者CPR和PT同步增加,提示感染加重,凝血途径过度激活。FBG虽同为急性期反应蛋白,但其升高仅2~3倍,在炎症早期FBG可升高,随着病情进展,凝血系统激活后微血栓形成,继发纤溶而导致FBG消耗并下降。本研究显示,FBG在存活组中持续偏高,而在死亡组中并无增高,虽然两组比较无统计学差异,但FBG作为炎症、凝血的双重指标,其下降提示存在纤溶亢进,需警惕DIC发生的风险。
脓毒症患者常存在多部位感染及多重病菌感染,本研究结果显示,不同感染部位患者的CRP和PT比较并无统计学差异,而混合感染患者的APTT显著高于肺部感染和腹腔感染组,病死率也明显升高。CPR和PT与感染部位无关,与感染程度有关;APTT在混合性感染患者中明显增高,提示多部位感染患者其内源性凝血途径被广泛激活。丁欢等[6]研究显示,随着脓毒症的病情进展,机体外源性凝血途径被激活,内源性凝血系统活性随之增强,并且在MODS的发生过程中起重要作用。本研究结果显示,APTT增高提示患者可能存在多部位感染,更易出现微循环障碍,病死率更高。既往研究显示,抑制凝血系统活化可以抑制炎症反应,凝血抑制剂不仅具有抗凝特性,还有一定的抗炎作用[7]。临床上常用低分子肝素进行抗凝治疗,朱建波等[8]研究显示,不同剂量的低分子肝素钠均能改善ALI/ARDS患者的预后,但以5 000 U剂量者疗效最明显。
综上所述,脓毒症患者存在凝血功能紊乱和失控的炎症反应的交叉作用,这是导致器官功能不全的重要病理生理机制。CPR和PT与脓毒症患者的预后相关性较好,PT与感染程度有关,APTT与感染部位的数量有关,混合性感染患者其病死率更高。在抗炎治疗的同时关注抗凝治疗,能打断炎症—凝血功能紊乱的恶性进展,有助于改善患者预后,降低重症感染并发器官功能不全的发生率和病死率。
[1]Zeerleder S,Hack CE,Wuillemin WA.Disseminated intravascular coagulation in sepsis[J].Chest,2005,128(4):2864-2875.
[2]Mitchell M,Mitchell P,John C,et al.2001 SCCM/ESICM/ACCP/ATS/SIS international sepsis definitions conference[J].Int Care Med,2003,29(4):530-538.
[3]van der Poll T,de Boer JD,Levi M.The effect of inflammation on coagulation and vice versa[J].Curr Opi Infect Dis,2011,24(3):273-278.
[4]Ten Cate H.Pathophysiology of disseminated in travascular coagulation in sepsis[J].Crit Care Med,2000,28(9):9-11.
[5]曲东.脓毒症患者凝血功能改变及治疗对策[J].中国医刊,2008,43(11):20-23.
[6]丁欢,马希刚,马玉杰,等.脓毒症患者血浆抗凝血酶Ⅲ及D-二聚体与SOFA评分的相关性研究[J].中国实用内科杂志,2008,28(2):113-118.
[7]Levi M,van der Poll T.The role of natural anticoagulants in the pathogenesis and management of systemic activation of coagulation and inflammation in critically ill patients[J].Semin Thromb Hemost,2008,34(5):459-468.
[8]朱建波,王爱芹,杜小芳,等.低分子肝素钠对ALI/ARDS患者凝血活化、炎症反应及纤溶抑制的影响[J].山东医药,2010,50(21):47-49.
