树突状细胞在抗白色念珠菌感染中的作用
2013-06-12蒋李懿乔鸣芳资云玲李风舟
陈 华,蒋李懿,乔鸣芳,资云玲,李风舟
(广东省口腔医院黏膜科,广州 510280)
念珠菌是广泛存在于人和动物体内的条件致病菌,其中引起人类念珠菌疾病的主要是白色念珠菌,又称白色假丝酵母菌(candida albicans,CD)。 正常人CD 的带菌率以口腔为最高。近年来,随着各种抗肿瘤化疗药物、免疫抑制剂、皮质激素和广谱抗生素在临床上的广泛应用,以及器官移植、介入治疗的不断实施,口腔CD 感染的发病率呈不断上升趋势[1-2]。 T 细胞免疫在抗CD 感染的过程中起着非常重要的作用, Th1 /Th2 比例的失调,有利于CD 病的发展。 IL-12 是连接天然免疫和获得性免疫的一个重要纽带,又是促进CD4+T 细胞向Th1 细胞分化的重要细胞因子。 树突状细胞 (dendritic cell,DCs)可产生IL-12,是目前已知的功能最强的抗原呈递细胞,也是机体免疫反应的始动者[3]。 在系统性真菌感染中,Th1 类因子介导的细胞免疫对机体起了保护作用,故测定抗原提呈细胞识别捕捉抗原后分泌IL-12 水平的高低是判断免疫应答方向的有效指标[4]。本研究观察了DCs 受CD 抗原冲击后分泌IL-12 的变化,初步探讨DCs 在抗CD 感染中的作用。
1 材料与方法
1.1 实验动物
6~8 周龄SPF 级C57BL/6 小鼠4 只,雌雄不拘,体质量18~20 g,购自湖南省斯莱克景达实验动物有限公司,动物合格证编号:HNASLKJ20101432,清洁环境饲养。
1.2 主要试剂与药物
沙保琼脂培养基(sabourd’s dextrose agar,SDA,广州迪景微生物科技公司),胎牛血清(fetal bovine serum, FBS)及RPMI-1640 培养基(北京索莱宝科技有限公司),青霉素、链霉素溶液和红细胞裂解液(上海玉博生物科技有限公司),重组小鼠细胞因子GM-CSF(rGM-CSF)和重组小鼠细胞因子IL-4(rIL-4,美国R&D 公司),小鼠IL-12 ELISA 试剂盒(上海抚生实业有限公司)。
1.3 方法
1.3.1 小鼠骨髓DCs 的制备与培养
参照文献[5-6]的方法,制备与培养小鼠骨髓DCs,其具体步骤:1)将C57BL/6 小鼠断颈处死,浸泡于碘伏液中消毒5 min;2) 无菌条件下取后肢双侧股骨、胫骨,浸泡于500 U·mL-1双抗(青霉素和链霉素)PBS 中,剔净周围组织,洗净后离断干骺端,用注射器针头破坏骨小梁后,用无血清1640 反复抽吸、冲洗髓腔,收集骨髓细胞悬液;3)将所得细胞悬液过200 目钢网,吹打成单细胞悬液;4)将单细胞悬液离心、弃上清,加0.5 mL 红细胞裂解液重悬,于室温下静置5 min,加无血清1640 稀释,离心、洗涤2 遍;5) 用DC 诱导体系 [RPMI-1640+10%FBS+rGM-CSF(20 ng·mL-1)+rIL-4(20 ng·mL-1)]定容制成细胞悬液,调至细胞浓度为1×107mL-1,置24 孔培养板中,每孔1 mL;置37 ℃、5%CO2培养箱中培养;6)3 d 后,吸弃悬浮细胞,加入同体系培养液,1 mL·孔-1,显微镜下可见细胞长出树突样突起,继续培养,隔天半量换液。
1.3.2 CD 菌株和鉴定
从广东省口腔医院黏膜牙周科确诊的20 例口腔念珠菌病患者的唾液中分离出CD 菌株,SDA 培养,经念珠菌CHROM agar 鉴定,45 ℃生长实验,玉米吐温80 培养基培养和念珠菌API 20C AUX 鉴定保种。
1.3.3 CD 菌株扩增
CD 菌株用SDA 28 ℃培养48 h, 菌液浓度调至5×105mL-1,转种于YPD 液体培养基,调至5×105mL-1,置摇床150 r·min-1、25 ℃振荡培养48 h,离心弃上清,将菌液浓度调至1×108mL-1,加入含FBS 的RPMI-1640 培养基,菌液浓度调至为5×105mL-1,置37 ℃水浴箱培养3 h,得到即为菌丝相CD。
1.3.4 CD 对DCs 的冲击实验及分组
待上述DCs 培养6~7 d,收取漂浮的DCs,调至细胞浓度为2×106mL-1, 以2 倍于DCs 的细胞数加入CD,每孔1 mL 置6 孔培养,共同置于37 ℃、5%CO2培养箱中孵育。 分2组进行实验:DCs+CD 组和DCs 组。 DCs+CD 组每孔中加入CD,使其终浓度为1×107mL-1,DCs 与CD 的比例为1∶10;置37 ℃、5% CO2孵箱中培养4、12 及24 h 后分别取出培养孔的培养液, 2 000 r·min-1离心2 min 后,取上清液。 DCs 组不加CD,DCs 细胞培养4、12 及24 h 后分别取出培养孔的培养液,2 000 r·min-1离心2 min后, 取上清液。 均采用ELISA 法检测上清液中细胞因子IL-12。
1.4 统计学方法
2 结果
DCs 组的DCs 有少量的IL-12 分泌,随着时间的推移,有缓慢增多的趋势。 培养到4 h 时,2组的IL-12 浓度比较差异无统计学意义(t=0.42,P>0.05)。培养12、24 h 时,DCs+CD 组分泌的IL-12 浓度分别为(150.12±56.38)和(1 236.24±125.33)ng·L-1,显著高于DCs 组的(93.65±29.18)和(347.56±76.54)ng·L-1(t=3.978,t=32.837,均P<0.05)。 见表1。
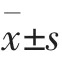
表1 2组各时间段DCs 分泌IL-12浓度的比较 ,ρ/(ng·L-1)
3 讨论
口腔念珠菌病是人类最常见的口腔真菌感染,引起口腔念珠菌病最常见的是CD[1]。 CD 具有亚硝基化潜力,在口腔黏膜白斑向口腔癌转变的过程中起到了促进作用[7]。 因此,对CD 感染的研究越来越多。
DCs 是目前发现的功能最强的抗原呈递细胞,是机体免疫应答的始动者,在免疫反应中起着关键的作用。正常情况下,体内绝大多数DC 处于未成熟状态,这时它具有较强的抗原呈递能力。 目前从多种组织中已能分离诱导出具有正常功能的DC,而不同来源以及处于不同发育阶段DC 具有不同的生物学特征[8]。 1992 年,Reid 等[9]在骨髓细胞中鉴定出DCs 的造血干细胞克隆,并且在GM-CSF 和TNF-α 的共培养下它能分化成DCs 及巨噬细胞。由于骨髓来源方便,且DCs 前体细胞的含量亦相对较多,因此在随后的研究中成为应用较多的DCs 来源[6]。 本实验采取小鼠骨髓体外培养、细胞因子rGM-CSF 和rIL-4 细胞因子联合诱导培育的方法,以IL-4 阻止巨噬细胞发育生长,从而获得了大量高纯度的DCs。
DC 可分泌IL-12、NO 及IFN-C 等,调节CD4+Th细胞向Th1 型分化。 Th1 型细胞主要介导细胞免疫应答, 可以增强吞噬细胞功能, 增加机体对CD 的抵抗力。IL-12 是特异性细胞免疫应答中的基本介质,也是测定CD 免疫的核心指标[10]。 本实验观察到体外培养的小鼠骨髓DCs 能分泌IL-12,但受CD 抗原冲击后,DCs 分泌的IL-12 明显高于单纯DCs组,且随着时间的推移,IL-12 分泌量逐渐增加。表明DC 在成熟过程中可以分泌IL-12,但DCs 被CD活化后IL-12 的分泌量增大。笔者推测,分泌增多的IL-12 对DC 功能的发挥可能起着至关重要的作用,在Th1 /Th2 之间的平衡调控机体免疫状态过程中,促使Th0 分化为Th1 型细胞增多,使宿主产生对CD 的抵抗,这也可能是CD 致敏的DCs 能高效地诱导抗CD 免疫的原因之一。
[1]常东,蒋伟,黄志红,等.真菌感染及耐药性分析[J].中华医院感染学杂志,2005,15(3):345-347.
[2]Pfaller M A,Jones R N,Doern G V,et al.Bloodstream infections due to candida species:SENTRY antimicrobial surveillance program in North America and Latin America,1997-1998[J].Antimicrob Agents Chemother,2000,44(3):747-751.
[3]李宁,刘冠贤,石咏军.树突状细胞与免疫调节的研究进展[J].西南军医,2010,12(3):504-506.
[4]黄巍,杨义成,黄长征,等.抗原致敏树突状细胞抗小鼠白念珠菌系统感染的实验研究[J].中国皮肤性病学杂志,2008,22(7):403-405.
[5]Molavi O,Mahmud A,Hamdy S,et al.Development of a poly(d,l-lactic-co-glycolic acid) nanoparticle formulation of STAT3 inhibitor JSI-124:implication for cancer immunotherapy[J].Mol Pharmaceutics,2010,7(2):364-374.
[6]吴昆,拜合提亚·阿扎提,王文光,等.小鼠骨髓来源树突状细胞培养鉴定和诱导T 淋巴细胞增殖[J].南京医科大学学报:自然科学版,2011,31(8):1128-1133.
[7]Farah C S,Hong S,Wanasaengsakul S,et al.Irradiationinduced oral candidiasis in an experimental murine model[J].Oral Microbiol Immunol,2001,16(6):358-363.
[8]Katsnelson A.Kicking off adaptive immunity:the discovery of dendritic cells[J].Exp Med,2006,203(7):1622.
[9]Reid C D,Stackpoole A,Meager A,et al.Interaction of tumor necrosis factor with granulocyte-macrophage colony-stimulating factor and other cytokines in the regulation of dendritic cell growth in vitro from early bipotent CD34+progenitors in human bone marrow[J].J Immunol,1992,149(8):2681-2688.
[10]Moser M.Dendritic cells in immunity and tolerance-do they display opposite functions[J].Immunity,2003,19(1):5-8.
