犬室颤心脏骤停模型的研究与改进
2013-06-12杨继斌
杨继斌,刘 勇,黄 亮
(南昌大学第一附属医院急诊科, 南昌 330006)
随着心肺复苏技术的不断提高和推广,心脏骤停猝死患者自主循环恢复率不断提高,但随着自主循环建立,机体往往又出现心脏停搏后综合征[1],表现为全身性的缺血再灌注损伤,致使心脏骤停患者的生存率一直不高,其具体机制尚不明确。 因此建立一种简单、有效、稳定的心脏骤停模型,对于研究心脏骤停及心肺脑复苏过程中机体的病理生理变化和开创新的复苏治疗手段具有重要的意义。 电刺激诱发室颤致心脏骤停是国内外常用的一种动物模型制做方法,各模型中对于不同物种的诱颤能量、诱颤时间及心脏骤停时间长短尚没有统一标准,为此,本研究以犬为实验动物,建立了一种稳定的室颤心脏骤停模型。
1 材料与方法
1.1 实验动物
成年、健康犬30 只,体质量(15±2)kg,雌雄不限,由南昌大学动物科学部提供,实验前48 h 饲养于动物房中,温度18~25 ℃,湿度40%~60%。 术前禁食12 h,自由饮水。
1.2 仪器设备
M8001A 飞利浦有创心电监护仪,德国飞利浦公司;电流控制器,南昌大学医学院物理教研室研制;双相波除颤仪,美国Philips 公司;PB760 呼吸机,美国Puritan-Bennett 公司。
1.3 麻醉、诱颤及分组
犬称重后以氯胺酮20 mg·kg-1及安定5 mg 混合液肌注进行基础麻醉,5~10 min 后将麻醉犬仰卧位固定于操作台上,四肢皮下置探针连接心电监护仪,行气管插管,无菌手术行左侧股静脉置管,林格氏液100 mL·h-1静脉滴注,以3%戊巴比妥钠2 mL·h-1静脉间断给药维持麻醉,经股动脉置入6F 动脉测压导管,管内预留肝素连接压力传感器检测动脉血压。 经右颈外静脉插入普通起搏导线,当导管进入到右心室内壁,心电图显示特异性心室波时固定好电极导线,心电导联设为Ⅱ导联,电极导线连接电流控制器,5 mA 交流电持续1~2 s,观察心电图和动脉压,出现室颤波及动脉压失去波动,可判断室颤成功,成功标准:1)心电图显示室颤波;2)动脉压曲线近似一条直线,压力降至10~20 mmHg(1.3~2.6 kPa)以下。 30 只犬根据CA 时间不同分为3 组、每组10 只,分为CA 3 min 组、CA 5 min 组和CA 8 min组。
1.4 复苏及复苏后治疗
各组犬分别于诱颤后3、5、8 min 开始,严格按照2010 年心肺复苏新指南开始心肺复苏(CPR),给予150 J 能量除颤,并立即胸外按压,连接呼吸机控制呼吸,通气频率为10~12 次·min-1,潮气量为12~15 mL·kg-1,吸呼比为1∶3,吸入氧浓度30%。 复苏至自主循环恢复(ROSC)。 ROSC 判断标准:1)心电图显示有效心律(包括窦性心律、交界性心律及室性自主心律);2)收缩压>60 mmHg(8 kPa),且持续时间大于3 min;3)可触及大动脉波动。复苏30 min 无效者放弃复苏。 对于ROSC 后犬继续心电监护6 h,期间根据具体情况给予相应的呼吸循环支持,并连续观察72 h 内所有实验犬的存活情况。
1.5 统计学方法
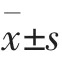
2 结果
2.1 各组犬基本生理参数及诱颤情况
每组10 只犬,各组动物的生理学参数见表1,组间比较差异无统计学意义。 诱颤前犬的心电图监测及动脉压监测见图1,经右心室起搏导管5 mA 电流诱颤1~2 s 后30 只犬均出现典型的室颤波,动脉压下降至1.3~2.6 kPa 以下,曲线失去波动。 各组犬生理学参数比较P>0.05,差异无统计学意义。 见图2。
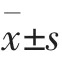
表1 各组犬的基本生理参数表
2.2 复苏情况
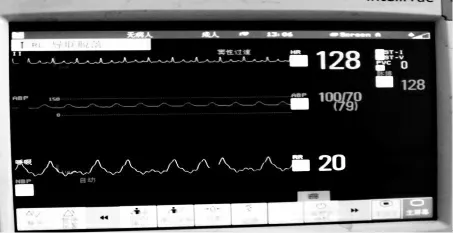
图1 犬生理指标检测

图2 诱发室颤时的心电图及动脉波形
各组自主循环恢复 (ROSC) 情况为CA 3 min组:90%(9/10)、CA 5 min:80%(8/10)、CA 8 min:20%(2/10),ROSC 率3 min 组和CA 5 min 组比较差异无统计学意义(P>0.05);CA 8 min 组与其他2组之间比较差异具有统计学意义(P<0.05)。 如表2。各组ROSC 犬存活时间比较,CA 3 min 组有7 只存活72 h, 而CA 5 min 和8 min 组分别于12 h 内全部死亡。CA 3 min 组、CA 5 min 组及CA 8 min 组存活时间分别为:(64.22±23.33)、(6.26±4.10)、(3.0±1.41)h、CA 3 min 组与其他2组存活时间比较差异具有统计学意义(P<0.05),CA 5 min 和CA 8 min 组之间比较差异无统计学意义(P>0.05)。
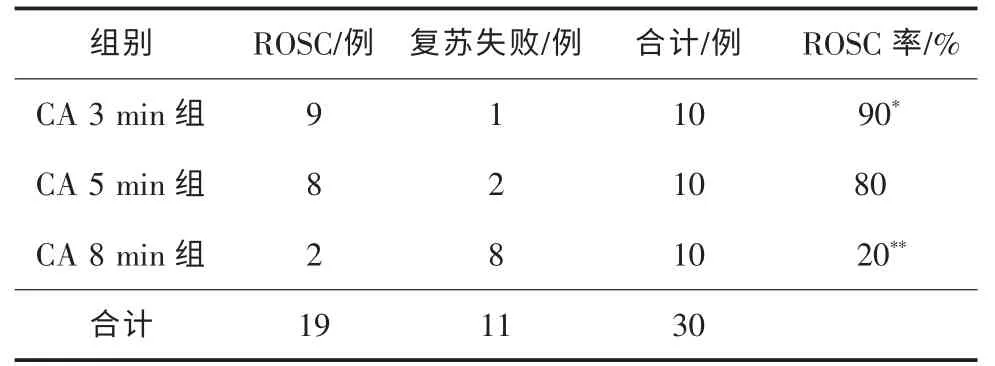
表2 各组犬ROSC 率比较表
3 讨论
SCD 的主要原因为心律失常,其中以室颤(VF)为多见,因此为了更好地研究VF 及CPR 后机体的病理生理改变,建立一个稳定且可靠的室颤动物模型有着重要的意义。
在心脏骤停动物模型的制备中,常常要根据不同实验动物选择不同的方法,笔者根据以往研究经验,选用犬作为研究对象,并采用电刺激诱发室颤,结果显示模型相对稳定可靠。 电刺激诱发室颤常用的方法有:1)经胸体外电休克;2)开胸直视下心外膜电击;3)经右心室起搏导管诱发室颤。
经胸体外电休克制作心脏骤停模型主要用于大动物的研究,如兔、猪、犬等,国外Vaagenes 等[3]、Miclescu 等[4]及国内金修才等[5]、刘焕兵等[6]均以犬为实验动物,采用体外经胸壁20~60 V 交流电击制作的心脏骤停模型均取得了较好的结果,然而这种方法诱发心脏骤停的交流电流选择及电击持续时间却没有统一标准,而且不但容易引起胸壁局部电烧伤,还容易自动复律,往往需要多次电击诱导。
开胸直视下心外膜电击建立心脏骤停模型也常应用于猪等大型动物,国外Krep 等[7]对猪采取直视下心外膜电击制作心脏骤停模型,在开胸等准备过程中死亡了2 只,其他所有动物都诱发了心脏骤停,且复苏成功。 这种模型具有诱导能量低、诱导成功率及复苏成功率高等优点被广泛应用,不足之处在于开胸后对心脏及大动脉的损伤较大,有可能使实验动物在准备过程中意外死亡,且其产生的心脏骤停与临床上有一定差异。
右心室起搏导管诱颤是常用的经典模型制作方法,周正宇等[8]及黄子通等[9]用猪为实验动物,通过颈静脉或股动脉置管至右心室诱发室颤成功制作了心脏骤停模型,然而实验用猪价格昂贵,实验成本较高。 相比实验用大鼠、家兔及猪等动物,犬既有的心血管功能与人的很相似的优势,又能降低实验成本,因此本研究选用健康成年杂交犬为实验对象, 结果显示,30 只犬均成功诱发室颤, 模型稳定,重复性高,临床上大多数心脏骤停是由室颤引起的,因此右心室起搏导管诱颤制作心脏骤停模型的病理生理机制更接近临床。
本研究中参照以往制作的室颤模型[10]并加以改进,诱颤能量固定为5 mA,笔者发现5 mA 电流能够诱导出室颤,是较理想的诱颤能量,诱颤时间设定为1~2 s,结果显示所有犬都出现了明显的室颤,且无自动复律,可见5 mA 电流诱颤1~2 s 能够满足模型制作的需要,相比体外交流电电击需要高电流、自动复律多见等缺点,本模型具有明显的优势。 目前在建立CA 动物模型时,CA 时间的长短还没有统一的标准, 短时间的CA 可能无法复制与临床接近的病理生理改变,长时间的CA 又可能无法顺利复苏,导致无法满足基础研究的需要,本研究结果提示CA 3 min 组及CA 5 min 组经标准的CPR 后具有较高ROSC 率,CA 3 min 组存活时间较CA 5 min及CA 8 min 长,综合比较提示CA 3 min 后进行复苏建立的心脏骤停复苏模型相对其他2组更具稳定性及可靠性,但CA 3 min 是否是研究犬心脏骤停的最佳时间复苏时间,还有待进一步研究。
4 结论
通过本研究,笔者认为犬经右心室导管诱发室颤制作的心脏骤停模型稳定且可靠,操作简单易行,成本较低,能满足心肺脑复苏基础研究的需要。
[1]Nolan J P,Neumar R W,Adrie C,et al.Post-cardiac arrest syndrome: epidemiology, pathophysiology, treatment, and prognostication.A Scientific Statement from the International Liaison Committee on Resuscitation; the American Heart Association Emergency Cardiovascular Care Committee; the Council on Cardiovascular Surgery and Anesthesia; the Council on Cardiopulmonary, Perioperative,and Critical Care; the Council on Clinical Cardiology; the Council on Stroke[J].Resuscitation,2008,79(3):350-379.
[2]Hua W, Zhang L F, Wu Y F,et al.Incidence of sudden cardiac death in China: analysis of 4 regional populations[J].Am Coll Cardiol,2009,54(12):1110-1118.
[3]Vaagenes P,Safar P,Moossy J,et al.Amelioration of brain damage by lidoflazine after prolonged ventricular fibrillation cardiac arrest in dogs[J].Resuscitation,1997,35(1):41-52.
[4]Miclescu A,Basu S,Wiklund L.Cardio-cerebral and metabolic effects of methylene blue in hypertonic sodium lactate during experimental cardiopulmonary resuscitation[J].Resuscitation,2007,75(1):88-97.
[5]金修才,杨兴易,赵良,等.心脏停跳复苏犬大脑组织内皮素-1 含量和Na-K ATP 酶活性的变化[J].中国急救医学,2000,20(8):451-452.
[6]刘焕兵,吴印生,尹林,等.血管加压素对心室颤动犬模型冠状动脉灌注压的影响[J].临床心血管病杂志,2007,23(1):65-66.
[7]Krep H, Breil M, Sinn D,et al.Effects of hypertonic versus isotonic infusion therapy on regional cerebral blood flow after experimental cardiac arrest cardiopulmonary resuscitation in pigs[J].Resuscitation,2004,63(1):73-83.
[8]周正宇,王禹斌,周慧英,等.猪心室颤动模型的建立[J].实验动物与比较医学,2007,27(4):251-259.
[9]黄子通,王彤,吴海东,等.电刺激诱发猪心室颤动模型的研究和改进[J].岭南急诊医学杂志,2006,11(2):83-85.
[10]吴天明,蒋光辉,黄亮.经胸体外单、双相波除颤对犬心肌损伤的程度比较[J].山东医药,2010,50(41):36-37.
