灵芝胶囊治疗鹅膏毒蕈中毒69例临床观察
2013-06-09肖桂林
李 洁,肖 宫,肖桂林
(中南大学湘雅医院,湖南 长沙410008)
毒蕈中毒是湖南地区常见急诊,本科自2002年以来采用灵芝煎剂治疗鹅膏毒蕈中毒取得显著疗效。但由于灵芝煎剂口感差,煎煮费时,患者依从性差且受条件制约,笔者采用灵芝胶囊代替灵芝煎剂治疗鹅膏毒蕈中毒,现报道如下。
1 资料与方法
1.1 临床资料
收集本院急诊科2009~2011年就诊的鹅膏毒蕈中毒的患者共69例,其中轻症组15例,中症组22例,重症组32例。重症组32例设为治疗组,以本科历史资料2002~2005年收治鹅膏毒蕈中毒重症34例为对照组[1]。(1)轻症组15例,其中男8例,女7例;最大年龄71岁,最小年龄11岁,平均年龄(41.2±2.3)岁。(2)中症组22例,其中男10例,女12例;最大年龄69岁,最小年龄10岁,平均年龄(39.9±3.6)岁。轻中症组全部病例均有食用野菌后至出现胃肠道症状的潜伏时间,最短为6 h,最长为11 h,平均为(7.8±3.1)h;食入野菌到本院就诊时间,最短为6.7 h,最长为55 h,平均为(32.3±10.6)h;(3)重症组(治疗组)患者32例,其中男性18例,女性14例;最大年龄为80岁,最小年龄为9岁,平均年龄(40.1±2.1)岁。重症组全部病例均有食用野菌后至出现胃肠道症状的潜伏时间,最短为5 h,最长为13 h,平均为(8.9±2.3)h;食入野菌到本院就诊时间,最短为5.3 h,最长为70 h,平均为(41.2±11.5)h;(4)对照组患者34例,其中男性18例,女性16例;最大年龄为78岁,最小年龄为6岁,平均年龄(41.1±1.1)岁。全部病例均有食用野菌后至出现胃肠道症状的潜伏时间,最短为5.6 h,最长为12.4 h,平均为(9.1±2.1)h;食入野菌到本院就诊时间,最短为5.7 h,最长为72 h,平均为(42.2±13.1)h。重症组(治疗组)与对照组临床资料比较差异无统计学意义(P>0.05)。
1.2 诊断标准[1]
(1)有采集野蘑菇史;(2)群体同时发病;(3)有潜伏期(一般为3~12 h)、胃肠炎期(一般持续24~48 h)、假愈期(一般持续24~48 h)、内脏损害期(持续时间较长)、恢复期的典型临床表现;(4)鉴定所食之蕈为鹅膏毒蕈(由湖南师范大学毒蕈研究所陈作红教授鉴定)。
1.3 病情分级标准[1]
(1)轻症:患者有消化道症状,如恶心、呕吐、腹痛、腹泻等,尚未出现黄疸及神志改变;(2)中症:除消化道症状外,出现了黄疸(巩膜黄染)或神志改变(幻觉、胡言乱语、躁狂、哭笑无常等);(3)重症:患者有消化道症状,同时伴有黄疸和神志改变。
1.4 治疗方法
(1)轻症组:给予灵芝胶囊(杭州民生药业集团有限公司生产,国药准字Z33020902,每粒胶囊含灵芝0.27 g)10粒/次口服(或鼻饲),每2 h 1次;3 d后改为5粒/次口服,每4 h 1次;3 d后改为2粒/次口服,每4 h 1次;疗程共10 d。(2)中症组给予灵芝胶囊20粒/次口服(或鼻饲),每2 h 1次;3 d后改为10粒/次口服,每4 h 1次;3 d后改为5粒/次口服,每4 h 1次;疗程共10 d。(3)重症组(治疗组)给予灵芝胶囊30粒/次口服(或鼻饲),每2 h 1次;3 d后改为20粒/次口服,每4 h 1次;3 d后改为10粒/次口服,每4 h 1次;疗程共10 d。(4)对照组给予灵芝500 g加水2 500 m L煎煮成2 000 m L液体,每3 h口服(或鼻饲)1次,每次250 m L,疗程7 d。
1.5 观察指标及方法
(1)临床症状:呕吐、腹痛、腹泻、黄疸及神志变化等;(2)实验室指标:血清总胆红素(STB),血清总胆汁酸(BA),谷丙转氨酶(ALT),谷草转氨酶(AST)。于治疗开始的当天、3、5、7、10 d各复查1次上述观察指标。
1.6 疗效评定标准[2]
治愈:临床症状消失,有关检测指标(STB、BA、ALT、AST)均恢复正常;显效:临床症状消失,STB、BA、ALT、AST几项指标明显下降但未恢复正常(STB30~60μmol/L,BA20~35μmol/L,ALT80~200 U/L,AST80~200 U/L);有效:临床症状好转,有关检测指标下降,但未恢复正常(STB60~90μmol/L,BA35~50μmol/L,ALT200~500 U/L,AST200~500 U/L);无效:临床症状无好转(STB>90μmol/L,BA>50μmol/L,ALT>500 U/L,AST>500 U/L)。全部病例于治疗后第10天进行疗效评定。
1.7 统计学分析
采用SPSS 15.0统计软件进行统计分析。计量资料以“±s”表示,用t检验;计数资料用χ2检验。
2 结果
2.1 临床疗效比较
轻、中、重3组疗效与对照组比较,差异无统计学意义(P>0.05)。见表1。
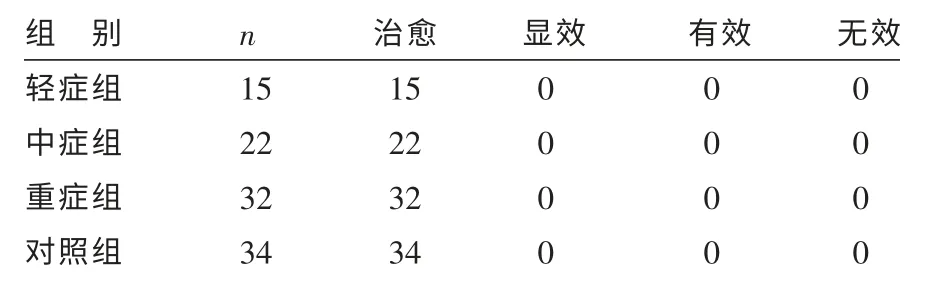
表1 各组临床疗效比较 (例)
2.2 实验指标动态变化比较
2.2.1 轻症组 轻症组的4项实验室指标在第3天达到最高,此后迅速下降,在第10天完全恢复正常。除BA、ALT和AST值第1天与第7天比较差异无统计学意义(P>0.05),其他各项实验室指标分别与1、3、5、7 d比较差异有统计学意义 (P<0.01)。见表2。
表2 轻症组实验指标变化比较 (n=15,±s)
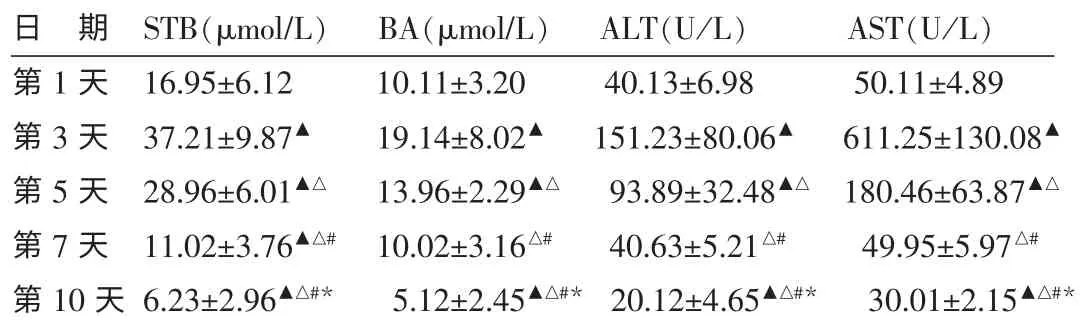
表2 轻症组实验指标变化比较 (n=15,±s)
注:与第1天比较▲P<0.01;与第3天比较△P<0.01;与第5天比较#P<0.01;与第7天比较*P<0.01。
日 期 STB(μmol/L) BA(μmol/L) ALT(U/L) AST(U/L)第1天 16.95±6.12 10.11±3.20 40.13±6.98 50.11±4.89第3天 37.21±9.87▲ 19.14±8.02▲ 151.23±80.06▲ 611.25±130.08▲第5天 28.96±6.01▲△ 13.96±2.29▲△ 93.89±32.48▲△ 180.46±63.87▲△第7天 11.02±3.76▲△# 10.02±3.16△# 40.63±5.21△# 49.95±5.97△#第10天6.23±2.96▲△#* 5.12±2.45▲△#* 20.12±4.65▲△#* 30.01±2.15▲△#*
2.2.2 中症组 中症组的4项实验室指标在第3天达到最高,此后迅速下降,在第10天完全恢复正常。除BA值第5天与第7天比较差异无统计学意义(P>0.05),其他各项实验室指标分别与1、3、5、7 d比较,差异有统计学意义(P<0.01)。见表3。
表3 中症组实验指标变化比较 (n=22,±s)
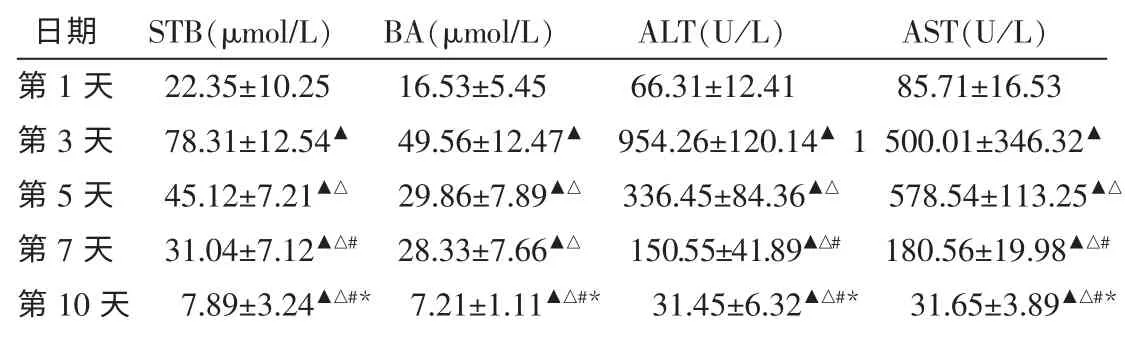
表3 中症组实验指标变化比较 (n=22,±s)
注:与第1天比较▲P<0.01;与第3天比较△P<0.01;与第5天比较#P<0.01;与第7天比较*P<0.01。
日期 STB(μmol/L) BA(μmol/L) ALT(U/L) AST(U/L)第1天 22.35±10.25 16.53±5.45 66.31±12.41 85.71±16.53第3天 78.31±12.54▲ 49.56±12.47▲ 954.26±120.14▲1 500.01±346.32▲第5天 45.12±7.21▲△ 29.86±7.89▲△ 336.45±84.36▲△ 578.54±113.25▲△第7天 31.04±7.12▲△# 28.33±7.66▲△ 150.55±41.89▲△# 180.56±19.98▲△#第10天 7.89±3.24▲△#* 7.21±1.11▲△#* 31.45±6.32▲△#* 31.65±3.89▲△#*
2.2.3 重症组与对照组实验指标动态变化 重症组的4项实验室指标在第3天达到最高,此后迅速下降,在第10天完全恢复正常。除ALT值第1天与第7天比较差异无统计学意义(P>0.05),其他各项实验室指标分别与1、3、5、7 d比较,差异有统计学意义(P<0.01)。重症组4项实验室指标在1、3、5、7 d分别与对照组比较,差异无统计学意义(P>0.05)。见表4。
表4 重症组与对照组实验指标变化比较 (±s)
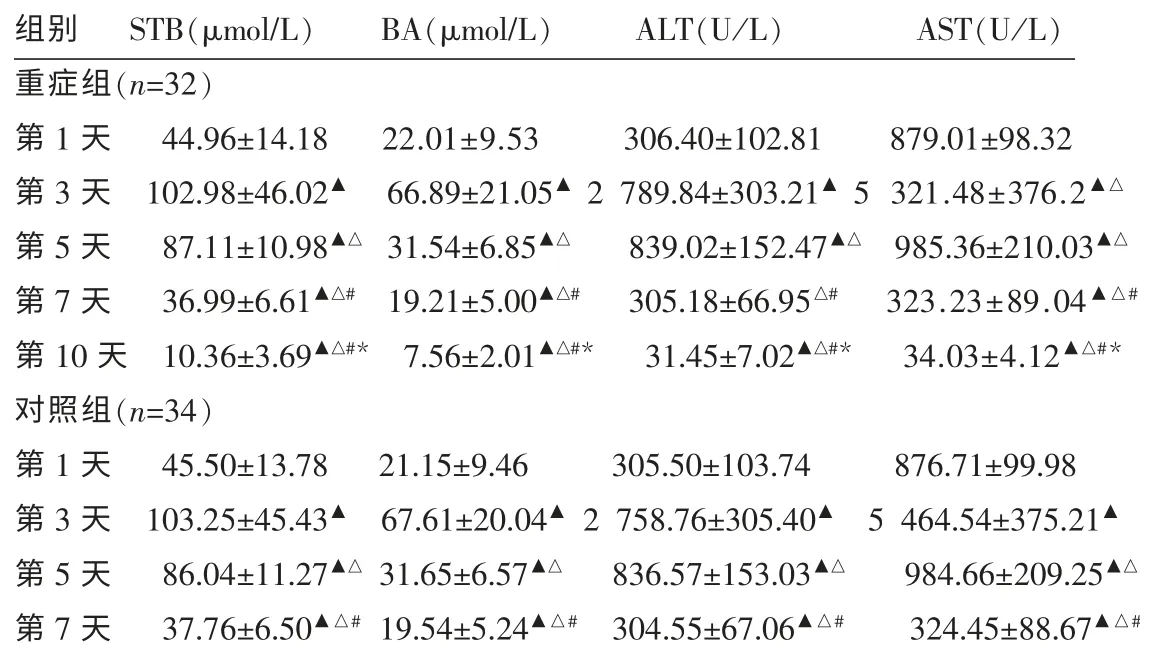
表4 重症组与对照组实验指标变化比较 (±s)
注:与第1天比较▲P<0.01;与第3天比较△P<0.01;与第5天比较#P<0.01;与第7天比较*P<0.01。对照组与重症组第1、3、5、7天比较P>0.05。
组别 STB(μmol/L) BA(μmol/L) ALT(U/L) AST(U/L)重症组(n=32)第1天 44.96±14.18 22.01±9.53 306.40±102.81 879.01±98.32第3天 102.98±46.02▲ 66.89±21.05▲2 789.84±303.21▲5 321.48±376.2▲△第5天 87.11±10.98▲△ 31.54±6.85▲△ 839.02±152.47▲△ 985.36±210.03▲△第7天 36.99±6.61▲△# 19.21±5.00▲△# 305.18±66.95△# 323.23±89.04▲△#第10天 10.36±3.69▲△#* 7.56±2.01▲△#* 31.45±7.02▲△#* 34.03±4.12▲△#*对照组(n=34)第1天 45.50±13.78 21.15±9.46 305.50±103.74 876.71±99.98第3天 103.25±45.43▲ 67.61±20.04▲2 758.76±305.40▲ 5 464.54±375.21▲第5天 86.04±11.27▲△31.65±6.57▲△ 836.57±153.03▲△ 984.66±209.25▲△第7天 37.76±6.50▲△#19.54±5.24▲△# 304.55±67.06▲△# 324.45±88.67▲△#
3 讨论
鹅膏蕈(amanita mushroom)属真蕈门、担子蕈亚门、担子蕈纲、伞蕈目、鹅膏蕈科、鹅膏蕈属一类真菌总称,其中绝大部分属于剧毒型。鹅膏毒蕈毒素含量高,仅1个子实体就可致死。因其中毒发病率高,病死率高(成人>20%,儿童>50%),误食野生蘑菇引起的中毒事件中,95%以上是由鹅膏毒蕈引起的[3、4]。鹅膏毒肽是鹅膏蕈所含的最重要的致死毒素[5],它性质稳定,耐高温、冷藏、干燥、酸碱,一般烹调不能使其破坏,饮用蕈汤也可中毒。食入后,毒素可迅速被消化道吸收进入肝脏,并能迅速与肝细胞RNA聚合酶结合抑制mRNA的生成,造成肝细胞坏死而致急性肝功能衰竭,甚至致人死亡。鹅膏毒肽与聚合酶解离后,经胆汁排泄,但进入肠道后,又可被吸收再次进入肝脏,形成肠肝循环[6]。鹅膏毒肽属于慢作用毒素,其中毒的临床特点为:①发病有明显的季节性,一般发生在湖南地区的5~6月份;②具有群体发病的流行病学特点(往往是全家或同食团体成员);③死亡率甚高[7](60%以上);④临床过程典型:潜伏期(3~12 h)、胃肠炎期(24~48 h)、假愈期(24~48 h)、内脏损害期和恢复期(持续时间较长),实际上大部分中毒病人死于内脏损害期;⑤灵芝煎剂有特效。本组病例也显示,鹅膏蕈中毒表现以肝脏损害为主。
灵芝无毒,被人们视为“仙草”,为担子菌类多孔菌科灵芝属植物。灵芝的干燥子实体,含有多糖、三萜化合物(主要是灵芝酸)、真菌溶菌酶、多肽、腺嘌呤、腺苷、尿嘧啶、尿苷及D-甘露糖等。动物实验表明[8,9],灵芝能增强机体超氧化物酯化酶(SOD)活性、清除或抑制氧自由基从而抑制细胞膜脂质过氧化,增加膜稳定性,对肝有解毒作用,能明显抑制肝脏肿胀,降低血清ALT和AST,并使肝脏损坏程度减轻。由于鹅膏蕈中毒以肝脏损害为主,我科从2002年以来用灵芝煎剂治疗鹅膏蕈中毒取得明显疗效,已有多篇论文[1、10]证实灵芝煎剂对鹅膏毒蕈中毒有特效,对机体重要脏器有明显的保护作用(尤其是肝脏),能使死亡率显著下降。但因其口感差,煎煮费时,急症患者待药时间延长且受条件限制,而灵芝胶囊完整地保留了灵芝药效,笔者采用灵芝胶囊替代灵芝煎剂,经临床研究发现灵芝胶囊治疗鹅膏蕈中毒的特点:①临床疗效显著,2009~2011年本科收治该类病人69例,全部治愈。②实验指标恢复正常快,本组病例所观察的实验指标,大多在治疗后1周内恢复正常,在10 d内全部完全恢复正常。③灵芝胶囊治疗组与灵芝煎剂历史对照组疗效相同。通过灵芝胶囊对69例临床病例的治疗,笔者认为灵芝胶囊在治疗鹅膏蕈中毒方面,与灵芝煎剂有等同疗效,完全可以替代灵芝煎剂。
[1]肖桂林,陈作红,李湘民,等.灵芝煎剂治疗鹅膏毒蕈中毒103例临床观察[J].湖南中医药大学学报,2006,26(5):44-45.
[2]何德剑,李 健,陈双秀.灵芝治疗鹅膏毒蕈中毒的疗效观察[J].美国中华临床医学杂志,2006,8(3):260-262.
[3]Litten W.The nlost poisonous mushrooms[J].Sci Anl,1975,232:90-101.
[4]杨祝良.我国的几种剧毒鹅膏菌[J].中国食用菌,2002,21(3):17-l8.
[5]张志光,张晓元,李东屏.鹅膏菌多肽毒素在生命科学研究中的应用[J].卫生研究,1999,28(1):60-63.
[6]杨柞荣,卢 振,李 秋.灵芝菌丝体对化学性肝损伤小鼠的保护作用[J].医药导报,2005,27(7):570-572.
[7]张志光,刘建强,陈作红,等.某市36起毒菌中毒事件调查[J].现代预防医学,2002,29(3):301-304.
[8]杨 宁,肖桂林.灵芝煎剂对鹅膏毒蕈中毒兔肝细胞保护作用的实验研究[J].中国中西医结合急救杂志,2006,27(5):570-572.
[9]张庆萍,胡显亚.灵芝孢子粉对肝脏保护作用的药理实验研究[J].基层中药杂志,1997,11(1):40.
[10]肖桂林,刘发益,陈作红,等.灵芝煎剂治疗鹅膏毒蕈中毒的临床研究[J].湖南中医学院学报,2003,23(1):43-45.
