鱼腥草植株间总蛋白量差异性研究
2013-06-09张喜利刘文龙贺福元王海琴杨岩涛石继连李顺祥
张喜利,刘文龙,2,3,贺福元,3,王海琴,杨岩涛,3,石继连,3,李顺祥,4
(1.湖南中医药大学药学院,中药现代化重点实验室,湖南 长沙410208;2.湖南师范大学生科院,湖南 长沙410081;3.中药药性与药效国家中医药管理局重点实验室,湖南 长沙410208;4.湖南省中医药研究院 中药新药研究与开发省重点实验室,湖南 长沙410013)
中药的质量研究一直是中药现代化进程的“焦点”之一,亦是中药研究和应用的一个重点与难点。目前,许多中药专家学者对此开展了大量的研究,取得了可喜的成效。前期研究表明中药遗传基因具有多态性,且这种基因多态性现象是引起中药质量不稳定——中药植物体内二次代谢产物(中药有效成分)差异性的内因[1-3]。蛋白质是基因表达的产物,亦即中药遗传基因的多态性促成了中药的蛋白质及酶的多样性,蛋白质及酶的多样性作用于中药的生长过程从而使得中药成分波动。故从蛋白质(酶)多样性方面更深层次地探究药用植物体内二次代谢产物——中药成分的差异情况及规律,更直观的、更确切、更具说服力。
本文从鲜鱼腥草的总蛋白的提取着手,探索适宜新鲜鱼腥草植株的最佳提取总蛋白的方法,建立鱼腥草总蛋白含测方法,测算出各植株含总蛋白的量,从蛋白总量的角度初步揭示53株鲜鱼腥草的总蛋白存在多样性,现将实验结果报道如下。
1 实验仪器与材料
1.1 仪器
TGL-16LM型高速冷冻离心机(湖南星科科学仪器有限公司);WH-2微型漩涡混合仪(上海沪西分析仪器厂);MA110型电子天平(上海天平仪器厂);DK-8D电热恒温水槽(上海精宏实验设备有限公司);Biophotometer核酸蛋白分析仪(德国Eppendorf公司);ZK-82A型真空冷冻干燥箱(上海实验仪器总厂);LDZX-30KBS立式压力蒸气灭菌器(上海申安医疗器械厂);CM-230超纯水系统(北京帕思特科技有限公司);WD-9415F型超声波清洗器(北京市六一仪器厂);756型紫外可见分光光度计(上海光谱仪器有限公司);灭菌EP管移液器。
1.2 药材
鱼腥草(Houttuynia cordata Thumb),采自湖南怀化GAP种植基地,由本院中药鉴定教研室刘塔斯教授鉴定。
1.3 试剂
液氮,三氯乙酸(TCA),丙酮,PVP(上海捷瑞生物工程有限公司),β-巯基乙醇(Sigma Chemical Co.),标准牛血清蛋白(BSA,Thermo,23209);提取溶剂I:10%三氯乙酸和0.07%β-巯基乙醇丙酮液;提取溶剂Ⅱ:0.07%β-ME丙酮溶液;提取溶剂Ⅲ:80%的丙酮溶液;标准蛋白质溶液:用牛血清蛋白(BSA)配制成1.0 mg/mL和0.1 mg/mL标准蛋白质溶液;考马斯亮蓝G-250染料试剂:称100 mg考马斯亮蓝G-250,溶于50 mL 95%乙醇后,再加入100 mL 85%磷酸,用超纯水稀释至1 L。
2 方法与结果
2.1 新鲜鱼腥草药材的预处理
采收同一产地同一批次鲜鱼腥草,去其枯叶、黄叶、斑叶及尘土后,用自来水洗净后阴干;每单株称质量后分装于封口袋中,得53株鱼腥草样品,置-44℃冰箱冻存备用。
2.2 鱼腥草总蛋白的提取[4-6]
本文采用三氯乙酸-丙酮沉淀(TCA-acetone)法提取,其步骤如下:(1)分别取各株鱼腥草(-44℃冻存)嫩叶约1.0 g,迅速放入预冷的研钵中,并加入约0.1 g PVP,加液氮研磨成粉末;(2)装入-20℃预冷的提取溶剂I(5.0 mL)中,涡旋振荡1 min,充分混匀,-20℃静置过夜;(3)4℃,15 000 r/min离心30 min,弃上清液;(4)加入-20℃预冷的提取溶剂Ⅱ(5.0 mL),涡旋振荡1 min,充分混匀,-20℃静置1 h;(5)4℃,15 000 r/min离心30 min,弃上清液;(6)重复步骤(4)、(5)2次;(7)加入-20℃预冷的蛋白质提取液Ⅲ(5.0 mL),涡旋振荡15 s;(8)4℃下15 000 r/min离心25 min,弃上清液;(9)-20℃静置过夜,次日于-44℃真空冷冻干燥,即得鱼腥草总蛋白质干粉,于-20℃冻存、备用。
2.3 样品溶剂制备
分别精密称取各株所制得的蛋白质干粉约40.0 mg于1.5 mL离心管中。用6×样品缓冲液按1∶20(w/v)溶解,涡旋振荡30 s,置水浴锅37℃水浴1.5 h,4℃下13 000 r/m in离心25 min,取上清液置0.5 mL的灭菌离心管中再次离心,取上清液,依次分装于灭菌EP管,-44℃冰箱储存,即得。
2.4 蛋白质含量测定
采用Ramagli改进的Bradford[7-9]法测定,其操作步骤如下。
2.4.1 标准曲线的制作 取8支10 mL试管,2支做空白,其余6支分别加入1.0 mg/mL的标准蛋白质溶液0、0.01、0.02、0.04、0.06、0.08、0.1 mL,然后用去离子水补充至0.1 mL,最后各试管中分别加入5.0 mL考马斯亮蓝G-250试剂,每加完一管,立即在漩涡混合器上混合2~5 min,依次测定吸光度(A595),每个标样重测3次实验,读取其平均值;以吸光度值(y,A595)为纵坐标,以标准蛋白浓度(x)为横坐标进行回归,得回归方程为:
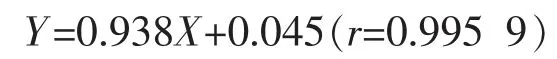
表明标准蛋白在0.1~1.0μg/μL浓度范围内线性良好。
2.4.2 样品测定
取待测样品溶液15μL,用去离子水稀释至100μL,加入5.0 mL Bradford工作液,涡旋混匀3~5 min后,测定样品的A595,每个样品重测3次,读取其平均值代入上述回归方程,即可求得各株鱼腥草样品的蛋白量浓度,最后折算成各株100 g鱼腥草所含蛋白的量(见表1)。
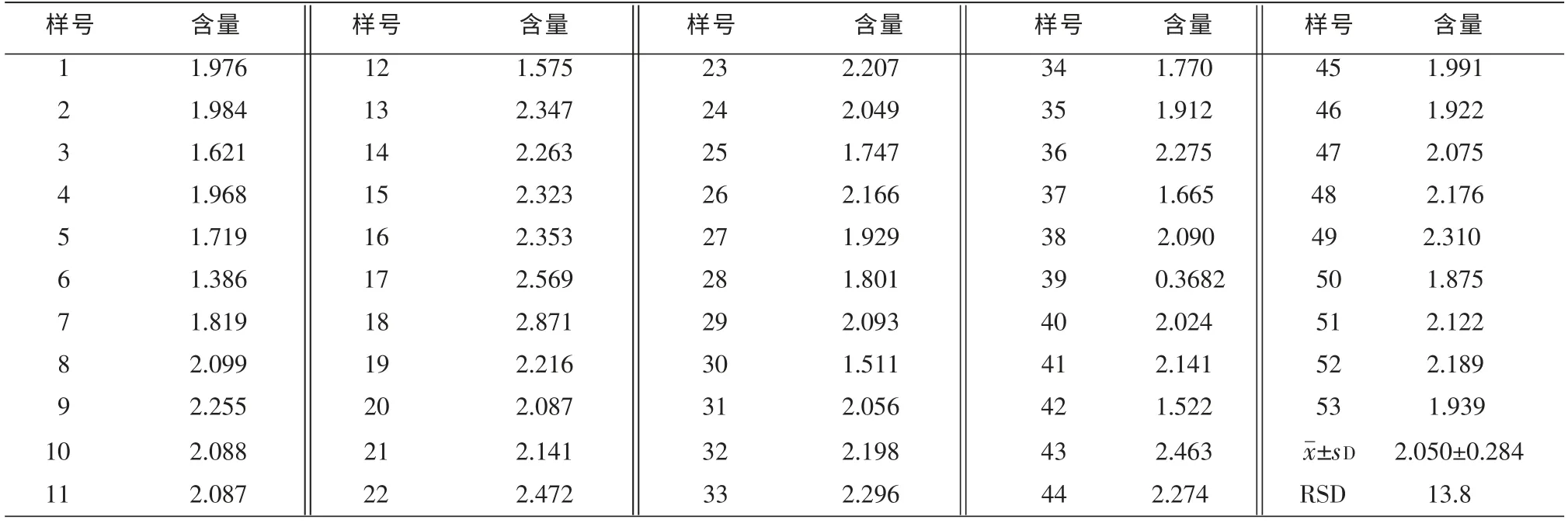
表1 53株鱼腥草蛋白含量测定结果 (%)
3 讨论
3.1 蛋白质提取方法分析及注意事项
鱼腥草总蛋白的提取是进行其总蛋白差异性、多样性研究、鱼腥草植物代谢网络等系列研究的起点,因此适宜鱼腥草鲜药材总蛋白的提取方法甚为重要。由于不同物种不同器官或组织的化学组成不同,甚至同一植物不同组织其蛋白组成不同,所以其最适蛋白质提取方法也不同。因此,目前还无一种能够适用于所有植物不同物种和不同器官组织的普遍的提取蛋白质的标准方法。本课题组在前期预实验中选用了[10-12]TCA-丙酮沉淀法、Tris法和磷酸缓冲液(PBS)法[13,14]对鲜鱼腥草叶片总蛋白的提取进行对比研究,从SDS-PAGE电泳发现TCA-丙酮沉淀法所获得的蛋白条带最多且清晰度最高,故认为TCA-丙酮沉淀法较后两者更适宜于鱼腥草总蛋白的提取;再者,鱼腥草植物叶片中富含酚类、醌类及色素类物质,它可以通过氢键等方式与蛋白质结合,影响后续的研究工作。因此,在用液氮研磨组织叶片时,应加入β-巯基乙醇和聚乙烯吡咯烷酮(PVP),可以有效减少叶片中酚类、色素等干扰物质。另外操作中还需注意:整个操作全过程应需在冰上进行,以防蛋白质降解;所用的三氯乙酸和丙酮均应事先制冷,提取时用80%冷丙酮少量多次反复洗涤沉淀;适量加大离心转速和延长离心时间,均能有效除去多糖和盐分等杂质成分。
3.2 鱼腥草总蛋白量差异性分析及讨论
蛋白质是基因表达的产物,其种类和数量随着机体、组织和细胞状态的不同而不同。因此,从蛋白质水平上系统全面地认识中药生长过程中的代谢合成途径、代谢网络以及与中药质量稳定的关联性问题,更能接近真实,更易揭示真相。故本文首先仅从鱼腥草总蛋白质(酶)量的差异性研究展开研究。
在蛋白质测定方法方面:准确测定每一植株鱼腥草蛋白质的量,找出其差异性是进行蛋白多样性研究的第一步。获悉准确的蛋白浓度也是把握电泳上样量,获得预期结果的保证。目前,蛋白浓度的测定方法很多,如紫外分光光度法(UV法)、Bradford法、BCA法、双缩脲法、Lowry法和试剂盒法等,原理基本相似。本文采用Ramagli改进的Bradford法[15],此法较其他测定方法不易受Na+、K+、Mg2+、(NH4)2SO4、非蛋白质复合物(如酚类)等因素的干扰;且操作简便、反应迅速和灵敏度较高,可保证蛋白浓度测定的准确性。
在总蛋白差异性研究方面:中药材的形成过程是伴随生命现象的一个复杂的新陈代谢,因此在“5P”质控模式下中药材质量仍因遗传与变异规律使得其质量个体间也必将存在一定程度上的差异,即个体间存在多态性或者多样性。从表1结果可知,鱼腥草各植株蛋白含量在1.766%~2.334%范围间变化,其RSD为13.8%。说明即便同一GAP产地不同株植物仍然存在含量差异。也就是说总蛋白的株间差异性是存在的,欲知是否蕴藏着总蛋白酶的差异,其蛋白酶的差异具体体现在种类上还是数量上,均需进一步探讨。本文仅从鱼腥草蛋白的提取及含量测定及差异性进行了研究讨论,为后续研究奠定了一定基础。
[1]刘文龙,张喜利,贺福元,等.稳态提取工艺中平衡群体的研究及对鱼腥草的实验验证[J].中国中药杂志,2011,36(21):20-25.
[2]王海琴,刘文龙,贺福元,等.基于鱼腥草ISSR扩增条带信息熵的一次投料量的研究[J],中国中药杂志,2012,37(3):20-25.
[3]刘文龙,张喜利,聂志娇,等.鱼腥草遗传多态性指纹图谱变异研究[J].湖南中医药大学学报,2010,30(7):28-30.
[4]李一婧,马伟超,王廷璞,等.宁夏枸杞中蛋白质的提取与鉴定[J].种子,2011,30(9):59-61.
[5]冯郁蔺,陈 伟,张清安.杏仁蛋白质的提取及功能特性研究进展[J].农产品加工.学刊,2011(9):61-63.
[6]王廷璞,马伟超.甘肃党参中蛋白质的提取分析[J].资源开发与市场,2011,27(7):582-583.
[7]海广范,张 慧.水的酸碱度对Bradford法检测蛋白质含量的影响[J].新乡医学院学报,2009,26(2):144-146.
[8]张志涛,刘金生,许 强,等.Bradford法测定牛奶中蛋白质含量[J].食品与机械,2011,27(5):128-130.
[9]王伟楠,赵 雨,李红艳,等.人参蛋白四种提取方法的比较研究[J].食品工业科技,2010,31(5):280-281.
[10]张 帅,张培宜,冯翠萍.板栗蛋白质的提取及多肽的制备[J].山西农业大学学报:自然科学版,2011,31(1):73-76.
[11]唐泽丽,李多伟,王 瑶,等.秦艽种子蛋白质的提取及SDS电泳研究[J].西北药学杂志,2011,26(2):94-96.
[12]毛泉明,张宁,王忆勤.地龙中蛋白质的提取工艺研究[J].上海中医药杂志,2010,44(3):74-77.
[13] CARPENTIERSC,WITTERSE,LAUKENSK,etal.Preparation of protein extracts from recalcitrant plant tissues:An evaluation of different methods for two-dimensional gel electrophoresis analysis[J].Proteomics,2005,5(10):2497-2507.
[14]杨文鹏,王明春,杨留启,等.玉米总蛋白质提取技术和蛋白质样品浓度测定方法的比较[J].种子,2010,12(29):18-22.
[15]Shewry P R,Tatham A S,Lazzeri P.Biotechnology of wheat quality[J].Journal of the Science of Food and Agriculture,1997,73(4):397-406.
[16]刘文龙,张喜利,贺福元,等.同一GAP产地鱼腥草株间基因多态性研究[J].湖南中医药大学学报,2011.31(11):30-33.
