TNF-α和IL-1β对人脐静脉内皮细胞蛋白C受体mRNA表达的影响
2013-06-07郭小芳刘海波任惠龙龚维坤
郭小芳 刘海波 任惠龙 龚维坤
浙江省宁波市鄞州人民医院 宁波 315040
成兴波 苏州大学医学院附属第一医院
TNF-α和IL-1β对人脐静脉内皮细胞蛋白C受体mRNA表达的影响
郭小芳 刘海波 任惠龙 龚维坤
浙江省宁波市鄞州人民医院 宁波 315040
成兴波 苏州大学医学院附属第一医院
目的:观察肿瘤坏死因子α(TNF-α)和白细胞介素1β(IL-1β)对人脐静脉内皮细胞(ECV304)蛋白C受体(EPCR)mRNA表达的影响。方法:通过体外培养ECV304细胞,分别以含TNF-α和IL-1β的培养基孵育ECV304细胞,行剂量和时间依赖性实验。采用实时定量聚合酶链反应(quantitative real-time PCR)技术测定ECV304细胞EPCR mRNA的表达。结果:TNF-α和IL-1β均能显著下调ECV304 EPCR mRNA的表达,并呈剂量和时间依赖性(P<0.05)。结论:TNF-α和IL-1β可能通过显著下调ECV304上EPCR mRNA的表达而成为损伤内皮细胞功能的一个新作用机制。
内皮细胞 肿瘤坏死因子 白细胞介素-1 内皮细胞蛋白C受体
内皮细胞功能受损是动脉粥样硬化的始动因素,也是心脑血管疾病发生的重要原因[1]。既往研究[2]显示,肿瘤坏死因子α(TNF-α)、白介素-1β(IL-1β)作为炎症细胞因子,在内皮细胞功能受损及动脉粥样硬化中发挥重要的作用,但其作用机制尚不十分清楚。内皮细胞蛋白C受体(endothelial protein C receptor,EPCR)是近年发现的蛋白C(protein C,PC)系统的一个新成员,主要表达于内皮细胞,它能与PC特异性结合,使PC活化效率提高5倍,而发挥抗凝作用,近年的研究表明EPCR也有重要的抗炎作用[3-5]。而炎症因子是否通过影响EPCR而损伤内皮细胞功能,目前还不十分明确。本研究观察炎症因子TNF-α、IL-1β对EPCRmRNA表达的影响,探讨炎症因子损伤内皮细胞功能的新机制。
1 材料与方法
1.1 药物与试剂 RPMI-1640培养基购自美国Gibco公司;小牛血清、胎牛血清购自杭州四季青公司;琼脂糖购自美国Amresco公司;胰酶购自Difcd公司;FITC-羊抗鼠二抗购自Immunotech公司;Trizol购自美国Invitrogen公司;DEPC购自BBI公司;M-MLV、随机引物和dNTP购自美国Promega公司;RNA酶抑制剂(Rnasin)购自上海华美生物技术公司;Taq酶、人重组肿瘤坏死因子(TNF-α)、人重组白介素-1β(IL-1β)购自上海晶美生物工程有限公司;ECV304为苏州大学附属第一医院血栓与止血研究室冻存细胞株;鼠抗人EPCR多克隆抗体由王迎春教授惠赠;鼠抗人单克隆β-actin购自Sigma公司。
1.2 主要仪器 Ex TaqTM R-PCR Version 2.1购自大连宝生物公司;Eva Green购自美国Biotium公司;实时定量(real-time)PCR仪MJ Research Option2TM购自MJ公司;PCR引物由上海生物工程有限公司合成。
1.3 方 法
1.3.1 人脐静脉内皮细胞培养 人脐静脉内皮细胞株ECV304细胞用含15%小牛血清的RPMI-1640培养基按常规实验方法培养。实验用为其3~5代。
1.3.2 实验方法 实验一:ECV304细胞用含TNF-α的低血清(含3%小牛血清)RPMI-1640培养基培养12h,观察不同浓度TNF-α(2、10、25ng∕mL)时EPCR mRNA的表达;同时以含TNF-α10ng∕mL的低血清(含3%小牛血清)RPMI-1640培养基培养ECV304细胞,行时间依赖(1、3、6、12h)实验。以相同时间的不加刺激剂组为对照。实验二:ECV304细胞用含IL-1β的低血清(含3%小牛血清)RPMI-1640培养基培养12h,观察不同浓度IL-1β(5、10、20ng∕mL)时EPCRmRNA的表达;同时以含IL-1β10ng∕mL的低血清(含3%小牛血清)RPMI-1640培养基培养ECV304细胞,行时间依赖(0.5、3、6、12h)实验。每个实验组设5个复孔,每次实验重复3次。采用逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)技术检测EPCRmRNA的表达。
1.3.3 总RNA抽提及逆转录 利用Trizol试剂从各组ECV304细胞中提取总RNA,并将mRNA浓度调整至0.5g∕L。常规方法逆转录。
1.3.4 聚合酶链反应(polymerase chain reaction, PCR) β-actin引物序列:上游 5′-CTCGCGC⁃TACTCTCTCTTTC-3′,下游5′-CAGTCTCGATCCCACTTAA-3′,扩增片段330bp。EPCR引物序列:上游:5′-ATTGCTGCCGATACTGCT-3′,下游:5′-AGAGGAAAGGCCAAGGTC-3′,扩增片段318bp。以上序列由上海生物工程有限公司合成。以β-actin(330bp)作内参照。反应条件:EPCR为94℃4min后开始循环,94℃40s→58℃40s→72℃40s,共30个循环,最后72℃10min充分延伸;β-actin为94℃4min后开始循环,94℃40s→58℃40s→72℃40s,共28个循环,最后72℃10min充分延伸。反应后1.5%琼脂糖凝胶上样,电泳鉴定结果。
1.3.5 实时定量PCR(quantitative real-time polymerase chain reaction,real-time PCR) 反应体系:5× buffer5μL,Mg2+(250Mm)0.25UL,dNTP(10Mm)0.75μL,Taq酶(250U∕50ul)0.25μL,上游引物(10Mm)0.5μL,下游引物(10mM)0.5μL,Evagreen(10mM)0.5μL,双蒸水15.45μL,cDNA 2μL,共25μL体系;反应条件:95℃5min预变性,95℃15s→58℃25s→72℃25s→78℃0.1s;读板;50个循环;60℃~96℃0.3s融解曲线;72℃5min;4℃,forever。结果计算公式:①相对量=2-△C(T),△C(T)=目的基因C(T)-内参基因C(T);②实验组∶对照组的相对量:2-△△C(T),△△C(T)=实验组△C(T)-对照组△C(T)。
1.3.6 统计学方法 各次实验最终结果用均数±标准差(±s)作为统计资料。采用t检验或单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 RT-PCR结果 ECV304细胞膜上有较高的EPCRmRNA表达,见图1。

图1 ECV304细胞EPCR mRNA表达
2.2 TNF-α和IL-1β对ECV304细胞EPCR mRNA表达的影响
2.2.1 不同浓度TNF-α对人脐静脉内皮细胞(ECV304)EPCR mRNA的影响 ECV304细胞EP⁃CRmRNA水平采用real-time PCR测定。已80%融合的ECV304细胞中加入TNF-α使其浓度分别达2、10、25ng∕mL,以低血清(含3%小牛血清)RPMI-1640培养基培养ECV304细胞为空白对照。12h后EPCR mRNA分别是对照组(100%)的(48.28±0.95)%(P<0.01)、(35.54±0.87)%(P<0.01)、(25.42±0.50)%(P<0.01),TNF-α2ng∕mL时即能明显下调ECV304细胞EPCRmRNA的表达,EPCRmRNA的表达呈剂量依赖性,见图2。

图2 不同浓度TNF-α对EPCR mRNA的影响
2.2.2 不同时间TNF-α对人脐静脉内皮细胞(ECV304)EPCR mRNA表达的影响 ECV304细胞EPCR mRNA水平采用real-time PCR测定。10ng∕mL TNF-α分别作用ECV304细胞1、3、6、12h。以低血清(含3%小牛血清)RPMI-1640培养基培养ECV304细胞为空白对照。与空白对照组(100%)相比,1、3、6、12h时EPCRmRNA水平分别是(56.42± 0.58)%(P<0.01)、(46.38±0.49)%(P<0.01)、(39.26± 0.61)%(P<0.05)和(35.54±0.87)%(P<0.01),TNF-α处理ECV304细胞1h时即能明显下调EPCRmRNA的表达,EPCRmRNA的表达呈时间依赖性,见图3。

图3 不同时间相同浓度TNF-α对EPCR mRNA表达的影响
2.2.3 不同浓度IL-1β对人脐静脉内皮细胞(ECV304)EPCR mRNA表达的影响 ECV304细胞EPCRmRNA水平采用real-time PCR测定。已80%融合的ECV304细胞中加入IL-1β使其浓度分别达5、10、20ng∕mL,以低血清(含 3%小牛血清)RP⁃MI-1640培养基培养ECV304细胞为空白对照。12h后EPCR mRNA分别是对照组(100%)的(40.70± 0.98)%(P<0.01)、(34.44±0.56)%(P<0.01)、(10.74± 0.36)%(P<0.01),IL-1β5ng∕mL时即能明显下调ECV304细胞EPCRmRNA的表达,EPCRmRNA的表达呈剂量依赖性,见图4。
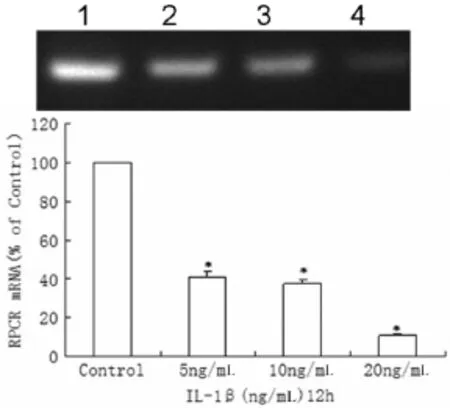
图4 不同浓度IL-1β对EPCR mRNA的影响
2.2.4 不同时间IL-1β对人脐静脉内皮细胞(ECV304)EPCR mRNA表达的影响 ECV304细胞EPCR mRNA水平采用real-time PCR测定。10ng∕mL IL-1β分别作用ECV304细胞0.5、3、6、12h。与空白对照组(100%)相比,0.5、3、6、12h时EPCRmRNA水平分别是(61.68±0.69)%(P<0.01)、(61.05±0.59)%(P<0.01)、(50.66±0.29)%(P<0.05)和(32.94±0.93)%(P<0.01),IL-1β处理ECV304细胞0.5h时即能明显下调EPCRmRNA的表达,EPCRmRNA的表达呈时间依赖性,见图5。
3 讨论
炎症因子是影响血管内皮细胞功能最重要的因素之一。现已证实TNF-α、IL-1为致内皮细胞损伤的重要炎症因子。它们可以启动炎症反应,从而导致血管内皮细胞损伤,是促使动脉粥样硬化发生发展的重要因素。
EPCR是近年发现的PC系统的一个新成员,是一个由221个氨基酸组成的Ⅰ型跨膜糖蛋白,主要表达于大血管内皮细胞,其通过凝血酶(thrombin)-凝血酶调节蛋白(thrombomodulin,TM)复合物增进PC活性,提高PC的活化率,从而发挥抗凝作用[6]。EPCR的抗炎作用是PC系统近年研究的重要进展[7]。在盲肠结扎穿孔致复合菌感染的脓毒症模型中,PC水平明显下降,同时EPCR表达代偿性增加[8]。
因此,TNF-α、IL-1β有可能是通过影响EPCR从而损伤内皮细胞的功能。目前国外的相关研究甚少,国内目前还未见相关报道。国外有研究发现TNF-α能显著下调EPCRmRNA表达[9-10],并呈剂量依赖性。另外,Margarita等[11]发现IL-1β能促进内皮细胞释放可溶性内皮细胞蛋白C受体(sEPCR),并下调ECV304细胞表面EPCR的表达。上述研究虽分别表明TNF-α和IL-1β能通过下调EPCR的表达而损伤内皮细胞功能,但他们均是对单一炎症因子的研究,也未同时进行时间及剂量依赖性实验。而在本研究中同时纳入TNF-α和IL-1β这两种有代表意义的炎症因子,观察其对内皮细胞EPCR表达的影响,并同时进行了时间和剂量依赖试验,实验设计更合理,实验结果更具有说服力。本研究发现EPCR mRNA在ECV304细胞膜上表达,TNF-α在2ng∕mL时即能显著下调ECV304细胞EPCRmRNA的表达,并呈剂量依赖关系;TNF-α浓度为10ng∕mL时处理ECV304细胞,1h后即能观察到EPCRmRNA的表达较对照组显著下降,且呈时间依赖关系,同时也发现IL-1β具有类似的作用。本研究证明了TNF-α、IL-1β对EPCRmRNA表达的下调是其损害内皮细胞功能的新机制,这可能为动脉粥样硬化的防治提供了新的思路。
[1]De Caterina R.Endothelial dysfunctions:common denominators in vascular disease[J].Curr Opin Lipidol,2000,11(1): 9-23.
[2]于健宁,马纪林,陶筱娟.白鹤冲剂对TNF刺激的血管内皮细胞与嗜中性粒细胞黏附的影响[J].浙江中西医结合杂志,2011,21(12):840-843.
[3]Macias WL,Yan SB,Williams MD,et al.New insights into the protein C pathway:potential implications for the biological activities of drotrecogin alfa(activated)[J].Crit Care,2005,9(4):S38-S45.
[4]Esmon CT.Inflammation and the activated protein C anticoagulant pathway[J].Semin Thremb Hemost,2006,32(1): 49-60.
[5]O Brien LA,Gupta A,Grinnell BW.Activated protein C and sepsis[J].Front Biosci,2006,1(1):676-698.
[6]Van de Water NS,French JK,McDowell J,et al.The endothelial protein C receptor(EPCR)23bp insert in patients with myocardial infarction[J].Thromb Haemost,2001,85(4):749-751.
[7]Esmon CT.Crosstalk between inflammation and thrombosis[J].Maturitas,2008,61(1-2):122-131.
[8]Gupta A,Berg DT,Gerlitz B,et al.Role of protein C in renal dysfunction after polymierobial sepsis[J].J An1 Soc Nephrel,2007,18(3):860-867.
[9]Bicheng Nan,Peter Lin,Alan B,et al.Effects of TNF-α and curcumin on the expression of thrombomodulin and endothelial protein C receptor in human endothelial cells[J].Thrombosis Research,2005,115(5):417-426.
[10]Youqin Chen,Jun Peng,Xiaoheng Liu,et al.Activated Protein Cameliorates TNF-α induced Inflammatory Response of Endothelium Via the Endothelial Protein C Receptor[J]. Journal of Biomedical Engineering,2009,26(3):625-630.
[11]Margarita Perez-Casal,Colin Downey,Kenji Fukudome,et al.Activated protein C induces the release of microparti-cle-associated endothelial protein C receptor[J].Blood,2005,105(4):1515-1521.
致作者
2013年1月1日起,请登录我刊官方网站http:∕zjzxy.alljournal.com.cn:8080投递稿件,或登录杭州市红十字会医院网站(www.hzhhyy.com)点击左上角《浙江中西医结合杂志》链接进入。本刊邮箱不再接受投稿,敬请谅解。
Effects of TNF-α and IL-1β on EPCR mRNA in endothelial cells
GUO Xiaofang,LIU Haibo,REN Huilong,et al.Yinzhou People’s Hospital,Ningbo(315040),China
Objective:To investigate the effect of tumor necrosis factor alpha(TNF-α)and interleukin-1 beta (IL-1β)on the expression of endothelial protein C receptor(EPCR)in human umbilical vein endothelial cells (ECV304).Methods:Cultured ECV304 were used as target cells.Different concentrations of TNF-αor IL-1β were added to the culture medium to establish the injury model of ECV304.EPCR mRNA were measured by quantitative real-time PCR.Results:The expression of EPCR in ECV304 was down-regulated by TNF-αand IL-1βin dose and time dependent manner.Conclusion:Both TNF-αand IL-1β may damage the function of endothelial cells by down-regulating the expression of EPCR mRNA.
endothelial cells tumor necrosis factor interleukin-1 endothelial protein C receptor
2012-09-24
