超高效液相色谱-串联质谱法鉴别十字花科植物中硫代葡萄糖苷*
2013-06-05赵振东李嘉诚冯玉红孟晓静金彪
赵振东,李嘉诚,冯玉红,孟晓静,金彪
(海南大学材料与化工学院,海口 570228)
超高效液相色谱-串联质谱法鉴别十字花科植物中硫代葡萄糖苷*
赵振东,李嘉诚,冯玉红,孟晓静,金彪
(海南大学材料与化工学院,海口 570228)
建立超高效液相色谱-串联质谱法鉴别十字花科植物中硫代葡萄糖苷的分析方法。采用70%甲醇水溶液提取白芥种子中的硫代葡萄糖苷,通过反相C18柱分离,电喷雾-离子阱-飞行时间质谱测定。利用硫代葡萄糖苷二级质谱裂解产生的m/z 195,241,259,275,291特征离子和伴随产生的80,162,163,196,242 Da中性分子丢失规律,共鉴别出5种硫代葡萄糖苷。
硫代葡萄糖苷;十字花科;液相色谱;质谱
硫代葡萄糖苷(简称硫苷)是广泛存在于十字花科植物中的含硫次级代谢产物,主要分布于植物的根、茎和叶中。当植物细胞受到破坏(如挤压、虫咬等)后,硫苷与植物内生的黑芥子酶接触,降解产生异硫氰酸酯、恶唑烷酮和硫氰酸酯等化合物[1],其中异硫氰酸酯具有良好的生物活性,而且对人畜无害。因此硫苷及其降解产物的研究引起了科学工作者的浓厚兴趣。根据侧链R基团的不同,目前已发现约120种硫苷,其中有多种具有抗癌、抗肿瘤、杀菌和杀虫活性的异硫氰酸酯,如吴华等[2]比较几种异硫氰酸酯的杀线虫活性,发现烯丙基和丙烯酰基异硫氰酸酯具有良好的杀线虫活性。大量研究表明甲硫基己基异硫氰酸酯等具有良好的抗肿瘤活性,是非常具有潜力的抗癌药物[3-6]。
硫苷的检测方法主要是传统的化学方法和现代的仪器分析手段。化学方法耗时、误差大、操作繁琐,只能测定硫苷总量。液相色谱法具有很高的分离效率,但对于硫苷单体鉴别需要对照品,无法满足快速鉴别硫苷的需要。笔者采用超高效液相色谱-离子阱-飞行时间质谱联用技术,既能高效分离硫苷,又能准确、快速鉴别硫苷。对于硫苷及降解产物的研究具有重要意义,同时又能够提高工作效率。
1 实验部分
1.1 主要仪器与试剂
超高效液相色谱-离子阱-飞行时间质谱仪:LCMS-IT-TOF型,日本岛津公司;
数显恒温水浴锅:HH-6型,常州澳华仪器有限公司;
真空干燥箱:VD23型,德国BINDER公司;电子天平:AUY220型,日本岛津公司;
超声波清洗器:KS-120EI型,宁波海曙科生超声设备有限公司;
旋转蒸发仪:R-216型,瑞士BUCHI公司;台式高速离心机:H-1650型,长沙湘仪离心机仪器有限公司;
研磨机:A11基本型,德国IKA公司;
白芥种子:产地为湖北武汉;
正己烷、氯仿、乙酸铵、甲酸:分析纯,广州化学试剂厂;
甲醇:色谱纯,美国Fisher公司;
实验用水为美国Pall公司Purelab Ultra超纯水系统制备的超纯水,电阻率为18.2 MΩ·cm。
1.2 硫代葡萄糖苷提取[7-8]
白芥种子在105℃干燥3 h,以灭活黑芥子酶保护硫苷。干燥种子经粉碎后,过420 μm筛。称取粗粉约50 g于锥形瓶中,依次用正己烷50 mL,氯仿50 mL 各3次除脂。残渣经真空干燥,用300 mL沸腾的70%甲醇水溶液浸泡,超声提取30 min,连续2次,合并提取液,静置至室温。提取液经离心分离,将清液真空下浓缩至原体积的20%。取1 mL浓缩液经石墨化碳脱色,滤液供超高效液相色谱-串联质谱分析。
1.3 流动相配制
用电子天平准确称量乙酸铵0.385 g,置于1 L量瓶中,加入1 mL甲酸,用水溶解定容后,经0.22 μm微膜过滤,超声波脱气后使用。
1.4 液质联用分析条件
(1)UPLC条件
ODS C18柱(100 mm×2.1 mm,3.5 μm,日本岛津公司);柱温:30℃;流动相A:5 mmol/L乙酸铵-1‰甲酸溶液;流动相B:甲醇;流动相流速:0.2 mL/min;进样体积:20 μL;梯度洗脱:0~3 min,98% A;3~25 min,98%~20% A;25~30 min,20%~20 % A;30~35 min,20%~98% A。
(2)MS条件
ESI负离子模式;电压:-3.5 kV;雾化气:N2,流量为1.5 L/min;干燥气压力:100 kPa;碰撞气:Ar;检测器电压:1.7 kV;Heat Block温度:200℃;CDL温度:200℃;一级质谱扫描范围:m/z 300~700;母离子扫描范围:m/z 315~650;二级质谱扫描范围:m/z 50~700;离子累积时间:10 ms;CID碰撞能量:100%;碰撞气能量:100%。
2 结果与讨论
2.1 分析条件选择
硫苷在水溶液中是亲水性阴离子化合物,在反相色谱柱中,保留时间短。优化实验发现,在ODS-C18柱上采用流动相A(5 mmol/L的乙酸铵+0.1%甲酸)和流动相B(甲醇)能够很好分离,并且有很好的质谱响应。质谱Heat Block和CDL温度采用200℃,温度过高会造成硫苷裂解,过低则影响离子化和脱溶剂化效果。为获得比较丰富的二级离子碎片信息,CID碰撞能量和碰撞气能量均采用100%。
2.2 分析结果
按照1.4分析条件检测白芥种子提取液,获取硫苷提取离子流色谱图及其一、二级质谱图(见图1~图11)。根据裂解机理,并参考文献[9-12],共鉴定出5种硫苷,结果见表1。
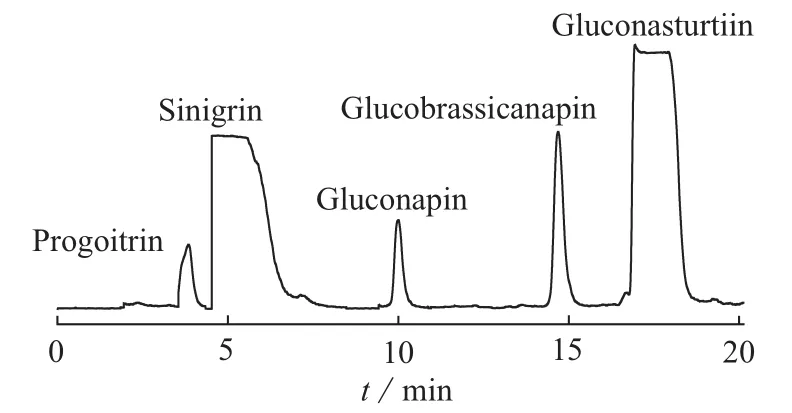
图1 白芥种子中硫代葡萄糖苷的提取离子流色谱图
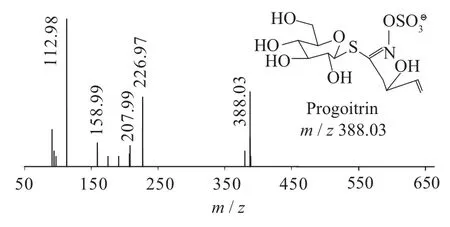
图2 progoitrin一级质谱图(MS1)
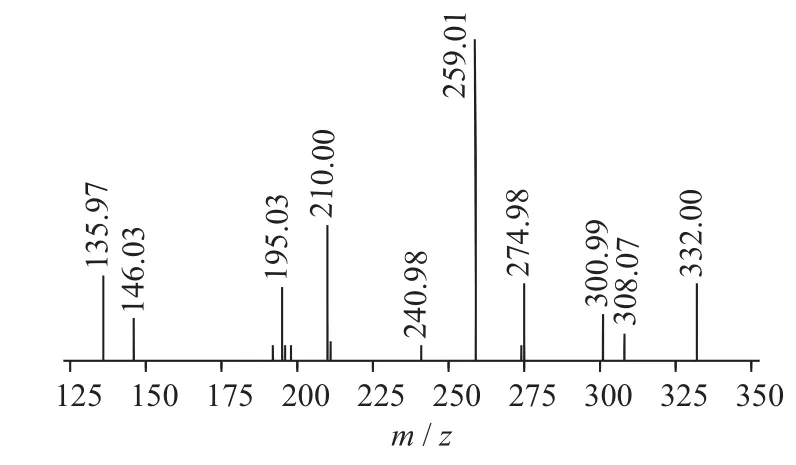
图3 progoitrin二级质谱图(MS2)
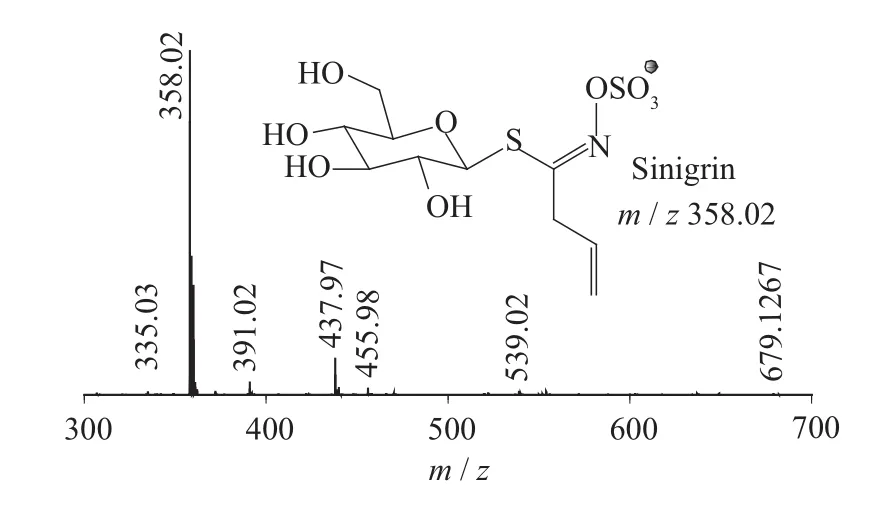
图4 Sinigrin一级质谱图(MS1)
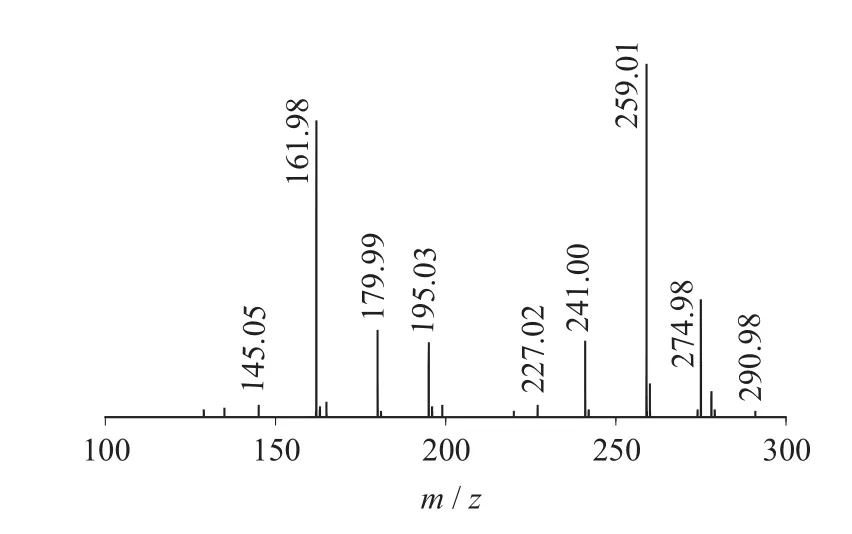
图5 Sinigrin二级质谱图(MS2)
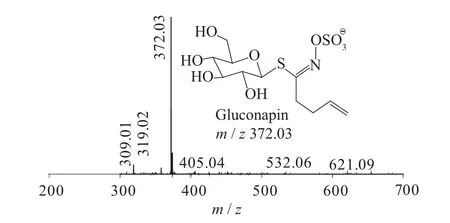
图6 Gluconapin一级质谱图(MS1)
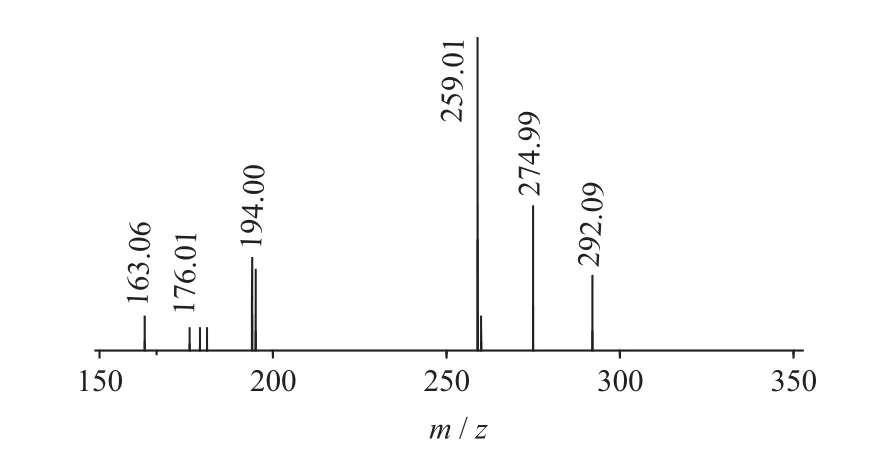
图7 Gluconapin二级质谱图(MS2)
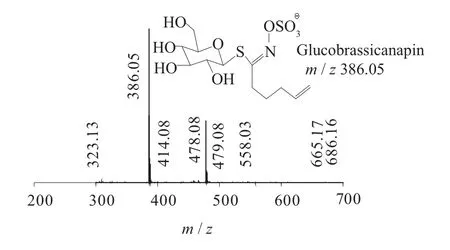
图8 Glucobrassicanapin一级质谱图(MS1)
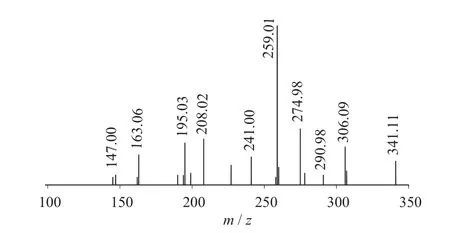
图9 Glucobrassicanapin二级质谱图(MS2)
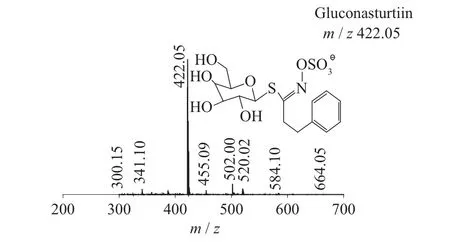
图10 Gluconasturtiin一级质谱图(MS1)
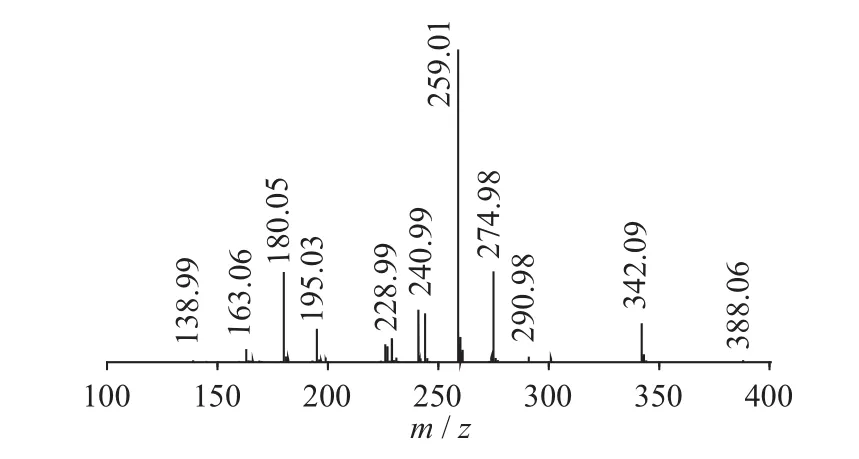
图11 Gluconasturtiin二级质谱图(MS2)
2.3 质谱碎片离子裂解机理
二级质谱特征离子,对于鉴别硫苷具有重要意义。在MS2中,母离子先后失去SO3(80 Da)和C6H10O5(162 Da)后产生242 Da中性分子丢失,氢重排后出现相对应的R—C(SH)=N—O—离子。另一裂解途径是硫苷上的氢发生重排后,失去C6H11O5(163 Da)和C6H12O5S(196 Da)中性碎片。与此同时,二级质谱中还能观察到m/z 195,241,259,275,291的特征离子,这些离子是由于硫与相邻碳原子发生断裂,并伴有氢重排形成的。
硫代葡萄糖苷负离子模式下主要特征二级碎片离子裂解机理见图12[13-14]。
3 结语
利用液相色谱-串联质谱技术快速、高效、准确的分离与鉴定十字花科植物中硫代葡萄糖苷,对硫代葡萄糖苷二级质谱80,162,163,196,242 Da中性分子丢失和m/z 195,241,259,275,291特征离子裂解机理进行了阐述和总结,能够准确推测硫代葡萄糖苷化学结构,对于十字花科植物的开发与利用具有重要意义。
[1]Luca Lazzeri,Giovanna Curto,Onofrio Leoni,et al. Effects of glucosinolates and their enzymatic hydrolysis products via myrosinase on the root-knot nematode meloidogyne incognita (kofoid et white)chitw[J]. J Agric Food Chem,2004,52: 6 703-6 707.

表1 白芥种子中硫苷主要二级质谱离子表
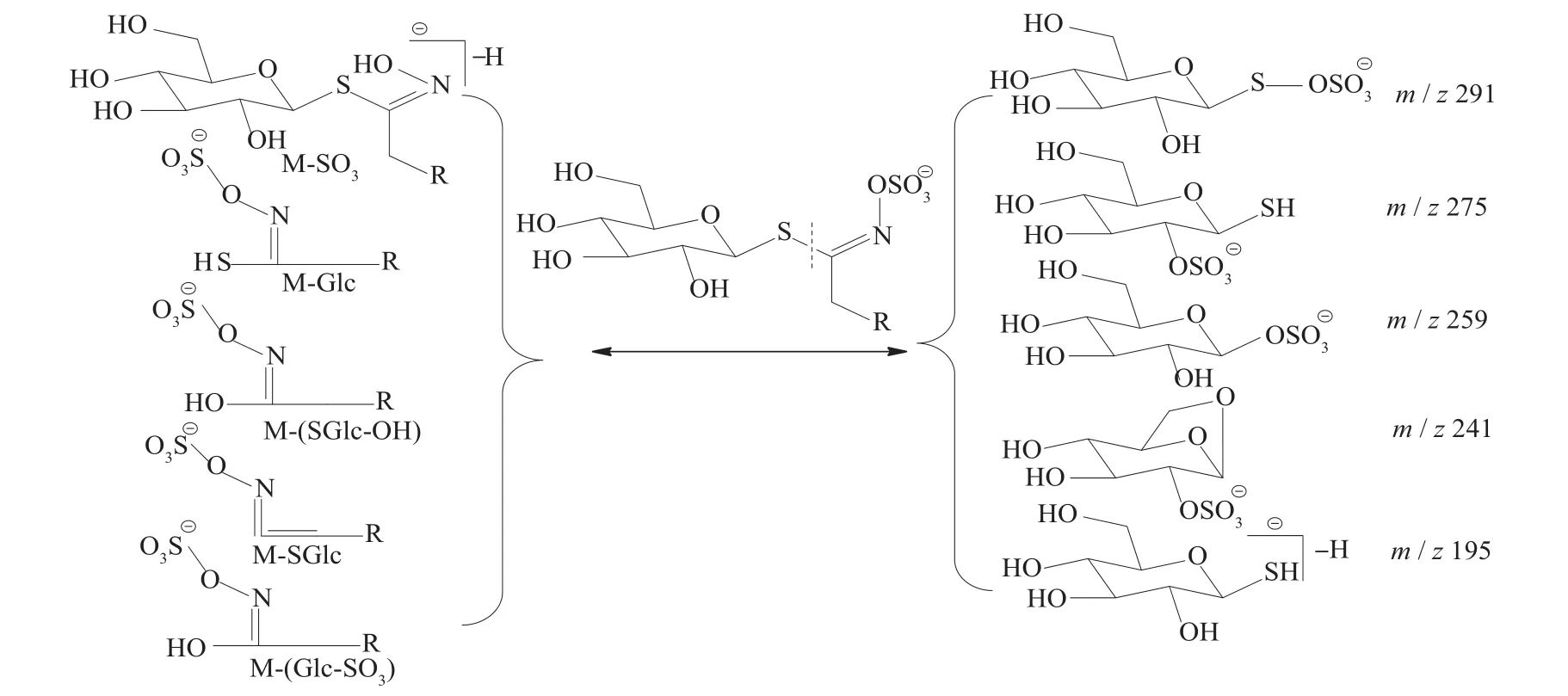
图12 硫代葡萄糖苷质谱裂解规律示意图
[2]Hua Wu,Chao-Jun Wang,Xiao-Wei Bian,et al. Nematicidal efficacy of isothiocyanates against root-knot nematode eloidogyne javanica in cucumber[J]. Crop Protection,2011,30: 33-37.
[3]Adarsh Pal Vig,Geetanjali Rampal,Tarunpreet Singh Thind,et al. Bio-protective effects of glucosinolates-a review[J]. Food Science and Technology,2009,42: 1 561-1 572.
[4]Al-Gendy A A,El-gindi O D,Hafez Al S,et al. Glucosinolates,volatile constituents and biological activities of Erysimum corinthium boiss.(brassicaceae)[J]. Food Chemistry,2010,118: 519-524.
[5]Steven F Vaughn,Debra E Palmquist,Sandra M Duval,et al. Herbicidal activity of glucosinolate-containing seedmeals[J]. Weed Science,2006,54: 743-748.
[6]Luisa M Manici,Luca Lazzeri,Sandro Palmieri. In vitro fungitoxic activity of some glucosinolates and their enzyme-derived products toward plant pathogenic fungi[J]. J Agric Food Chem,1997,45: 2 768-2 773.
[7]Steven F Vaughn,Mark A Berhow. Glucosinolate hydrolysis products from various plant sources pH effects,isolation,and purification[J]. Industrial Crops and Products,2005,21: 193-202.
[8]Lijiang Song,Renato Iori,Paul J Thornalley. Purification of major glucosinolates from Brassicaceae seeds and preparation of isothiocyanate and amine metabolites[J]. J Sci Food Agric,2006,86: 1 271-1 280.
[9]Kim-Chung Lee,Wan Chan,Zhitao Liang,et al. Rapid screening method for intact glucosinolates in Chinese medicinal herbs by using liquid chromatography coupled with electrospray ionization ion trap mass spectrometry in negative ion mode[J]. Rapid Commun Mass Spectrom,2008,22: 2 825-2 834.
[10]Nicolas Fabre,Véréna Poinsot,Laurent Debrauwer,et al. Characterisation of glucosinolates using electrospray ion trap and electrospray quadrupole time-of-flight mass spectrometry[J]. Phytochem Anal,2007,18: 306-319.
[11]Simone J Rochfort,V Craige Trenerry,Michael Imsic,et al. Class targeted metabolomics: ESI ion trap screening methods for glucosinolates based on MSnfragmentation[J]. Phytochemistry,2008,69: 1 671-1 679.
[12]Jason B Bialecki,Josef Ruzicka,Carl S Weisbecker,et al. Collision-induced dissociation mass spectra of glucosinolate anions[J]. J Mass Spectrom,2010,45: 272-283.
[13]Filomena Lelario,Giuliana Bianco,Sabino A Bufo,et al. Establishing the occurrence of major and minor glucosinolates in Brassicaceae by LC-ESI-hybrid linear ion-trap and Fouriertransform ion cyclotron resonance mass[J]. Phytochemistry,2012,73(1): 74-83.
[14]Tommaso R I Cataldi,Alessandra Rubino,Filomena Lelario,et al. Naturally occurring glucosinolates in plant extracts of rocket salad (Eruca sativa L.) identified by liquid chromatography coupled with negative ion electrospray ionization and quadrupole ion-trap mass spectrometry[J]. Rapid Commun Mass Spectrom,2007,21: 2 374-2 388.
Separation and Identification of Glucosinolates in the Cruciferae Crops by UPLC-MS/MS
Zhao Zhendong,Li Jiacheng,Feng Yuhong,Meng Xiaojing,Jin Biao
(Materials and Chemical Engineering of Hainan University,Haikou 570228, China)
A method for precise identification of glucosinolates in the Cruciferae Crops by UPLC-MS/MS was established. The glucosinolates were extracted with methanol-water (volume ratio 70∶30),while the separation and qualitative determination of the individual glucosinolates was achieved using RP-UPLC-ESI-IT-TOF. The glucosinolates was confirmed with the use of product ions at m/z 195,241,259,275,291 in MS2. Further identification of the five glucosinolates was based on the detection of compounds with a constant neutral loss of 80, 162, 163, 196, 242 Da in collision-induced dissociation.
glucosinolate; cruciferae; liquid chromatography; mass spectrometry
O657.63
A
1008-6145(2013)02-0012-04
10.3969/j.issn.1008-6145.2013.02.003
*“十二五”科技支撑计划(2011BAE06B06-7,2011BAE06B04-7);海南大学青年基金项目(qnjj1220)
联系人:冯玉红;E-mail: ljcfyh@263.net
2012-12-12
