大鼠背根神经节ERK5/CREB信号通路在神经病理性疼痛中的作用
2013-06-05孙建良浙江省嘉兴市第一医院麻醉科嘉兴314000
肖 纯 孙建良 浙江省嘉兴市第一医院麻醉科 嘉兴 314000
卢 波 姚 娟 温州医学院附属第二医院(育英儿童医院)麻醉科
·实验研究·
大鼠背根神经节ERK5/CREB信号通路在神经病理性疼痛中的作用
肖 纯 孙建良 浙江省嘉兴市第一医院麻醉科 嘉兴 314000
卢 波 姚 娟 温州医学院附属第二医院(育英儿童医院)麻醉科
目的:探讨脊髓与背根神经节(DRG)细胞外信号调节蛋白激酶5(ERK5)信号通路在神经病理性疼痛中的作用。方法:SD大鼠坐骨神经结扎(CCI)建立神经病理性模型。应用免疫组化方法检测CCI大鼠DRG磷酸化ERK5(p-ERK5)表达的变化;鞘内注射ERK5反义寡核苷酸对CCI大鼠DRG p-CREB表达以及机械缩足反射阈值(MWT)和热缩足反射潜伏期(TWL)的影响。结果:CCI大鼠同侧DRG p-ERK5标记的神经元数量明显增加;鞘内注ERK5反义寡核苷酸有效抑制DRG ERK5表达的同时,CCI所致的p-CREB表达上调(P<0.05)、机械与热痛觉过敏也明显减轻(P<0.05)。结论:DRG ERK5参与了神经病理性疼痛的信号转导过程,其部分作用是通过激活转录因子CREB实现的。
大鼠 坐骨神经结扎 神经病理性疼痛 背根神经节 细胞外信号调节蛋白激酶5 cAMP反应原件结合蛋白
神经病理性疼痛是困扰人类健康的严重问题,目前其发生机制尚未完全阐明,临床治疗效果亦不理想。背根神经节(dorsal rootganglion,DRG)细胞是初级感觉传入神经元,在神经病理性疼痛的发生发展过程中起重要作用[1]。细胞外信号调节蛋白激酶5(extracellular-signal regulated protein kinase 5,ERK5)是丝裂原活化蛋白激酶(mitogen-activatedprotein ki⁃nases,MAPKs)家族的新成员,研究发现ERK5在DRG的活化参与了炎症性疼痛与神经病理性疼痛的信号转导,但其机制尚不清楚[2-3]。本研究拟通过观察坐骨神经结扎(CCI)大鼠DRG磷酸化ERK5(p-ERK5)的表达变化,及其对转录因子CREB(cAMP response elementbinding protein)活性的调节作用,探讨其在神经病理性疼痛中的作用及其机制。
1 材料与方法
1.1 实验动物 健康成年雄性SD大鼠,体质量220~250g,由浙江省实验动物中心提供。
1.2 动物分组 实验分三部分进行。第一部分,32只大鼠随机分为坐骨神经结扎组(CCI组)与假手术组(Sham组),每组16只。坐骨神经结扎组大鼠参照Xie[4]的方法行坐骨神经结扎建立神经病理性疼痛模型;假手术组仅暴露坐骨神经但不结扎。于术前1天,术后1、4、7天各处死4只大鼠取材行免疫组化试验,观察大鼠背根神经节p-ERK5的表达变化。
第二部分,共60只大鼠,参照Yaksh等[5]描述的方法行鞘内置管。于坐骨神经结扎前36、24、12h,通过导管行鞘内给药,按鞘内所给药物不同随机分为ERK5反义寡核苷酸组(AS组)、ERK5错义寡核苷酸组(MM组)与生理盐水组(NS组),每组20只。其中48只大鼠于术前1天,术后1、4、7天各处死4只取材行免疫组化试验,观察大鼠背根神经节p-CREB的表达变化;其余12只大鼠,鞘内给药后不行坐骨神经结扎,于鞘内给药后12h处死取材行免疫印迹实验,测定背根神经节ERK5含量,评估反义寡核苷酸对ERK5表达的抑制效果。
第三部分,24只大鼠随机分为三组,每组8只,分组与处理同第二部分。于坐骨神经结扎前1天,术后1、4、7天进行行为学实验。
1.3 免疫组织化学 动物戊巴比妥钠(60mg/kg,腹腔注射)深麻醉下,经升主动脉依次灌注4℃生理盐水 100mL、4%多聚甲醛 400mL(0.1mol/L PB,pH7.4)。取同侧L4、L5DRG置于多聚甲醛后固定3h后,移至30%蔗糖脱水至组织沉底。冰冻冠状切片,片厚25μm。切片经0.01M的PBS冲洗3次,与0.3% H2O2、10%山羊血清孵育后,加入山羊抗p-ERK5抗体(1:200,Santa Cruz公司美国)孵育,4℃过夜。按SP法进行免疫组织化学染色,DAB显色。
1.4 免疫印迹 动物在戊巴比妥钠(60mg/kg,腹腔注射)麻醉下处死,迅速取同侧L4、L5DRG移至液氮保存。将组织在预冷的蛋白质抽提缓冲液(10mM HEPES,1mM Na3VO4,1.5mM MgCl2,10mM KCl,50mM NaF,0.1mM EDTA,0.1mM EGTA,0.5mM Phenylmethylsulfonyl fluoride,1mM Dithiothreitol, 0.02%cocktail,pH 7.9)中匀浆,加入90μL10%NP-40剧烈震荡30s,4℃14000g离心15min,吸取上清液。Bradford法测定样本蛋白浓度,加入4倍样本缓冲液(mM:Tris-HCl 250,蔗糖 200,Dithiothreitol 300,0.01%考马斯亮兰-G和8%SDS,pH 6.8),95℃水浴5min。取等量30μg样本加至10%SDS-聚丙烯酰胺凝胶恒压电泳,压缩胶80V,分离胶150V。半干法转移至硝酸纤维素膜。3%牛血清封闭3h。加兔抗ERK5抗体(1:500,Cell Signaling Technology公司,美国),4℃孵育过夜。TBST冲洗,加入碱性磷酸酶标记的山羊抗兔二抗(1:10000),室温摇床孵育1.5h,TBST冲洗,NBT/BCIP检测反应条带。
1.5 鞘内给药 在异氟醚吸入麻醉下使用微量注射器行鞘内给药。根据分组不同,分别在坐骨神经结扎前36、24、12h鞘内注射10nmol/10μLERK5反义寡核苷酸(溶于生理盐水),或相同剂量的错义寡核苷酸或生理盐水。ERK5反义及错义寡核苷酸采用Nadruz[6]设计的序列,由上海生工生物技术有限公司合成并进行硫代磷酸化修饰,反义序列:5'-GCC⁃GCCGCCGCCGCCAT-3',错义序列:5'-CGCGC⁃GCTCGCGCACCC-3'。鞘内给药时间大于30s,随后用10μl生理盐水冲洗导管。
1.6 行为学实验 采用von Frey纤维按Chaplan[7]报道的方法测定大鼠左后足机械缩足反射阈值(MWT)。将大鼠于置透明的有机玻璃箱中,底为1cm×1cm的铁丝网,测定前使之适应15min,以不同折力的Von Frey纤维(Stoehing公司,美国)刺激大鼠足底,从2g开始,以up-down法并在阈值上下刺激5次,计算50%缩足反应阈值,最大折力为15g,大于此值时记为15g。按Hargreaves[8]报道的方法测定热缩足反射潜伏期(TWL)。用热辐射刺激仪(10V,50W;光斑直径为0.8cm,浙江大学国家光学仪器技术研究中心)照射大鼠足底,记录照射开始至大鼠出现抬腿回避时间,每只动物测定3次,间隔3min,取平均值为TWL。
1.7 细胞计数与半定量分析 随机选取各实验动物L4~5DRG,高倍镜下计算DRG阳性细胞数目;West⁃ern blot条带用Adobe Photoshop软件进行半定量分析。
1.8 统计学方法 应用SPSS13.0统计软件,采用单因素方差分析。
2 结 果
2.1 坐骨神经结扎大鼠p-ERK5阳性的背根神经节神经元表达 术前坐骨神经结扎组与假手术组大鼠仅有少量背根神经节神经元表达p-ERK5;假手术组大鼠术后p-ERK5阳性背根神经节神经元数量无明显改变(图1-A);与假手术组比较坐骨神经结扎大鼠p-ERK5阳性背根神经节神经元数量明显增加(P<0.05)(图1-B、C)。坐骨神经结扎模型建立1天后p-ERK5阳性背根神经节神经元数量达峰值,p-ERK5阳性背根神经节神经元数量增加一直持续到实验结束(7天)(图1-C)。

图1 CCI对DRG p-ERK5表达的影响
2.2 鞘内注射ERK5反义寡核苷酸对坐骨神经结扎术后DRG p-CREB表达的影响 各组基础p-CREB阳性背根神经节神经元数量之间差异无统计学意义(P>0.05);坐骨神经结扎后各组大鼠p-CREB阳性背根神经节神经元数量均明显增加,与MM组比较,AS组背根神经节p-CREB阳性背根神经节神经元数量明显降低(P<0.05);生理盐水组与MM组之间p-CREB阳性背根神经节神经元数量差异无统计学意义(P>0.05)(图2-A、B、C、E)。
Western blot结果显示,与MM组比较AS组DRG与脊髓ERK5的含量明显降低(>70%)(P<0.05);生理盐水组与MM组之间背根神经节与脊髓ERK5含量差异无统计学意义(P>0.05)(图2-D、F)。
2.3 鞘内注射ERK5反义寡核苷酸对坐骨神经结扎术后热与机械痛敏的影响 各组基础TWL和MWT之间差异无统计学意义(P>0.05)。坐骨神经结扎术后各组TWL与MWT均低于基础值,与MM组比较,AS组TWL与MWT升高(P<0.05);生理盐水组与MM组TWL与MWT差异无统计学意义(P>0.05)(图3-A、B)。

图2 鞘内注射反义寡核苷酸抑制ERK5表达对CCI大鼠DRG p-CREB表达的影响
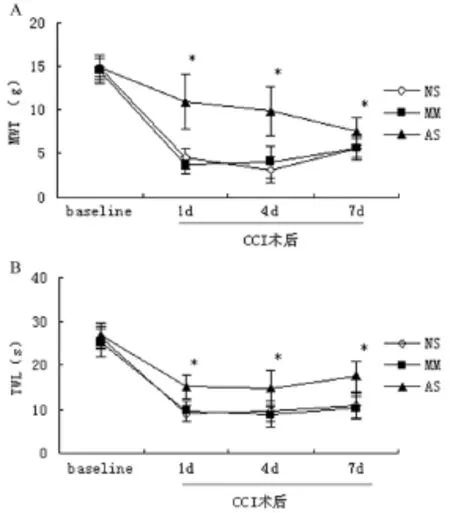
图3 鞘内注射反义寡核苷酸抑制DRG ERK5缓解CCI所致的热与机械痛觉过敏
3 讨论
神经系统的可塑性是神经病理性疼痛发生发展的关键机制,导致神经系统持久可塑性改变必需有基因表达水平的改变。伤害性传入信号通过细胞信号转导体系传递后,可激活多种转录因子,调节初级感觉和脊髓背角神经元基因的表达,从而产生病理性疼痛状态下神经系统长时间的功能和结构变化[9]。
与其它MAPKs一样ERK5信号通路采用高度保守的三级激酶级联体系进行信号传递。被上游激酶磷酸化激活后,p-ERK5—ERK5的活化形式不仅催化多种胞浆蛋白磷酸化,而且迅速转位进入核内直接或间接调节转录因子的活性,通过调节转录及转录后修饰发挥其生物学作用[10]。本研究中,外周神经损伤后DRG p-ERK5表达明显增加,鞘内注射ERK5反义寡核苷酸抑制ERK5表达的同时,明显减轻了CCI所致的机械和热痛觉过敏反应,说明DRG ERK5的激活参与神经病理性疼痛的发展过程。
对ERK5信号通路的研究发现,p-ERK5核转位后可调节多种转录因子的活性,包括MEF2C、CREB、NF-B、Fos、Zif268、Sap1等[10]。转录因子CREB由341个氨基酸残基组成,CREB存在多个磷酸化位点,其中serine133的磷酸化是其发挥调节转录功能的基础,p-CREB先与CREB结合蛋白(CBP)结合,再共同结合到靶基因上的特定序列CRE,即可募集RNA聚合酶Ⅱ组成转录复合体,调节靶基因的转录[11]。CREB结合位点CRE存在于许多疼痛相关基因的启动子区域,包括c-fos、zif268、cox-2、NK-1、强啡肽、降钙素基因相关肽、脑源性神经营养因子(brain-de⁃rived neurotrophic factor BDNF)等[12~14]。研究表明,CREB依赖的基因表达是伤害性刺激诱发的神经系统重塑所必须的,如突触的长时程增强、交感神经芽生等。在本研究中鞘内注射ERK5反义寡核苷酸在减轻炎性痛的同时有效地抑制了CCI所致的DRG神经元CREB的磷酸化。因此,p-ERK5参与了神经损伤诱导所致的CREB活化过程,而ERK5的部分功能可能是通过调节CREB依赖的基因表达实现的。
伤害性刺激不仅能增强初级感觉神经元的兴奋性,而且可增强中枢神经系统的兴奋性,外周和中枢神经系统的敏感化都参与了痛觉过敏的产生和维持过程。Mizushima等[15]证实,ERK5在DRG的短暂(60min)活化仅参与了热痛敏和外周敏感化产生,而与机械痛敏无关。本研究中,鞘内注射ERK5反义寡核苷酸大鼠CCI后热和机械痛觉过敏均明显减轻。导致机械痛敏的主要原因是中枢敏化。初级感觉神经元的传入信号在中枢敏感化过程中同样起重要的作用。许多神经递质的编码基因包含CRE,例如BDNF[12]。在神经病理性疼痛状态下初级感觉神经元BDNF表达增加,并通过轴浆运输转运脊髓背角,进而调节脊髓神经元的兴奋性。Obata等[3]证实背根神经节ERK5参与了BDNF表达的调节。因此,DRG中ERK5-CREB信号通路的活化可能通过突触传递间接地参与中枢神经系统的敏感化过程。
综上所述,DRG ERK5参与了神经病理性疼痛的信号转导过程,其部分作用是通过激活转录因子CREB实现的。
[1]LaMotte RH,Shain CN,Simone DA,etal.Neurogenic hyper⁃algesia:Psychophysical studies of underlying mechanisms[J].JNeurophysiol,1991,66(1):190-211.
[2]Katsura H,Obata K,Mizushima T,etal.Activation of extra⁃cellular signal-regulated protein kinases 5 in primary affer⁃ent neurons contributes to heat and cold hyperalgesia after inflammation[J].JNeurochem,2007,102(5):1614-1624.
[3]Obata K,Katsura H,Mizushima T,etal.Roles of extracellu⁃lar signal-regulated protein kinases 5 in spinal microglia and primary sensory neurons for neuropathic pain[J].JNeu⁃rochem,2007,102(5):1569-1584.
[4]Xie Y,Zhang J,Petersen M,etal.Functional changes in dor⁃sal root ganglion cells after chronic nerve constriction in the rat[J].JNeurophysiol,1995,73(5):1811-1820.
[5]Yaksh TL,Rudy TA.Chronic catheterization of the subarach⁃noid space[J].Physiol Behav,1976,7(6):1032-1036.
[6]NadruzWJ,Kobarg CB,Constancio SS,etal.Load-induced transcriptionalactivation of c-jun in ratmyocardium:regula⁃tion by myocyte enhancer factor 2[J].Circ Res,2003,92(2):243-251.
[7]Chaplan SR,Bach FW,Pogrel JW,etal.Quantitative assess⁃mentof tactile allodynia in the ratpaw[J].JNeurosciMeth⁃ods,1994,53(1):55-63.
[8]Hargreaves K,Dubner R,Brown F,et al.A new and sensi⁃tivemethod formeasuring thermal nociception in cutaneous hyperalgesia[J].Pain,1998,32(1):77-88.
[9]JiRR,Strichartz G.Cell signaling and the genesis of neuro⁃pathic pain[J].SciSTKE,2004,(252):reE14.
[10]Wang X,Tournier C.Regulation of cellular functionsby the ERK5 signaling pathway[J].Cell Signal,2006,18(6):753-760.
[11]BonniA,Ginty DD,Dudek H,etal.Serine133-phosphory⁃lated CREB induces transcription via a cooperativemecha⁃nism that may confer specificity to neurotrophin signals[J].MolCellNeurosci,1995,6(2):168-183.
[12]Lonze BE,Ginty DD.Function and regulation ofCREB fam⁃ily transcription factors in the nervous system[J].Neuron,2002,35(4):605-623.
[13]Ji RR,Rupp F.Phosphorylation of transcription factor CREB in rat spinal cord after formalin-induced hyperalge⁃sia:relationship to c-fos induction[J].JNeurosci,1997,17(5):1776-1785.
[14]Tamura S,Morikawa Y,Senba E.Up-regulated phosphory⁃lation of signal transducer and activator of transcription 3 and cyclic AMP-responsive elementbinding protein by pe⁃ripheral inflammation in primary afferent neurons possibly through oncostatin M receptor[J].Neuroscience,2005,133(3):797-806.
[15]Mizushima T,Obata K,Katsura H,et al.Intensity-depen⁃dent activation of extracellular signal-regulated protein ki⁃nase 5 in sensory neurons contributes to pain hypersensitiv⁃ity[J].JPharmacolExp Ther,2007,321(1):28-34.
Activation of ERK 5/CREB Signaling Pathway in Dorsal Root Ganglia Contributes to Neuropathic Pain
XIAO Chun,LU Bo,YAO Juan,et al.Department of Anesthesiology,the First Hospital of Jiaxing,Jiaxing (314000),China
Objective:To explore the role of dorsal root ganglia(DRG)extracellular signal-regulated protein ki⁃nase 5(ERK5)signaling pathway in neuropathic pain.M ethods:Chronic constructive injury(CCI)model was made by loose ligation of sciatic nerve by chromic gut in male SD rat.The expression of p-ERK5 was investigat⁃ed in the DRG following ligation of sciatic nerve by using immunohistochemistry.To examine the functional con⁃sequences of ERK5 activation,the expression of p-CREB(cAMP response element binding protein)and hyperalge⁃sia response to nerve injury was test after intrathecal administrating ERK5 antisense oligonucleotides.Results:Li⁃gation of sciatic nerve produced sustained ERK5 activation in DRG.Knockdown of the ERK5 by antisense oligo⁃nucleotides suppressed the heat and mechanical hyperalgesia,and phosphorylation of CREB induced by peripher⁃al inflammation(P<0.05).Conclusion:Activation of ERK5 DRG contributes to neuropathic pain by activating the transcription factor CREB.
extracellular signal-regulated protein kinase 5 neuropathic pain dorsal root ganglion cAMP re⁃sponse element binding protein
2012-07-30
