急性冠脉综合征患者应用负荷剂量的瑞舒伐他汀与阿托伐汀的效果对比
2013-05-25高远关启刚孙宇姣李玉泽张海山田文郭亮贾大林张月兰孙英贤齐国先
高远,关启刚,孙宇姣,李玉泽,张海山,田文,郭亮,贾大林,张月兰,孙英贤,齐国先
(中国医科大学附属第一医院心血管内科,沈阳 110001)
他汀类药物在临床应用日益广泛,在非ST段抬高急性冠脉综合征(non-STsegment elevation acute coronary syndrome,NSTEACS)患者早期、积极的应用他汀类药物可减少经皮冠脉介入治疗(percutaneous coronary intervention,PCI)围术期的心肌损伤,减少术后不良心脏事件的发生率,改善预后。Armyda-acs研究[1]证实PCI术前12 h给予80 mg阿托伐他汀,继而给予40 mg的负荷治疗可使NSTEACS患者围术期心肌梗死发生率下降70%,同时使术后30d不良心脏事件的发生率下降88%。Armyda[2]及其他的研究[3~6]同样证实PCI术前应用负荷量的阿托伐他汀可明显减少围术期心肌损伤。近来Yun等[7]也报道给予NSTEACS患者PCI术前40 mg的瑞舒伐他汀负荷治疗可减少围术期心肌损伤和术后1个月和1年的心脏不良事件(major adverse cardiovascular events,MACE)发生率。体内、体外实验已证实他汀类药物具有独立于降脂作用之外对于冠脉粥样硬化的抗炎、改善血管内皮功能、稳定斑块等作用。然而针对NSTEACS中国患者PCI术前应用不同负荷剂量的瑞舒伐他汀及阿托伐他汀治疗对PCI围术期炎症因子的影响及疗效,以及其对预后的影响还不甚清楚,二者之间的对比研究还未见报道,因此我们设计了这个随机对照研究。
1 材料与方法
1.1 研究对象
我们于2009年1月至2010年6月在中国医科大学附属第一医院连续、随机入选了242位NSTEACS(不稳定心绞痛和急性非ST段抬高性心肌梗死)患者,这些患者在入院48 h后都进行了冠脉造影检查,研究得到中国医科大学附属第一医院伦理委员会的批准。
排除标准:(1)急性ST段抬高性心肌梗死;(2)高危急性非ST段抬高性心肌梗死需急诊PCI治疗的;(3)EF%<30%;(4)肾功能不全,血 Cr>220mmol/L;(4)既往应用过他汀类药物治疗的;(5)既往有肝脏疾病或肌病病史;(6)任何原因导致的肝酶:丙氨酸氨基转移酶(ALT)升高;(7)其他严重的疾病预期生存期不确定的。39位患者被排除,其中包括:8位曾经应用过他汀类药物治疗的(3位普伐他汀,3位瑞舒伐他汀,2位阿托伐他汀);3位肝病患者;5位肝酶升高;9位高危患者行急诊PCI治疗;6位患者EF%<30%;5位肾功能不全,血 Cr>220 mmol/L;2位冠脉造影显示严重三支病变转入外科CABG治疗;1位肺癌患者。203名患者入选,其中102名患者被随机分配到瑞舒伐他汀组[冠脉造影前12 h给予20 mg瑞舒伐他汀(可定,阿斯利康公司),冠脉造影前2 h给予10 mg瑞舒伐他汀],101名患者被随机分配到阿托伐他汀组[冠脉造影前12 h给予80 mg阿托伐他汀(立普妥,辉瑞公司),冠脉造影前2 h给予40 mg阿托伐他汀]。
1.2 方法
1.2.1 冠脉造影检查:所有患者经桡动脉行冠脉造影检查,术前至少4 h均给予阿司匹林300 mg、氯吡格雷300 mg嚼服,其后阿司匹林100 mg日1次、氯吡格雷75 mg1次口服;术后24 h以后瑞舒伐他汀组一直给予瑞舒伐他汀10 mg日1次口服,直至术后6个月;阿托伐他汀组继续给予阿托伐他汀40 mg日1次口服至术后6个月;术后低分子肝素常规应用3~5 d。PCI成功的定义是造影显示残余狭窄<20%。
1.2.2 PCI术前及术后24 h抽血化验:CKMB,cTNI,hs-CRP,IL-1,IL-6 和 TNF-α。 血 IL-1,IL-6 和TNF-α检测要求病人空腹,在早晨8:00抽血,血样在4℃,1 000 r/min离心20 min后取血清于-80℃冻存,应用ELISA试剂盒(Wuhan EIAab Science)检测。
1.2.3 终点:
1.2.3.1 一级终点 我们随访病人3个月及6个月的心脏不良事件发生率,包括:心脏性死亡,再发心肌梗死,靶血管血运重建(PCI或外科CABG治疗)。心肌梗死定义为:心肌坏死标志物(CKMB,cTNI)升高大于正常上限3倍或PCI术后升高大于原有升高值的 2 倍[7]。
1.2.3.2 二级终点 定义PCI术后心肌损伤,既术后心肌坏死标志物升高但小于正常上限的3倍或在原有升高的基础上小于原有升高值的2倍。
1.3 统计方法
连续资料应用x±s表示,计数资料应用数量(n)和百分比表示。两组计量资料应用t检验,计数资料应用χ2检验比较,P<0.05定为有统计学差异,应用SPSS14.0软件进行统计分析。
2 结果
2.1 患者临床特点
有12位患者应用他汀后住院期间出现ALT升高>2倍(瑞舒伐他汀组6位,阿托伐他汀组6位),其后停用他汀,退出研究。有3位患者失访(瑞舒伐他汀组2位,阿托伐他汀组1位)。两组患者基本临床资料未有统计学差异,详细资料见表1。入选患者PCI术后未见明显边支闭塞发生。两组患者PCI术中临床特点没有明显差异,包括冠脉靶血管病变分布、特点及置入支架数量等方面数据详见表2。
2.2 一级终点
瑞舒伐他汀组随访3月时,心肌梗死发生1例(1.06%),靶血管血运重建发生1例(1.06%);阿托伐他汀组随访3月心肌梗死发生7例(7.45%),靶血管血运重建发生3例(3.19%)。瑞舒伐他汀组和阿托伐他汀组相比MACE事件2.13%比10.64%(P=0.017),差异有统计学意义。随访6月,瑞舒伐他汀组心肌梗死发生2例(2.13%),靶血管血运重建发生3例(3.19%);阿托伐他汀组随访6月心肌梗死发生10例(10.64%),靶血管血运重建发生5例(5.32%)。瑞舒伐他汀组和阿托伐他汀组相比MACE事件率为5.32%比15.96%(P=0.018),差异有统计学意义。瑞舒伐他汀组和阿托伐他汀组相比3月及6月MACE事件发生率明显低。随访期间两组无死亡患者。详见表3。
2.3 二级终点
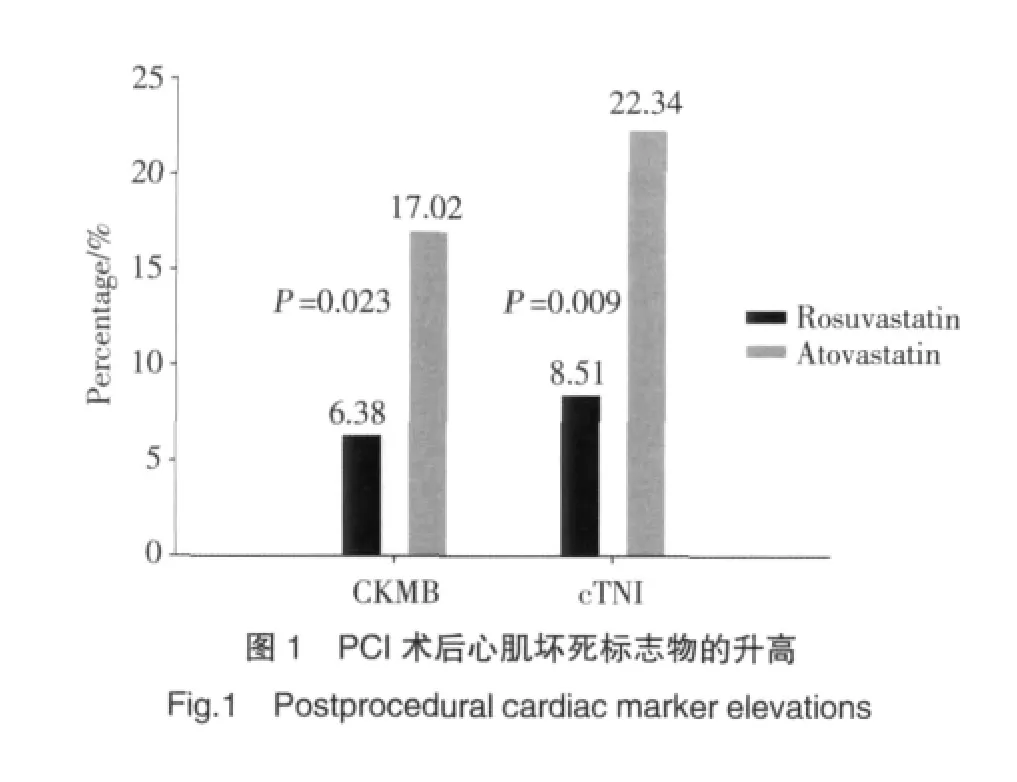
围PCI术期瑞舒伐他汀组和阿托伐他汀组相比较:CKMB升高为6.38%比 17.02%(P=0.023),cTNI为8.51%比22.34%(P=0.009)。瑞舒伐他汀组围PCI术期心肌损伤发生率低,差异有统计学意义。见图1。

表1 临床特点Tab.1 Baseline clinical characteristics
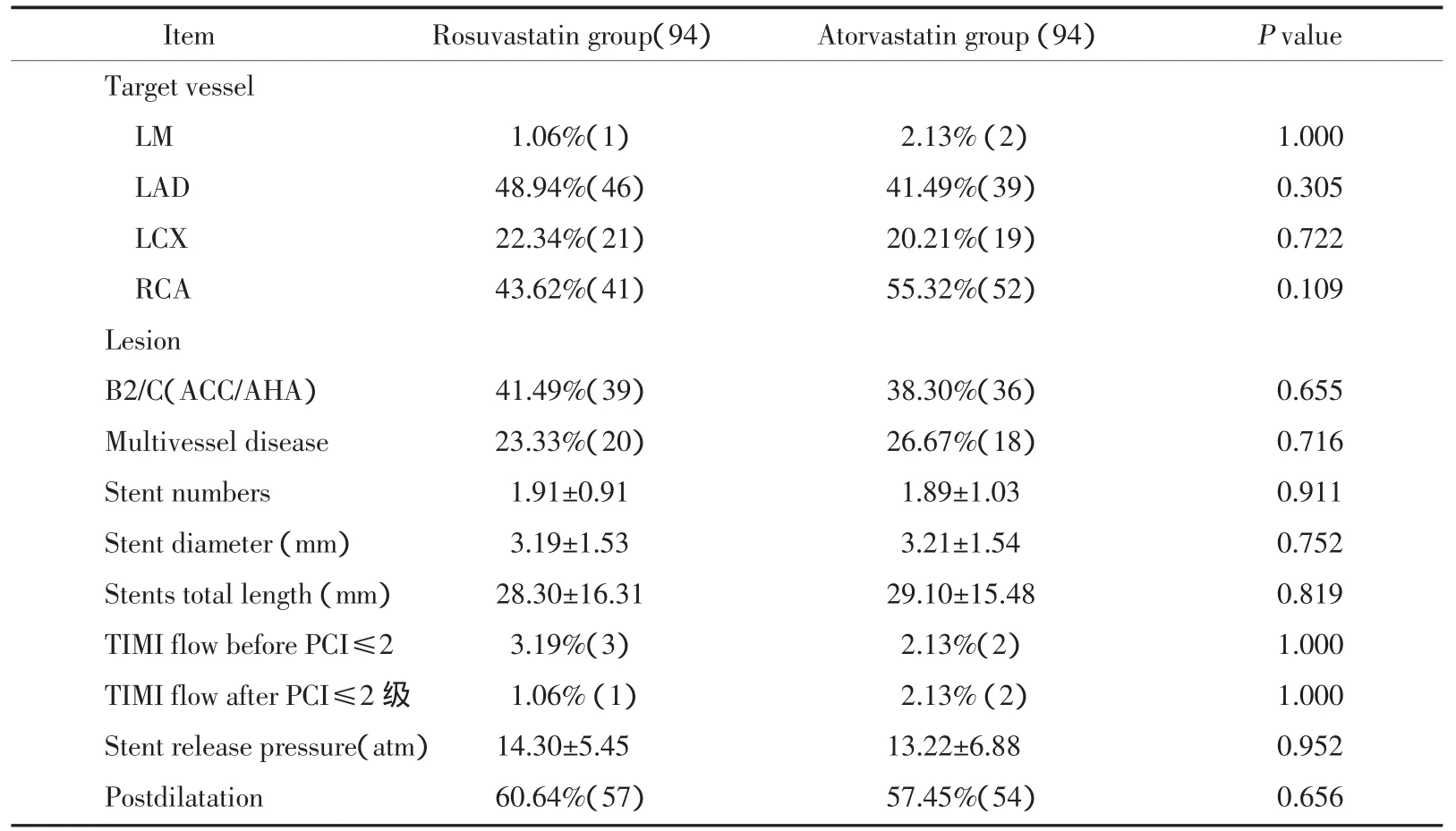
表2 PCI手术术中资料Tab.2 Coronary angiographic and procedural characteristics
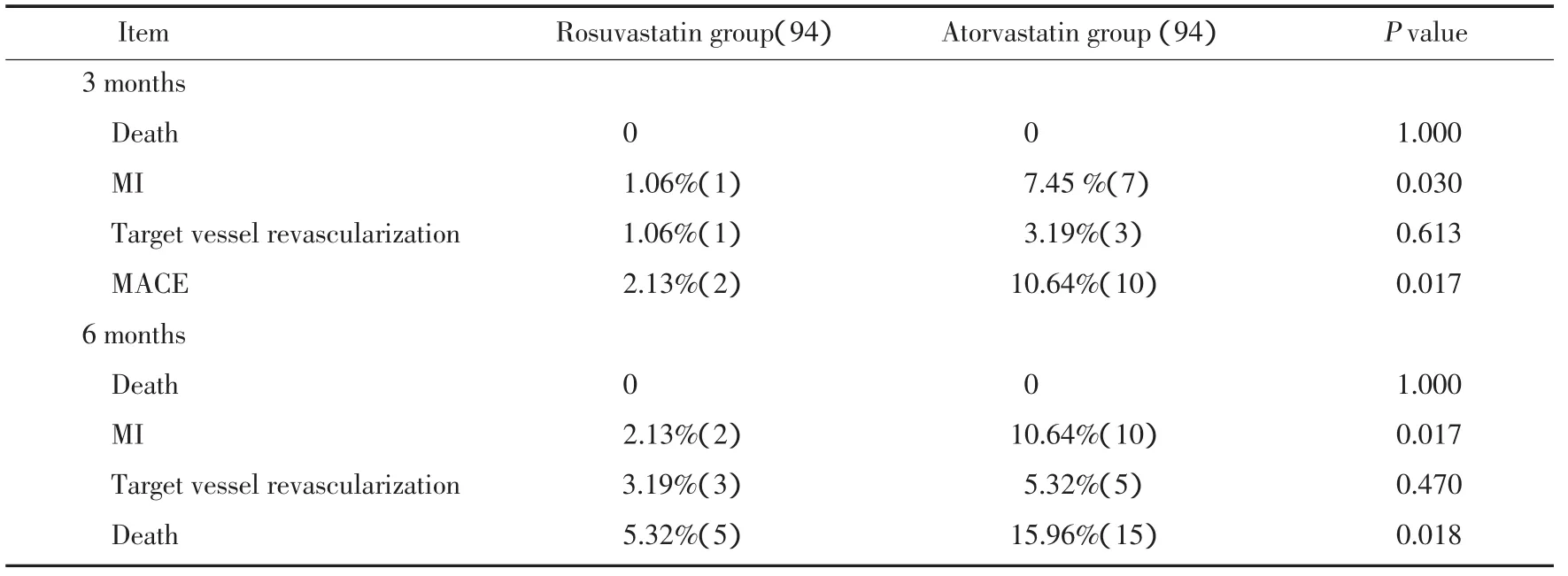
表3 术后瑞舒伐他汀与阿托伐他汀组MACE比较Tab.3 Major adverse cardiac events in Rosuvastatin versus Atorvastatin group
2.4 围术期 hs-CRP,IL-1,IL-6,TNF-α 的变化
我们分别检测 hs-CRP,IL-1,IL-6,TNF-α 在 PCI术后24 h的值与PCI术前值的差值来观察围PCI术期炎性因子的变化。瑞舒伐他汀组围PCI术期炎症因子增幅值小,差异有统计学意义,说明瑞舒伐他汀组炎症反应轻,详见表4。
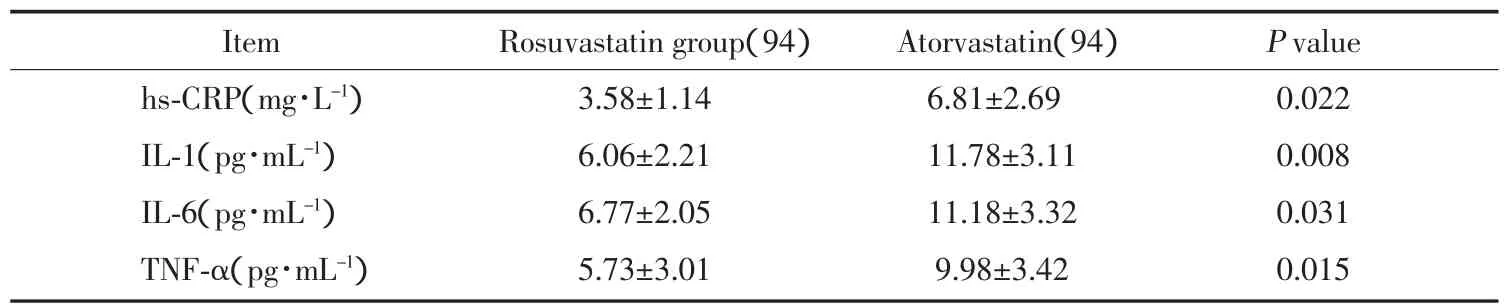
表4 围术期hs-CRP,IL-1,IL-6,TNF-α 的变化差值△Tab.4 The value of hs-CRP,IL-1,IL-6 and TNF-α
3 讨论
冠心病是炎症性疾病,炎症反应贯穿冠心病发生、发展的全过程,特别是在急性冠脉综合征(acute coronary syndrome,ACS)病理生理中:不稳定斑块破裂,炎性因子释放,血小板激活、聚集,血栓形成都有炎性反应参与其中并起关键作用[9,10]。研究发现CRP是血管炎性反应的标志物,它本身在ACS的发病过程中起重要作用。hs-CRP,IL-1,IL-6 和 TNF-α 是ACS发病过程中有代表意义的炎性因子[11]。在ACS发病过程中IL-6可刺激肝脏产生炎性介质,这其中包括CRP和纤维蛋白原;CRP刺激单核细胞释放炎性因子[12,13]:IL-1,IL-6,MCP-1 和 TNF-α 等,炎性因子继而激活白细胞,趋化白细胞聚集,使炎性反应的级联效益不断扩大。炎性因子同时也刺激血管平滑肌细胞产生IL-1,IL-6。ACS患者围PCI术期的心肌损伤和炎性反应密切相关,而且炎性反应的强弱和病人的预后明显相关。Bonz等[14]发现外周血IL-6,CRP浓度升高,ACS患者PCI术后cTNT升高比率明显增高。
临床中20%~30%的患者PCI术后心肌坏死标志物升高,其机制比较复杂,包括:PCI术中斑块移位导致边支血管受压或闭塞;血管痉挛或夹层撕裂导致短暂血管闭塞;远端血管栓塞;慢血流或无复流等导致心肌损伤,这一过程与炎性反应密切相关[15]。此类患者一般没有典型的胸痛,心电图往往没有明显变化,心功能多不受影响,但心肌坏死标志物升高。已有研究表明这种心肌坏死标志物升高与患者预后的不良心血管事件发生率明显相关,围PCI术期的抗动脉粥样硬化,抗炎性反应治疗可能带来益处。
广泛的循证医学证据证实了他汀类药物在冠心病一级预防及二级预防领域的卓越作用。有研究证实ACS病人早期应用大剂量的他汀治疗可减少术后MACE发生率,改善患者预后。另外如前所述许多研究[1~4]已证实围PCI术期早期给予负荷剂量的他汀治疗可减少术后心肌损伤发生率,减少术后MACE发生率。
本研究发现NSTEACS患者术前给予负荷剂量30 mg的瑞舒伐他汀治疗组比负荷剂量120 mg的阿托伐他汀治疗围PCI术期心肌损伤发生率低,且hsCRP,IL-1,IL-6和TNF-α 炎症标志物水平围 PCI术期升高幅度小。这说明负荷剂量30 mg的瑞舒伐他汀治疗比负荷剂量120 mg的阿托伐他汀治疗有更强的抗炎症作用,这可能是瑞舒伐他汀组患者围PCI术期心肌损伤发生率低的主要原因。瑞舒伐他汀组患者术后3月及6月MACE发生率明显降低。
独立于降脂外的作用被称为“他汀多效性作用”,包括改善血管内皮功能、抗动脉粥样硬化,稳定动脉粥样斑块、抗纤维蛋白聚集等作用,他汀类药物也可减少ACS过程中血管氧化应激反应[16],减少炎性因子和粘附因子聚集,减轻炎性反应。这种抗炎作用可能带来额外的血管保护和心肌保护作用。
当然我们研究的样本量不足,随访时间较短,瑞舒伐他汀及阿托伐他汀负荷治疗合适的剂量及术前应用的频率,还需要进一步的研究证实。
[1]Patti G,Pasceri V,Colonna G,et al.Atorvastatin pretreatment improves outcomes in patients with acute coronary syndromes undergoing early percutaneous coronary intervention:results of the ARMYDA-ACSrandomized trial [J].J Am Coll Cardiol,2007,49(12):1272-1278.
[2]Pasceri V,Patti G,Nusca A,et al.ARMYDA Investigators.Randomized trial of atorvastatin for reductionof myocardial damage during coronary intervention:results fromthe ARMYDA (Atorvastatin for Reduction of Myocardial Damage During Angioplasty) study[J].Circulation,2004,110(6):674-678.
[3]Germano Di,SciascioMD,Giuseppe Patti,et al.Efficacy of Atorvastatin Reload in Patients on Chronic Statin Therapy Undergoing Percutaneous Coronary Intervention.Results of the ARMYDA-RECAPTURE(Atorvastatin for Reduction of Myocardial Damage During Angioplasty)Randomized Trial[J].JAm Coll Cardiol,2009,54(6):558-565.
[4]于兴隆,耿静,葛志明,等.负荷剂量阿托伐他汀对非ST段抬高急性冠状动脉综合征经皮冠状动脉介入治疗预后影响的研究[J].中国实用内科杂志,2010,30(9):820-822.
[5]Sun Y,Qi G,Gao Y,et al.Effect of different loadingdosesof atorvastatin on percutaneous coronary interventionforacute coronary syndromes[J].Can JCardiol,2010,26(9):481-485.
[6]Gao Y,Jia Z,Sun Y,et al.Effect of high-dose rosuvastatin loading before percutaneous coronary intervention in female patients with non-ST-segment elevation acutecoronary syndrome[J].Chin Med J,2012,125(13):2250-2254.
[7]Yun KH,Jeong MH,Oh SK,et al.The beneficial effect of high loading dose of rosuvastatin before percutaneous coronary intervention in patientswithacutecoronarysyndrome[J].Int JCardiol,2009,137(3):246-251.
[8]Thygesen K,Alpert JS,White HD,et al.Universal definition of myocardial infarction[J].JAm Coll Cardiol,2007,50(22):2173-2195.
[9]Libby P,Theroux P.Pathophysiology of coronary artery disease[J].Circulation,2005,28,111(25):3481-3488.
[10]Hansson GK.Immunemechanismsin atherosclerosis[J].Arterioscler Thromb Vasc Biol,2001,21(12):1876-1890.
[11]Rus HG,Vlaicu R,Niculescu F.Interleukin-6 and interleukin-8 protein and gene expression in human arterial therosclerotic wall[J].Atherosclerosis,1996,127:263-271.
[12]Buffon A,Biasucci LM,Liuzzo G,et al.Widespread coronary inflammationinunstableangina[J].NEngl JMed,2002,347(1):5-12.
[13]Balbay Y,Tikiz H,Baptiste RJ,et al.Circulating IL-1 beta,IL-6,TNF alpha and soluble ICAM-1 in patients witch chronic stable anginaand myocardial infarction[J].Angiology,2001,52(2):109-114.
[14]Bonz AW,Lengenfelder B,Jacobs M,et al.Cytokine response after percutaneous coronary intervention in stableangina:effect of selectiveglycoprotein IIb/IIIareceptor antagonism[J].Am Heart J,2003,145(4):693-699.
[15]Nallamothu BK.Periprocedural myocardial infarction and mortality:causality versusassociation[J].Jam Coll Cardiol,2003,42(8):1412-1414.
[16]Sposito AC,Chapman MJ.Statin therapy in acute coronary syndromes.Mechanistic insight into clinical benefit[J].Arterioscler Thromb Vasc Biol,2002,22(10):1524-1534.
