双启动子shRNA干扰的协同效应
2013-05-23崔文静马祥敏王雯雯
崔文静,张 矫,马祥敏,王雯雯,王 欣
(天津医科大学附属肿瘤医院,乳腺癌防治教育部重点实验室,天津市肿瘤防治重点实验室,天津300060)
RNA干扰(RNAi)是利用序列特异性的、与靶基因同源的双链RNA(dsRNA)对靶基因转录后的mRNA降解,从而抑制靶基因表达的一种转录后基因沉默现象。将siRNA的质粒、病毒表达载体或带有siRNA表达盒的PCR产物转入细胞,由细胞表达产生RNA干扰作用[1]。siRNA表达载体常用在哺乳动物细胞中表达shRNA(short hairpin RNA)的含有RNA聚合酶Ⅲ(polⅢ)启动子的载体[2],shRNA在细胞内被特异核酸酶(Dicer酶)剪切成siRNA而发挥作用。我们对实验室常用的shRNA表达载体PLKO.1-puro进行改造,构建了含有双启动子(人U6和H1启动子)的shRNA表达载体,实现了两段shRNA序列的共同表达,以期能提高RNAi效应。
1 材料与方法
1.1 材料 DH5α感受态细胞(天根生化科技有限公司);PLKO.1-puro质粒、pH1RP质粒、PCDH-EGFP质粒、Hela细胞株,293t细胞株为本实验室保存;限制性内切酶(NEB公司),Taq DNA聚合酶、dNTPs、T4 DNA连接酶(Fermentas公司);efusion同源重组试剂(百慧生物科技公司);引物由Invitrogen公司合成;小鼠抗GFP一抗,小鼠抗人β-actin一抗(天津三箭生物);抗小鼠荧光二抗(Odyssey红外荧光成像系统自带);DMEM培养基(北京Neuronbc公司);胎牛血清(民海生物);胰酶(Hyclone)。其他为国产分析纯试剂。
1.2 方法
1.2.1 PLKO.1-H1载体的构建 以人源的H1启动子基因序列为模板设计引物,引物序列如下:上游引物H1-F:AAGGCCAGTGTTTTTCTAGAAATCTGAATTATTTCGGAATTCGAACGCTGACGT,下 游 引物H1-R:TGTCTCGAGGTCGAGTCGACGATATATACGCGTAGATCTGTGGTCTCATAC。以pH1RP质粒为模板,H1-F及H1-R为上下游引物行PCR扩增H1启动子,下划线部分为带入的酶切位点(上游的XBaⅠ和EcoRⅠ以及下游的MluⅠ和SalⅠ酶切位点)。以EcoRⅠ酶切PLKO.1载体,回收线性化载体与PCR片段H1同源重组,使得U6和H1启动子串联排列,构建含有U6和H1双启动子的shRNA载体,命名为PLKO.1-H1(图1)。

图1 PLKO.1-H1载体模式
1.2.2 shS1-H1-shS2重组质粒的构建 利用Sigma公司网站的siRNA设计软件设计两对针对EGFP基因不同位点的shRNA序列shEGFP1(正义链5'-CCGGGCTACGTCCAGGAGCGCACCACTCGAGTGGTGCGCTCCTGGACGTAGCTTTTT-3',反义链 5'-CTAGAAAAAGCTACGTCCAGGAGCGCACCACTCGAGTGGTGCGCTCCTGGACGTAGC-3')和shEGFP2(正义链5'-CGCGAGCCACAACGTCTATATCATGCTCGAGCATGATATAGACGTTGTGGCTTTTTT-3',反义链 5'-TCGAAAAAAAGCCACAACGTCTATATCATGCTCGAGCATGATATAGACGTTGTGGCT-3'),分别破坏 AgeⅠ和SalⅠ酶切位点。同时设计两对无干扰作用的片段 shS1(正义链 5'-CCGGTCCTAAGGTTAAGTCGCCCTCGCTCGAGCGAGGGCGACTTAACCTTAGGTTTTT-3',反义链 5'-CTAGAAAAACCTAAGGTTAAGTCGCCCTCGCTCGAGCGAGGGCGACTTAACCTTAGGA-3')和 shS2(正义链 5'-CGCGTAGACGGAGGCTTACAGTCTGGCTCGAGCCAGACTGTAAGCCTCCGTCTTTTTTG-3',反义链 5'-TCGACAAA-AAAGAC-GGAGGCTTACAGTCTGGCTCGAGCCAGACTGTAAGCCTCCGTCTA-3')作为对照,AgeⅠ和 SalⅠ酶切位点保留。将上述4对shRNA片段分别互补退火,得到4组shRNA片段。以AgeⅠ和XbaⅠ双酶切PLKO.1-H1制备线性载体后,首先与shS1片段以T4 DNA连接酶连接,将重组质粒转化DH5α感受态细胞,通过Amp抗性筛选阳性克隆小提质粒,得到PLKO.1-shS1-H1质粒载体。经酶切鉴定后再以MluⅠ和SalⅠ双酶切PLKO.1-shS1-H1质粒制备线性化载体,并与shS2片段连接,得到 shS1-H1-shS2重组质粒载体。
1.2.3 shEGFP1-H1-shEGFP2重组质粒的构建 以AgeⅠ和XbaⅠ内切酶及MluⅠ和SalⅠ内切酶分别双酶切shS1-H1-shS2质粒制备线性载体,并分别与shEGFP1和shEGFP2片段以T4 DNA连接酶连接,得到shEGFP1-H1-shS2和shS1-H1-shEGFP2重组质粒。经酶切鉴定后再以MluⅠ和SalⅠ双酶切shEGFP1-H1-shS2质粒制备线性载体,与shEGFP2片段以T4 DNA连接酶连接,得到shEGFP1-H1-shEGFP2重组质粒。
1.2.4 重组质粒的酶切鉴定 以AgeⅠ和XbaⅠ内切酶以及MluⅠ和SalⅠ内切酶分别双酶切上述四种重组质粒鉴定,由于shEGFP1寡核苷酸链合成时破坏了AgeⅠ酶切位点,而shS1寡核苷酸链合成时保留了 AgeⅠ酶切位点,因此以AgeⅠ和XbaⅠ酶切鉴定上述四种重组质粒时,shEGFP1-H1-shS2/shEGFP1-H1-shEGFP2质粒酶切后被线性化,而shS1-H1-shS2/shS1-H1-shEGFP2重组质粒则可以切出大小两个片段。由于shEGFP2寡核苷酸链合成时破坏了SalⅠ酶切位点,而shS2寡核苷酸链合成时则保留了SalⅠ酶切位点。因此以MluⅠ和SalⅠ对上述四种重组质粒进行酶切鉴定时,shS1-H1-shEGFP2/shEGFP1-H1-shEGFP2质粒酶切后被线性化,而shS1-H1-shS2/shEGFP1-H1-shS2重组质粒则可以切出大小两个片段。0.8%琼脂糖凝胶电泳分析酶切结果。选择酶切鉴定成功的重组质粒进行序列测定。
1.2.5 细胞培养及稳定细胞系的建立 首先建立Hela-EGFP细胞系。293t细胞用DMEM培养基(含10%胎牛血清和1%青链霉素)于37℃、5%CO2孵箱内培养,转染前1 d,将对数生长期的293t细胞以8×106/孔接种于6孔盘,第2天细胞融合达50%时将PCDH-EGFP慢病毒表达载体用磷酸钙法转染293T细胞,转染后48 h收集病毒颗粒。感染前1 d将Hela细胞株以1.5×106/孔接种于6孔板,第2天细胞融合达30%时以EGFP慢病毒颗粒感染Hela细胞株,G418药筛2周得到稳定的带有绿色荧光的Hela-EGFP细胞系。同样用磷酸钙转染法将重组shRNA慢病毒表达载体shEGFP1-H1-shS2、shS1-H1-shEGFP2、shEGFP1-H1-shEGFP2及 shS1-H1-shS2转染入293t细胞,转染后48 h收集病毒颗粒感染Hela-EGFP细胞,嘌呤霉素2 μg/mL药筛1周得到四种稳定的细胞系。在荧光显微镜下观察各个试验组之间的荧光变化。
1.2.6 EGFP蛋白表达的测定方法 将上述四种稳定细胞系分别接种于10cm培养盘,1.8×107/盘,48 h后提取细胞总蛋白,紫外分光光度法测取蛋白浓度。分别取总蛋白15 μg于聚丙烯酰胺凝胶(5%聚合胶,15%分离胶)中电泳后转至NC膜。以5%脱脂牛奶(TBS-T稀释)封闭膜1 h后加入小鼠抗GFP一抗(1∶5 000稀释)和小鼠抗人β-actin一抗(1∶10 000稀释)孵育1 h,洗涤后加入抗小鼠荧光二抗孵育1 h,用Odyssey红外荧光成像系统扫膜显像,Western blot方法行EGFP蛋白表达水平的半定量分析。
2 结果
2.1 重组质粒的鉴定结果 以AgeⅠ和XbaⅠ酶切鉴定上述四种重组质粒时,shEGFP1-H1-shS2/shEGFP1-H1-shEGFP2质粒酶切后被线性化,而shS1-H1-shS2/shS1-H1-shEGFP2重组质粒可以切出大小两个片段。而以MluⅠ和SalⅠ对上述四种重组质粒进行酶切鉴定时,shS1-H1-shEGFP2/shEGFP1-H1-shEGFP2质粒酶切后被线性化,而shS1-H1-shS2/shEGFP1-H1-shS2重组质粒则可以切出大小两个片段。经测序证实插入的4个shRNA片段碱基序列与设计序列完全一致(图2)。

图2 重组质粒测序结果
2.2 细胞荧光强度测定结果 在荧光显微镜下观察细胞荧光,比较在同一曝光条件下细胞的荧光强度(图3),可见与对照组shS1-H1-shS2相比,试验组shEGFP1-H1-shS2及shS1-H1-shEGFP2细胞荧光强度及发荧光的细胞数量均明显降低,与这两组相比shEGFP1-H1-shEGFP2试验组细胞荧光强度降低得更加明显。由此可以初步证明含有两段不同靶特异干扰序列的双启动子shRNA载体干扰效应大于单个靶特异干扰序列的shRNA载体。

图3 干扰EGFP表达结果
2.3 EGFP蛋白表达水平 与对照组shS1-H1-shS2相比,试验组 shEGFP1-H1-shS2及 shS1-H1-shEGFP2的EGFP荧光蛋白表达量明显降低,而与这两组相比,shEGFP1-H1-shEGFP2试验组的EGFP荧光蛋白表达量降低更加明显。见图4。通过对EGFP蛋白表达水平的半定量分析,进一步证明了含有两段不同靶特异干扰序列的双启动子shRNA载体的协同干扰效应。
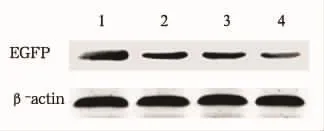
图4 干扰EGFP表达Western blot结果
3 讨论
RNA聚合酶Ⅲ启动子能在体内外高效快速地转录某些小片段基因,这类启动子相对简单,完全位于转录序列上游,因而转录产物不含来自启动子的序列;另外遇到3~6个连续的T就会终止转录,不需要转录终止信号,很适合制备短的RNAs。最常用的RNA聚合酶Ⅲ启动子包括哺乳动物U6 snRNA基因启动子、人7SK基囚启动子和H1 RNA基因启动子等。本次试验研究所应用的PLKO.1-puro表达载体即由U6启动子引导shRNA的合成,由于载体上还携带了由hPKG启动子引导的puromycin抗性筛选标记,可以方便的获得稳定表达shRNA的细胞株。
有研究表明,利用相对排列的RNA聚合酶Ⅲ启动子构建载体,可以在体内直接转录siRNA,并且可以达到较高的 RNA干扰效率[3,4]。国内亦有学者构建了U6和H1相对排列的双启动子载体,均以其间插入的靶序列为模板,分别转录出其正义和反义链,形成功能性siRNA,并可有效干扰相应基因的表达[5]。我们在这些研究的基础上,成功构建了U6和H1串联排列的双启动子shRNA表达载体PLKO.1-H1,同时将在体外互补退火形成发夹结构的两段shRNA片段分别插入U6启动子和H1启动子的下游,并由各自的启动子启动转录。据实验结果显示,含有两段不同靶特异干扰序列的双启动子shRNA载体干扰效应优于单个靶特异干扰序列的shRNA载体,可以得出双启动子shRNA载体存在协同干扰效应的结论。而双启动子shRNA表达载体的作用并不限于此。
随着siRNA表达载体的快速发展,RNAi技术在生物学和医学领域的应用越来越广泛。如在基因功能分析[6]、研究信号传导通路的新途径[7]、新药物的研究与开发[8]、治疗病毒感染[9]及治疗肿瘤等方面的作用。其中RNAi技术在肿瘤防治方面的研究越来越受重视,如BCR-ABL杂合基因的形成导致酪氨酸激酶活性增高而致病 ,针对 BCR-ABL的siRNA可有效治疗该类白血病[10]。肿瘤的发生是多因素、多阶段、多基因相互作用的结果,往往需要多个序列不相关的基因同时沉默才能达到治疗效果。我们所构建的双启动子shRNA载体可以实现双基因表达水平的同时降低,减少了载体DNA的重复使用,提高了基因治疗的安全性。
总之,我们通过这种模式化工具载体的建立,不仅实现了两个siRNA片段的协同干扰,同时为RNAi技术用于肿瘤的基因治疗提供了更加简便、经济、安全的桥梁。此亦指导我们思考在载体中插入更多的RNA聚合酶Ⅲ启动子构建成多启动子的shRNA表达载体,是否可以实现多个基因表达水平的同时降低,从而进行更加复杂的RNAi研究。
[1]袁成良,金晓岚.RNA干扰原理及应用研究进展[J].西部医学,2009,21(4):664-666.
[2]Miyagishi M,Taira K.U6 promoter-driven siRNAs with four uridine 3'overhangs efficiently suppress targeted gene expression in mammalian cells[J].Nat Biotechnol,2002,20(5):497-500.
[3]Zheng LX,Liu J,Batalov S,et al.An approach to genomewide screens of expressed small interfering RNAs in mammalian cells[J].PNAS,2004,101(1):135-140.
[4]Tran N,Cairns MJ,Dawes IW,et al.Expressing functional siRNAs in mammalian cells using convergent transcription[J].BMC Biotechnol,2003,(3):21.
[5]蹇锐,程小星,彭涛,等.U6和 H1双启动子载体用于RNAi的实验研究[J].中国生物工程杂志,2004,11(24):26-31.
[6]Ashrafi K,Chang FY,Watts JL,et al.Genome-wide RNAi analysis of caenorhabditis elegans fat regulatory genes[J].Nature,2003,421(6920):268-272.
[7]Jin P,Zarnescu DC,Cemans S,et al.Biochemical and genetic interaction between the fragile X mental retardation protein and the microRNA pathway[J].Nat Neurosci,2004,7(2):113-117.
[8]Makimura H,Mizuno TM,Mastaitis JW,et al.Reducing hypothalamic AGRP by RNA interference increases metabolic rate and decreases body weight without influencing food intake[J].BMC Neurosci,2002,3(1):18-22.
[9]McCaffrey AP,Nakai H,Pandey K,et al.Inhibition of hepatitis B virus in mice by RNA interference[J].Nat Biotechnol,2003,21(6):639-644.
[10]Wilda M,Fuchs U,Wossmann W,et al.Killing of leukemic cells with a BCRPABL fusion gene by RNA interference(RNAi)[J].Oncogene,2002,21(20):5716-5724.
