黄体中期GnRHa长方案中Gn刺激时间与IVF结局的关系*
2013-05-16熊承良徐望明邹宇洁彭祥炽
程 丹, 杨 菁, 熊承良, 徐望明, 李 洁, 邹宇洁, 郭 跃, 彭祥炽
1武汉大学人民医院生殖医学中心,武汉 430060
2华中科技大学同济医学院计划生育研究所,武汉 430030
体外受精-胚胎移植(invitrofertilization and embryo transfer,IVF-ET)已经成为不孕症治疗的常规手段之一。如何提高IVF成功率,减少周期取消率,获得更好的治疗结局一直是生殖医学领域追求的目标。黄体中期促性腺激素释放激素激动剂(GnRHa)长方案是目前临床上最常用,也是IVF结局较好的促排卵方案[1]。近年来越来越多的学者开始关注到促性腺激素(Gn)对卵子和胚胎质量的影响,开展了很多关于Gn剂量、Gn类型等对IVF结局影响的研究[2-5],也有研究证实大剂量长时间的Gn暴露对卵泡的生长、卵子的发育有不良的影响[6-7],但是目前国内外很少有关于Gn刺激时间与IVF结局关系方面的研究。Gn刺激时间能否初步预测IVF结局?多久的Gn刺激对于卵泡的生长是合适的?多长时间的Gn暴露对于卵子的不良影响较小?本研究回顾我中心初次行IVF助孕的患者资料,分析了Gn刺激时间的患者分布情况,并比较了不同Gn刺激时间的IVF结局,探讨Gn刺激时间与IVF结局间的关系。
1 资料与方法
1.1 研究对象
选择2009年1月至2011年12月间在武汉大学人民医院生殖中心行IVF助孕的1 119例患者。纳入条件:第1次促排卵的采卵周期,患者月经周期正常,双侧卵巢存在,IVF指征为输卵管因素,应用黄体中期GnRHa长方案促排卵,受精方式为常规IVF。本研究经本院伦理委员会批准。
1.2 促排卵与IVF-ET
患者在前次月经周期的黄体期开始每日肌注0.1mg醋酸曲普瑞林(达必佳,辉凌公司),降调14 d后在月经周期的第3~7天开始应用基因重组Gn(Gonal-F,75U/支,默克雪兰诺公司)超促排卵,根据患者年龄、基础卵泡刺激素(bFSH),双侧卵巢窦卵泡计数(basal antral follicle count,BAFC)情况决定启动剂量(75~225U/d)。随后根据动态监测血雌二醇(E2)水平与卵泡生长情况调整Gn剂量,到主导卵泡直径达到18mm,晚间肌注人绒毛膜促性腺激素(HCG,丽珠公司)1万U,34~36h后采卵。常规体外受精,胚胎培养,第3天行胚胎移植,35岁以下患者常规移植2个胚胎,35岁以上患者根据情况移植2或3个胚胎。黄体支持方法为取卵后肌内注射黄体酮针剂(浙江仙琚药业)60mg/d。胚胎移植后12d查血βHCG确定是否妊娠,移植后30d行阴道B超检查,有孕囊确定为临床妊娠,临床妊娠者黄体支持持续6~8周。
1.3 分组
全部患者根据Gn刺激时间分为7组:≤9d、10 d、11d、12d、13d、14d、≥15d组。
1.4 观察指标
1.4.1 IVF患者一般资料 包括年龄、体重指数(BMI,kg/m2)、不育年限(infertility years IY)、bFSH(连续3次测定月经第3天bFSH,记录其平均值)和BAFC。
1.4.2 患者周期资料 包括Gn用量、HCG日E2峰值(mmol/L)、获卵数(ovum retrieval,OR)、受精数(fer-tilized)、卵裂数(cleavaged)、优质胚胎数(good quality embryoes,GQE;即OR后D3≥6细胞,碎片≤20%的胚胎)、移植周期数(embryo transfer,ET)、取消周期数(cancelled cycles,CC)和取消移植、全胚冷冻周期数(total embryo freezing,TEF)等。无可用胚胎移植病例记为CC,计算CC率(取消周期数/采卵周期数);有优质胚胎但因为卵巢过度刺激(ovarian hyperstimulation syndrome,OHSS)高危(移植日有一侧卵巢直径≥9cm或出现明显过度刺激症状)或提前黄素化(HCG日P≥2.5ng/mL)时取消鲜胚移植,将全部胚胎冷冻,并计算TEF率(全胚冷冻周期数/采卵周期数)。
1.4.3 IVF临床结局 包括临床妊娠率(clinical pregnancy rate,CPR;即临床妊娠周期数/移植周期数),着床率(implantation rate,IR;即孕囊个数/移植胚 胎 数),流 产 率 (spontaneous abortion rate,SAR;即流产周期数/临床妊娠周期数)和活胎分娩率(live birth rate,LBR;即28周以后活胎分娩周期数/移植周期数)。
1.5 统计学方法
采用SPSS 12.0统计软件进行数据分析,结果以±s表示。计量资料满足方差齐性条件时,采用t检验;不满足方差齐性条件,则采用非参数的Kruskal-Wallis检验;两组率的比较采用χ2检验;以P<0.01为差异有统计学意义。
2 结果
2.1 全组病例的周期资料
共有1 119例患者被纳入本研究,患者平均刺激时间为(11.8±1.8)d(7~18d),平均 Gn用量为(37.7±11.8)支(16~63支),平均 OR数为(12.7±3.9)个,平均获得胚胎(8.5±3.1)个,临床妊娠率47.3%,着床率28.5%,流产率6.8%,活胎分娩率38.1%。40例 (3.6%)患者因无可移植胚胎取消周期,48例(4.3%)因OHSS高危或P提前上升而取消鲜胚移植行全胚冷冻,中、重度OHSS发生率为 2.3%(26例),较文献报道稍低[8-9]。
2.2 各组患者一般情况及卵巢储备指标
Gn刺激时间的患者分布情况如表1所示。Gn刺激时间以12d者最多,共272例,占总人数的24.3%,其 余 依 次 为 11d(247 例,22.1%),13d(192例,17.2%),10d(137例,12.2%),14d(122例,10.9%),≥15d(92例,8.2%)和≤9d(57例,5.1%)。各组的年龄、BMI、不育年限、bFSH 和BAFC与全组患者的平均水平相比,差异均无统计学意义(表1)。
表1 不同Gn刺激时间患者的一般资料及卵巢储备情况(±s)Table 1 Baseline data and ovarian reserve of patients in different groups(±s)
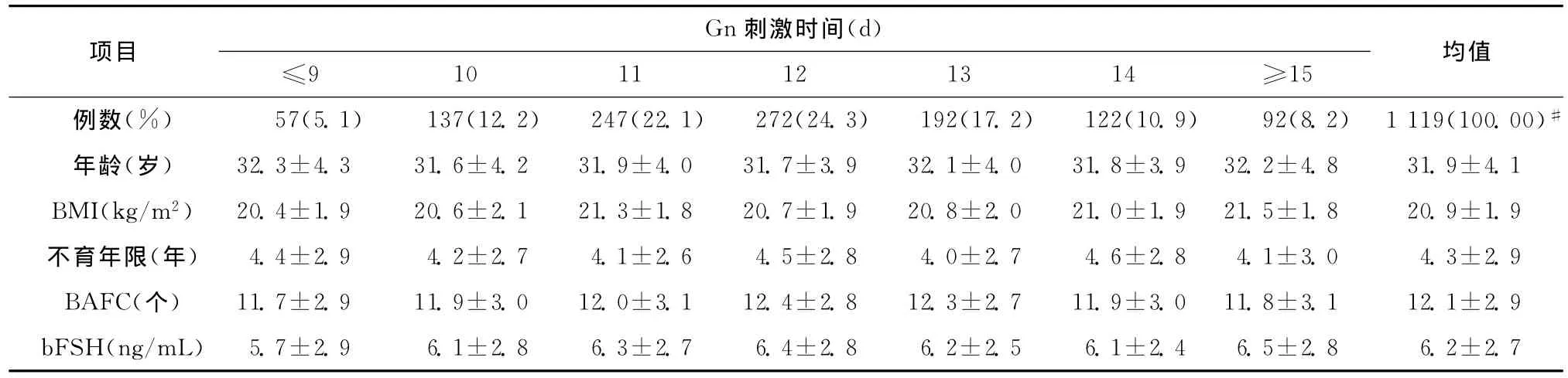
表1 不同Gn刺激时间患者的一般资料及卵巢储备情况(±s)Table 1 Baseline data and ovarian reserve of patients in different groups(±s)
#为合计
均值例数(%) 57(5.1) 137(12.2) 247(22.1) 272(24.3) 192(17.2) 122(10.9) 92(8.2) 1 119(100.00)项目Gn刺激时间(d)≤9 10 11 12 13 14 ≥15#年龄(岁) 32.3±4.3 31.6±4.2 31.9±4.0 31.7±3.9 32.1±4.0 31.8±3.9 32.2±4.8 31.9±4.1 BMI(kg/m2) 20.4±1.9 20.6±2.1 21.3±1.8 20.7±1.9 20.8±2.0 21.0±1.9 21.5±1.8 20.9±1.9不育年限(年) 4.4±2.9 4.2±2.7 4.1±2.6 4.5±2.8 4.0±2.7 4.6±2.8 4.1±3.0 4.3±2.9 BAFC(个) 11.7±2.9 11.9±3.0 12.0±3.1 12.4±2.8 12.3±2.7 11.9±3.0 11.8±3.1 12.1±2.9 bFSH(ng/mL) 5.7±2.9 6.1±2.8 6.3±2.7 6.4±2.8 6.2±2.5 6.1±2.4 6.5±2.8 6.2±2.7
2.3 各组超促排卵与IVF周期情况
各组超促排卵中Gn用量、HCG日E2水平、获卵数及IVF实验室资料见表2。随着Gn刺激时间的增加,Gn用量与HCG日E2水平逐渐上升,≤9d组、10d组、14d组及≥15d组与全组资料的平均水平相比,差异有统计学意义;14d组与≥15d组获卵数与受精数最多,但卵裂数并未相应增加,12d组和13d组优质胚胎数最多,与全组均值相比差异无统计学意义。与全组均值比较,≤9d组与10d组Gn用量少,HCG日E2峰值低,获卵数少、受精数少、优质胚胎数少,周期取消率高,但全胚冷冻率与OHSS发生率较低;而14d组与≥15d组虽获卵数、受精数多,但优质胚胎数少,周期取消率与全胚冷冻率均高,发生OHSS比例也较高。
表2 各组超促排卵情况与IVF周期资料(±s)Table 2 Controlled ovarian hyperstimulation and IVF cycle data in different groups(±s)
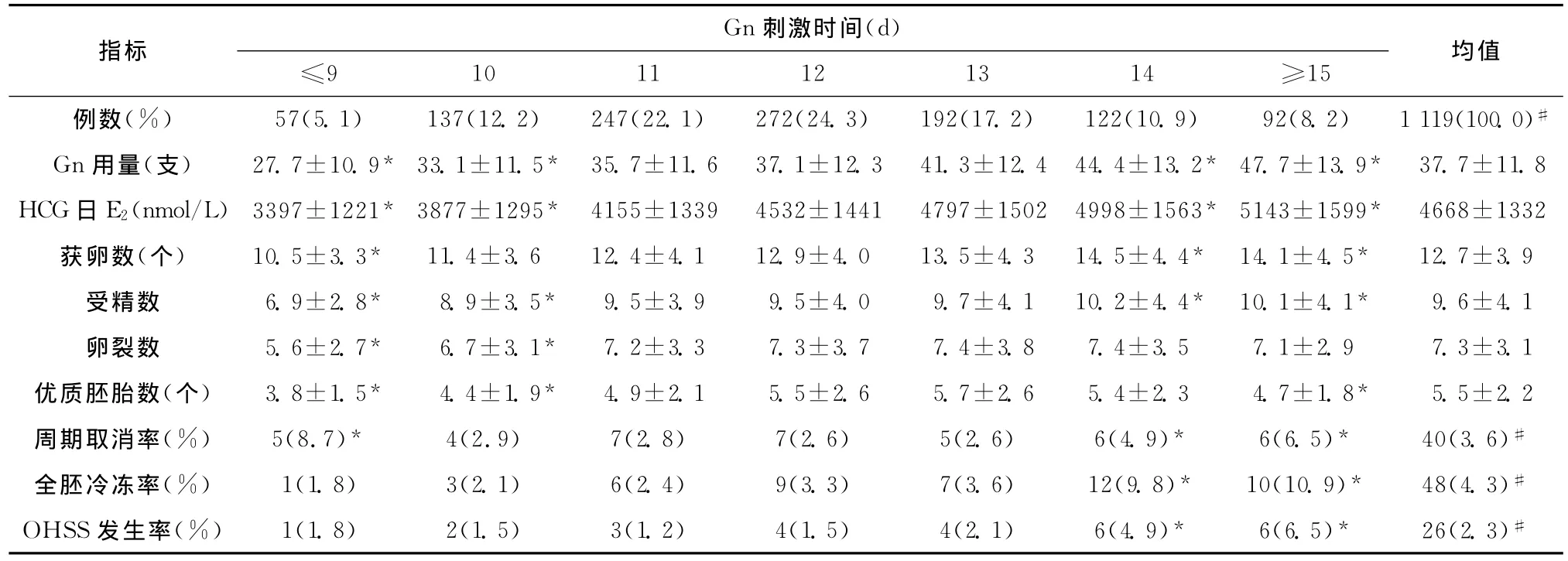
表2 各组超促排卵情况与IVF周期资料(±s)Table 2 Controlled ovarian hyperstimulation and IVF cycle data in different groups(±s)
#为合计;与全组资料的均值比较,*P<0.01
均值例数(%) 57(5.1) 137(12.2) 247(22.1) 272(24.3) 192(17.2) 122(10.9) 92(8.2) 1 119(100.0)指标 Gn刺激时间(d)≤9 10 11 12 13 14 ≥15#Gn用量(支) 27.7±10.9* 33.1±11.5* 35.7±11.6 37.1±12.3 41.3±12.4 44.4±13.2* 47.7±13.9* 37.7±11.8 HCG日E2(nmol/L)3397±1221* 3877±1295* 4155±1339 4532±1441 4797±1502 4998±1563* 5143±1599* 4668±1332获卵数(个) 10.5±3.3* 11.4±3.6 12.4±4.1 12.9±4.0 13.5±4.3 14.5±4.4* 14.1±4.5* 12.7±3.9受精数 6.9±2.8* 8.9±3.5* 9.5±3.9 9.5±4.0 9.7±4.1 10.2±4.4* 10.1±4.1* 9.6±4.1卵裂数 5.6±2.7* 6.7±3.1* 7.2±3.3 7.3±3.7 7.4±3.8 7.4±3.5 7.1±2.9 7.3±3.1优质胚胎数(个) 3.8±1.5* 4.4±1.9* 4.9±2.1 5.5±2.6 5.7±2.6 5.4±2.3 4.7±1.8* 5.5±2.2周期取消率(%) 5(8.7)* 4(2.9) 7(2.8) 7(2.6) 5(2.6) 6(4.9)* 6(6.5)* 40(3.6)#全胚冷冻率(%) 1(1.8) 3(2.1) 6(2.4) 9(3.3) 7(3.6) 12(9.8)* 10(10.9)* 48(4.3)#OHSS发生率(%) 1(1.8) 2(1.5) 3(1.2) 4(1.5) 4(2.1) 6(4.9)* 6(6.5)* 26(2.3)#
2.4 各组IVF治疗结局
如表3所示,Gn刺激时间少于10d者IVF结局较差,刺激时间在11~13d者IVF结局最好,表现为更高的临床妊娠率、着床率、活胎分娩率和较低的流产率。而随着刺激时间的增加,IVF结局并没有相应提高,刺激时间超过14d者临床妊娠率、着床率、活胎分娩率明显降低,而流产率较高。
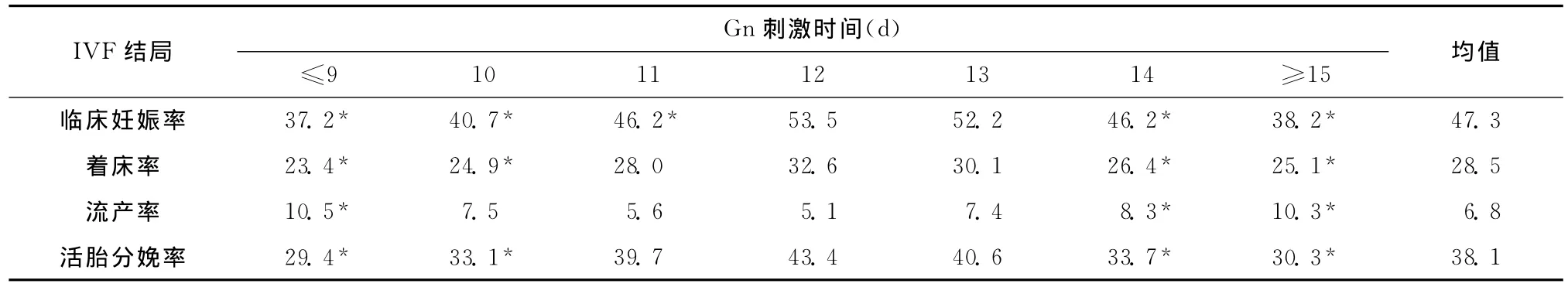
表3 不同Gn刺激时间患者的IVF治疗结局(%)Table 3 The profiles of IVF outcomes in different groups(%)
3 讨论
在IVF控制性超促排卵方案中GnRHa长方案的应用是一个里程碑式的发展,GnRHa长方案通过在前次月经周期的黄体期开始应用GnRH的类似物占领垂体的受体达到抑制垂体的目的,从而在卵泡生长早期抑制内源性的激素分泌,避免出现过早的黄体生成素(LH)峰[10],使卵泡对外源性的Gn有更好的反应,刺激多个卵泡同步发育成熟。长方案应用于IVF临床已经超过25年,通过长方案获得多个同步发育成熟的卵母细胞体外培养受精,使IVF效率大为提高,明显提高了IVF临床妊娠率,使其成为治疗不育症的常规方法。
IVF治疗结局与卵子质量息息相关,获得优质的卵子才能得到优质的胚胎,从而获得高的临床妊娠率,降低妊娠丢失率。因此获得好的IVF治疗结局的关键就是能够获得高质量的卵子。很多研究人员都关注到IVF促排卵药物对卵子质量的影响[11],有很多关于Gn剂量、剂型等对卵子质量影响的相关报道,但目前尚未见关于Gn刺激时间与IVF结局之间关系的报道。
本研究通过回顾性分析1 119例应用GnRHa长方案促排卵行IVF的临床资料,比较了Gn刺激时间与IVF结局之间的关系。结果发现Gn刺激时间与IVF结局有关,刺激时间过长(≥14d)与过短(≤10d)均预示着不良的IVF结局,刺激时间在11~13d时IVF临床结局最佳。刺激时间太短导致IVF结局不良可能是由于卵泡生长过快,导致卵细胞胞质与胞核发育不同步,胞核成熟而胞质不成熟,影响卵子质量或导致空卵泡综合征,因此Gn刺激少于10d的2组尽管卵巢储备功能的指标无差异,但促排卵后可用胚胎较少,周期取消率较高。
有研究报道对于高龄低反应的患者单纯增加Gn剂量,延长Gn刺激时间可能增加获卵数,但并不能改善IVF治疗结局,也不能降低周期取消率[12-13]。我们的研究也得出相同的结论,当 Gn刺激时间超过14d时,尽管获卵数有所增加,但是无可移植胚胎的周期取消率明显增加,而且由于提早黄素化(premature luteinization,PL)[14-15]引起卵泡发育与内膜生长不同步,种植窗提早关闭而取消新鲜胚胎移植的周期比例明显增加。本组资料中依照文献报道[16-18]当 HCG日孕酮(P)水平超过2.5ng/mL定义为提早黄素化,取消新鲜周期移植。由于提早黄素化或OHSS高危(移植日有一侧卵巢直径大于9cm或已经出现明显OHSS症状)而取消鲜胚移植的全胚冷冻率为4.3%,与文献报道相仿。
Al-Ghamdi等[19]的研究发现过高的Gn刺激可能降低临床妊娠率和活产率,而提高流产率。我们的资料也证实了这样的结论。本组资料发现当Gn刺激时间超过14d时,流产率明显增加。有文献[20]报道大量外源性Gn对胚胎着床与着床后胎儿发育的不良影响。尽管其确切的影响机制以及Gn用量与流产率之间是否存在一定的量效关系尚不完全明了,但有研究证实大剂量外源性Gn可能影响生长中卵泡内的颗粒细胞[21-22]。体外研究也证实大剂量的外源性Gn对卵子中的纺锤体形成与染色体分离有不良的影响,确切的作用途径与关系尚有待于进一步研究证实。
Gn刺激时间过长或过短都预示着不良的IVF治疗结局,可能与促排卵过程中Gn启动剂量、Gn剂量的调整不当等有关。当患者初次IVF治疗失败需要重复助孕治疗时,前次促排卵治疗经过对于以后的促排卵方案、Gn启动剂量、Gn剂量的调整、促排卵时间的控制等都有非常重要的指导意义。
总之,Gn刺激时间与IVF治疗结局有关,适当的Gn刺激预示着较好的IVF治疗结局,过长与过短的Gn刺激都可能导致不良的治疗结局。但是本研究仅为回顾性分析,而且样本量较小,Gn刺激时间与IVF结局之间的具体关系尚需要进一步的大样本随机对照研究。
[1] Bosch E,Ezcurra D.Individualised controlled ovarian stimulation(iCOS):maximising success rates for assisted reproductive technology patients[J].Reprod Biol Endocrinol,2011,9:82-91.
[2] Tan S L,Child T J,Cheung A P,et al.A randomized,doubleblind,multicenter study comparing a starting dose of 100IU or 200IU of recombinant follicle stimulating hormone(Puregonr)in women undergoing controlled ovarian hyperstimulation for IVF treatment[J].J Assist Reprod Genet,2005,22(2):81-88.
[3] Roberts R,Iatropoulou A,Ciantar D,et al.Follicle-stimulating hormone affects metaphase I chromosome alignment and increases aneuploidy in mouse oocytes maturedinvitro[J].Biol Reprod,2005,72(1):107-118.
[4] Pal L,Jindal S,Witt B R,et al.Less is more—Increased gonadotropin use for ovarian stimulation adversely influences clinical pregnancy and live birth following IVF[J].Fertil Steril,2008,89(6):1694-1701.
[5] Li Y,Li Y,Lai Q,et al.Comparison between a GnRH agonist and a GnRH antagonist protocol for the same patient undergoing IVF[J].J Huazhong Univ Sci Technolog [Med Sci],2008,28(5):618-620.
[6] Fernández-Shaw S,Pérez Esturo N,Cercas Duque R,et al.Mild IVF using GnRH agonist long protocol is possible:Comparing stimulations with 100IU vs.150IU recombinant FSH as starting dose[J].J Assist Reprod Genet,2009,26(2/3):75-82.
[7] Al-Inany H,van Gelder P.Success of frozen embryo transfer:Does the type of gonadotropin influence the outcome?[J].2010,2:89-98.
[8] Humaidan P,Quartarolo J,Papanikolaou E G.Preventing ovarian hyperstimulation syndrome:guidance for the clinician[J].Fertil Steril,2010,94(2):389-400.
[9] Chen C D,Chen S U,Yang Y S.Prevention and management of ovarian hyperstimulation syndrome[J].Best Pract Res Clin Obstet Gynaecol,2012,26(6):817-827.
[10] Ye H,Huang G N,Zeng P H,et al.IVF/ICSI outcomes between cycles with luteal estradiol(E2)pre-treatment before GnRH antagonist protocol and standard long GnRH agonist protocol:aprospective and randomized study[J].J Assist Reprod Genet,2009,26(2/3):105-111.
[11] Revelli A,Casano S,Salvagno F,et al.Milder is better?advantages and disadvantages of“mild”ovarian stimulation for humaninvitrofertilization[J].Reprod Biol Endocrinol,2011,9:25.
[12] Wei Z,Cheng X,Li H,et al.Effects of prolonging administration gonadotropin on unexpectedly poor ovarian responders undergoinginvitrofertilization[J].Reprod Biol Endocrinol,2010,8:26-31.
[13] Detti L,Ambler D R,Yelian F D,et al.Timing and duration of use of GnRH antagonist down-regulation for IVF/ICSI cycles have no impact on oocyte quality or pregnancy outcomes[J].J Assist Reprod Genet,2008,25 (5):177-181.
[14] Elnashar A M,Aboubakr M.Progesterone rise on the day of HCG administration(premature luteinization)in IVF:An overdue update[J].J Assist Reprod Genet,2010,27(4):149-155.
[15] Yanaihara A,Yorimitsu T,Motoyama H,et al.The decrease of serum luteinizing hormone level by agonadotropin-relea-sing hormone antagonist following the mild IVF stimulation protocol for IVF and its clinical outcome[J].J Assist Reprod Genet,2008,25(4):115-118.
[16] Polotsky A J,Daif J L,Jindal S,et al.Serum progesterone on the day of hCG administration predicts clinical pregnancy of sibling frozen embryos[J].Fertil Steril,2009,92(6):1880-1885.
[17] Chen S L,Wu F R,Luo C,et al.Combined analysis of endometrial thickness and pattern in predicting outcome ofinvitrofertilization and embryo transfer:a retrospective cohort study[J].Reprod Biol Endocrinol,2010,8:30.
[18] Liu Q,Zhu G,Hu J,et al.Relationship between pronuclear scoring and embryo quality and implantation potential in IVFET[J].J Huazhong Univ Sci Technolog[Med Sci],2008,28(2):204-206.
[19] Al-Ghamdi A,Coskun S,Al-Hassan S,et al.The correlation between endometrial thickness and outcome ofinvitrofertilization and embryo transfer (IVF-ET)outcome[J].Reprod Biol Endocrinol,2008,6:37.
[20] Fu J,Wang X J,Wang Y W,et al.The influence of early cleavage on embryo developmental potential and IVF/ICSI outcome[J].J Assist Reprod Genet,2009,26(8):437-441.
[21] Kaleli S,Yanikkaya-Demirel G,Erel C T,et al.High rate of aneuploidy in luteinized granulosa cells obtained from follicular fluid in women who underwent controlled ovarian hyperstimulation[J].Fertil Steril,2005,84(3):802-804.
[22] Sibug R M,Helmerhorst F M,Tijssen A M I,et al.Gonadotropin stimulation reduces VEGF120expression in the mouse uterus during the peri-implantation period[J].Hum Reprod,2002,17(6):1643-1648.
