酶法从虾壳中提取甲壳素工艺优化的研究
2013-05-15刘锡红赵灵希张成杰熊海容
刘锡红,赵灵希,张成杰,刘 虹,覃 瑞,熊海容,*
(1.中南民族大学南方少数民族地区生物资源保护及综合利用工程中心,湖北武汉430074;2.武汉新华扬生物股份有限公司,湖北武汉430000)
目前工业化生产甲壳素的原料主要是虾、蟹壳,2006年我国对虾养殖产量已高达156×104t左右,目前我国的对虾产品主要以出口为主,而出口产品又以无头对虾(虾仁)为主。对虾的虾头和虾壳占整个虾质量的30%~40%,在对虾的加工过程中会产生大量的虾头和虾壳下脚料[1]。目前工业上去除虾壳中蛋白质的主要方法是采用稀NaOH溶液熬煮虾壳,熬煮液经HCl中和后回收其中的蛋白质,固体物质经KMnO4氧化,再用NaHSO3还原,水洗干燥得到甲壳素[2-4]。采用这一方法,碱液及热能消耗大,易产生废液废水,环境污染严重,虽可以实现蛋白质的回收利用,但利用率和价值都较低,工序复杂[5]。采用酶法脱蛋白可降低有机试剂的用量,缩短提取时间,效果比常规方法好,而且酶法脱蛋白化学试剂用量少,蛋白质回收容易。如果采用蛋白酶水解的方式脱除虾壳中的蛋白质,不仅条件温和,工艺简单,废水废液少,而且可实现节能减排,因此是一种值得研究和推广的绿色加工技术。本实验利用蛋白酶去除蛋白质收获甲壳素,避免了碱法对环境造成的污染。虾头和虾壳中残留有大量的蛋白质,另外还有多不饱和脂肪酸、VE、虾青素和各种矿物质等成分,营养价值很高。利用蛋白酶水解虾头和虾壳,可以将其中的蛋白质水解为短肽、氨基酸等,所得水解液经喷雾干燥可制成蛋白粉,或者经调配制成虾油[1]。本论文采用不同蛋白酶水解脱钙虾壳,研究了酶解的条件及酶解对甲壳素微观表面状态的影响,选出最合理的蛋白酶及其水解条件。
1 材料与方法
1.1 材料与仪器
虾壳 购自浙江海鲜市场,经过挑选除杂、清洗和干燥后,粉碎混匀,储藏备用;标准甲壳素样品Sigma公司,色谱纯;碱性蛋白酶、酸性蛋白酶 源叶生物;胰蛋白酶、木瓜蛋白 BIOSHARP公司;NaOH(分析纯)、硼酸(化学纯)、硼砂(化学纯) 国药集团试剂有限公司;福林酚试剂 北京鼎国生物技术有限公司;干酪素 源叶生物;L-酪氨酸 Sigma公司;其他化学药品 均为分析纯。
RK1028型超声波清洗仪 德国BANDELIN公司;JA2003型电子分析天平 HANGPING公司;722型紫外可见分光光度计 UNICO公司;半微量凯氏定氮仪 上海申立仪器有限公司;低温超高速冷冻离心机 德国Eppendorf公司;jsm6510型电子扫描显微镜 日本;E-1010型离子溅射仪 HITACHI;粉碎机 上海速邦。
1.2 实验方法
1.2.1 工艺流程 酶法改良甲壳素制备工艺流程:虾壳→预处理→稀盐酸脱碳酸盐→水洗至中性→蛋白酶脱除蛋白质→水洗至中性→干燥→脱色→甲壳素。
1.2.2 操作步骤
1.2.2.1 预处理 虾壳经分检去杂后浸入40℃温水15min,去除杂质,捞取虾壳用清水反复冲洗至无浮液并沥干待用。
1.2.2.2 烘干 将清洗好的虾壳置于鼓风干燥箱中干燥,干燥温度为80℃,时间8h。
1.2.2.3 粉碎 对达到干燥要求的虾壳,用粉碎机进行粉碎至所需粒度。
1.2.2.4 稀盐酸脱碳酸盐 将烘干的虾壳用0.25mol/L HCl在室温下搅拌处理30min[6]。
1.2.2.5 酶解 将虾壳和蒸馏水加入玻璃容器里,用2%氢氧化钠调节pH至蛋白酶最适pH,再加入蛋白酶粉,水浴锅预热至蛋白酶最适温度,在恒温搅拌器的条件下进行反应。
1.2.3 酶活力的测定 采用Folin显色法[7],测OD680nm值并计算酶活力。酶活定义为1g固体酶粉(或1mL液体酶),在一定温度和pH条件下,1min水解酪素产生1μg酪氨酸为1个酶活力单位,以U/g(U/mL)表示。
1.2.4 虾壳常规指标的测定
1.2.4.1 水分测定 采用105℃恒重法[8]。
1.2.4.2 脂肪含量的测定 采用索氏抽提法测定[9]。
1.2.4.3 灰分含量的测定 采用550℃干法灰化法测定[10]。
1.2.4.4 甲壳素化学制备方法 称取10g虾壳粉,用5%盐酸溶液浸泡至无气泡产生,洗涤至中性,烘干,用10%氢氧化钠在沸水浴中浸泡1~2h,洗涤至中性,烘干。其中脱蛋白与脱钙处理重复2~3次。进行脱色,得到白色甲壳素,称取质量[11]。
1.2.4.5 蛋白质含量的测定 称取5g粉碎的虾壳,加人30mL质量分数为4%的NaOH溶液,于温度95℃下水浴浸泡60min,离心分离,滤渣重复上述实验,合并上清液,用凯氏定氮法测定上清液中的蛋白质含量[1]。
1.2.5 样品总氮含量的测定 采用食品安全国家标准测定食品中蛋白质含量[12]。
1.2.6 蛋白质水解率的测定 公式如下:
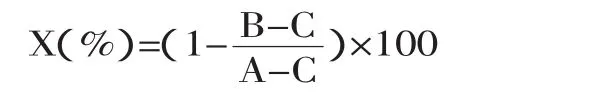
式中:X-试样中蛋白质的水解率;A-原材料虾壳中的总氮;B-酶法水解后收获物的总氮;C-酸碱法水解虾壳获得的甲壳素的总氮。
1.2.7 水解用蛋白酶的选择 分别采用碱性蛋白酶、酸性蛋白酶、木瓜蛋白酶水、胰蛋白酶解粉碎成20目虾壳,加酶量10000U/g,在酶的最适反应条件(见表1)下反应5h,底物质量浓度为2g/100mL,比较四种酶的水解率大小。

表1 酶的最适反应温度、pHTable 1 The optimal temperature and pH of enzymes
1.2.8 酶解时间的选择 加水到粉碎成20目的虾壳中,底物质量浓度为2g/100mL,添加碱性蛋白酶5000U/g,于温度60℃保温水解24h,pH为8.5,反应过程中分别在第2、3、4、5、6、7、10、24h取样测定其水解率。
1.2.9 酶用量的选择 加入水到粉碎成20目的虾壳中,底物浓度为2g/100mL,碱性酶用量分别为2000、3000、4000、5000、6000、7000U/g,于温度60℃保温水解5h,pH为8.5,反应结束后,测定水解率。
1.2.10 最佳底物浓度的选择 加不同量的水到粉碎成20目的虾壳中,使底物质量浓度分别为1、2、2.5、3、3.5g/100mL,添加碱性蛋白酶5000U/g,于温度60℃保温水解5h,pH为8.5,反应结束测定水解度。
1.2.11 虾头、虾壳壳破碎粒度的选择 将虾壳分别粉碎成过20目筛、过40目筛和过80目筛,底物质量浓度为2g/100mL,加入5000U/g碱性蛋白酶,于温度60℃保温水解5h,pH为8.5,反应结束后测定水解率。
1.2.12 脱色方法 将前述工艺所得的虾壳在3%KMnO4溶液中,固液比为1∶10,常温下处理0.5h,后换用1%草酸溶液,固液比为1∶20,在70℃水浴中处理15min或常温下处理5h[13]。
1.2.13 甲壳素的表征与特性分析 采用jsm6510-EDAX(日本)电子扫描显微镜对甲壳素标准品、化学法甲壳素样品和酶法甲壳素样品表征进行检测。用HITACHI E-1010离子溅射仪在观察面上镀金后,在3000倍数下对试样甲壳素标准品、化学法甲壳素样品和酶法甲壳素样品进行表面形貌的观察[14]。
2 结果与讨论
2.1 虾壳基本成分
经测定,虾壳中各成分含量为:水分6.4%,粗蛋白40.9%,粗脂肪7.2%,灰分11.7%,其余部分主要为甲壳素。
2.2 酶活力的测定结果
4种蛋白酶酶活力的测定结果见表2。
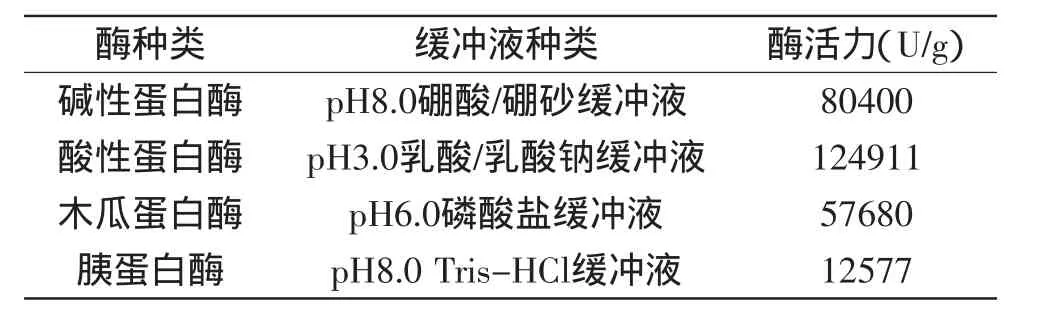
表2 酶活力测定结果Table 2 The results of enzyme activity
由表1可知,木瓜蛋白酶和胰蛋白酶的酶活力相对较低,碱性蛋白酶和酸性蛋白酶的酶活力都比较高。
2.3 蛋白酶的确定
4种酶的水解率见图1。
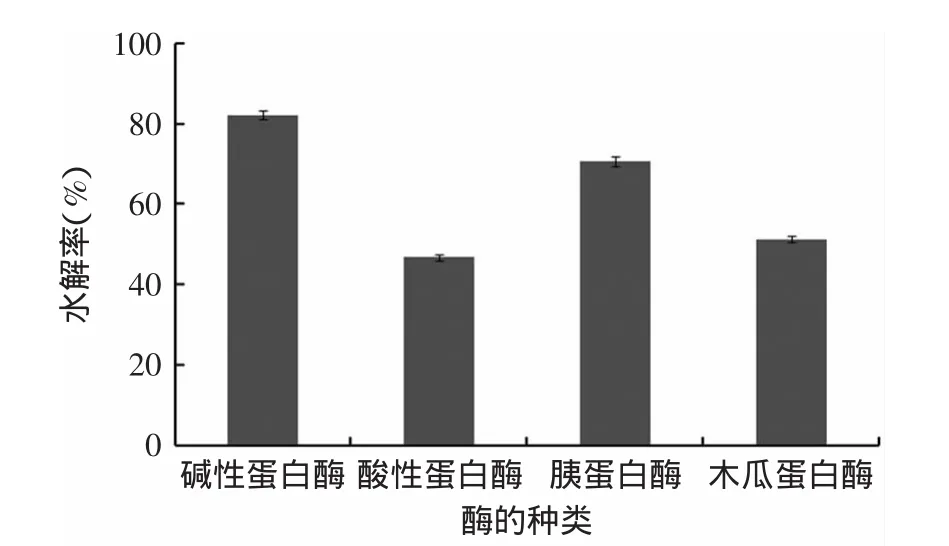
图1 酶种类对水解率的影响Fig.1 The effect of different kinds of enzyme on hydrolysis rate
由图1可知,酸性蛋白酶和木瓜蛋白酶的水解效果最差,水解率相对较低,碱性蛋白酶和胰蛋白酶的酶解效果最好,水解率都比较高。考虑到碱性蛋白酶的水解率略高于胰蛋白酶,而且胰蛋白酶的价格昂贵,且综合表1结果的碱性蛋白酶的酶活力相对较高,选择碱性蛋白酶进行进一步的研究。
2.4 酶解条件的确定
2.4.1 酶解时间的确定 酶解时间对水解效果的影响见图2。
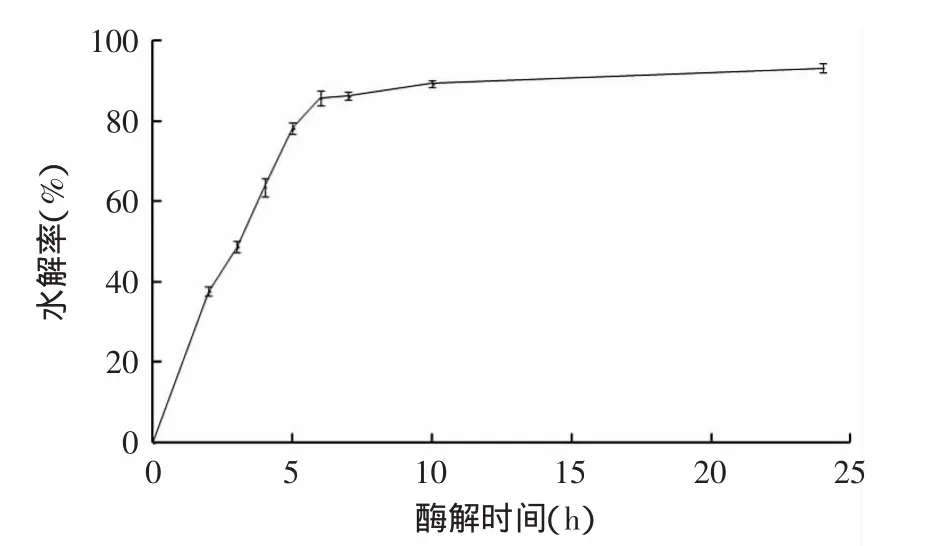
图2 酶解时间对酶解效果的影响Fig.2 The effect of time on hydrolysis rate
由图2可知,酶解液的水解率随着酶解时间延长而逐渐增加,在前2h增长速度极快,酶解到第7h反应便逐渐趋于平衡,继续延长酶解时间,水解率增加较少,考虑到生产效率问题,选择酶解时间6h为宜。
2.4.2 酶用量的确定 酶用量对酶解效果的影响见图3。
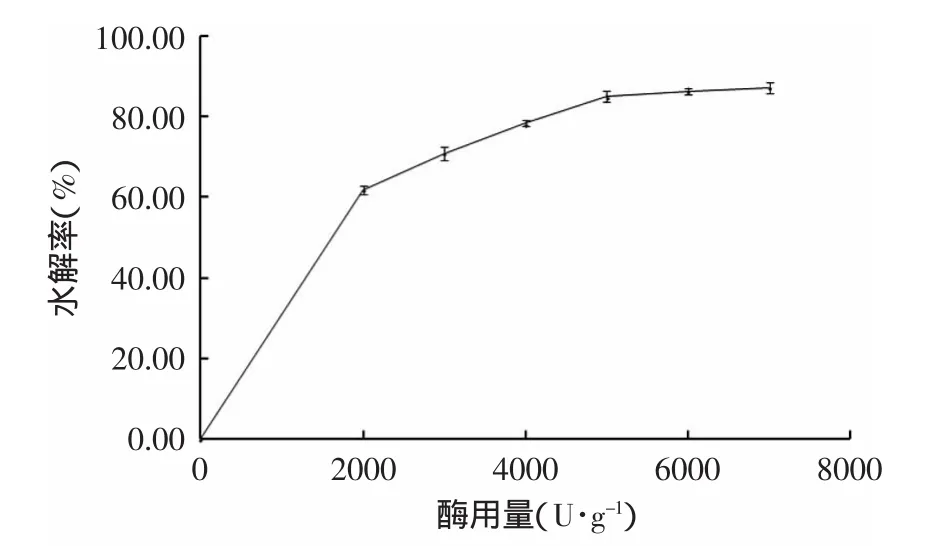
图3 酶用量对酶解效果的影响Fig.3 The effect of enzyme dosage on hydrolysis rate
由图3可知,碱性蛋白酶用量在2000~7000U/g的情况下,随着酶用量的增加,酶解液的水解率逐渐增大,当碱性蛋白酶用量超过5000U/g后,水解效果提高并不明显,因此,从减少成本的角度考虑,选择采用碱性蛋白酶用量为5000U/g。
2.4.3 最佳底物质量浓度的确定 最佳底物质量浓度对酶解效果的影响见图4。
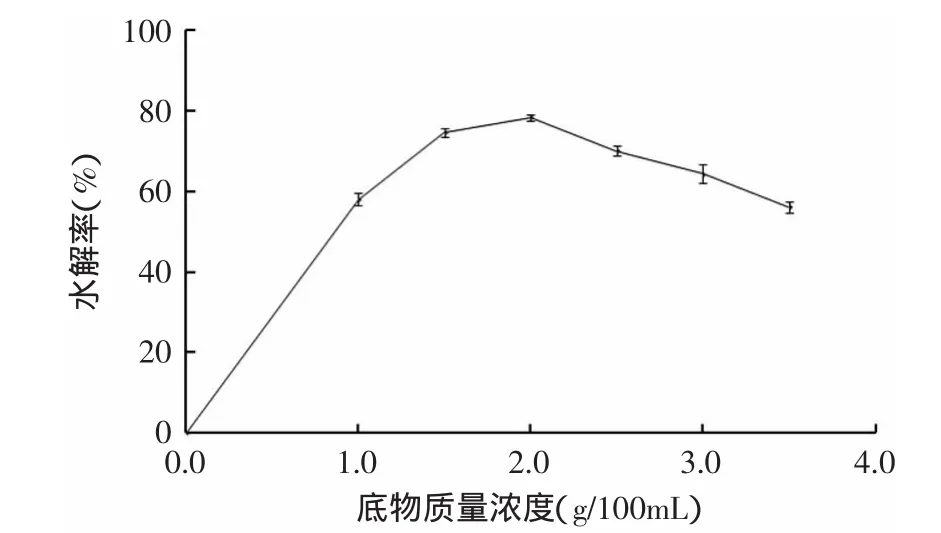
图4 底物质量浓度对酶解效果的影响Fig.4 The effect of concentration of substrate on hydrolysis rate
由图4可知,随着底物质量浓度的增大,水解率也增大,当底物质量浓度为2.0g/100mL时,水解效果趋于平衡,当底物浓度高于2.0g/100mL时,对水解率产生一定的影响。但在生产中采用高底物浓度使得单位时间和单位容积的反应器收得量更高,因此实际生产过程中,可以选择3.0~3.5g/100mL的底物质量浓度,本实验则选用2.0g/100mL进行后续实验。
2.4.4 虾壳破碎粒度的确定 虾壳破碎粒度对酶解效果的影响见图5。
由图5可知,过80目筛的虾壳水解效果最好,但三个破碎度之间的水解率差异不显著(p>0.05),从后期处理的简化考虑,选择过20目筛的虾壳进行后续实验。
2.5 脱色效果
甲壳素的脱色,主要是将甲壳素的颜色去除,使甲壳素颜色变浅,提高产品价值。在脱色前,甲壳素不宜粉碎成较小颗粒,以免被氧化降解,形成更小颗粒或细粉末状,影响产物回收率,降低得率[15]。
将脱钙和脱蛋白质后的虾壳在分别经过3%KMnO4溶液和1%草酸溶液处理。实验显示脱色效果良好,所得甲壳素蓬松,色泽半透明,且白晳、均一。
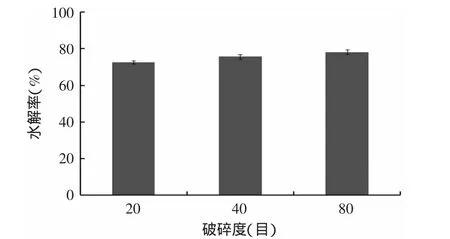
图5 虾壳破碎粒度对酶解效果的影响Fig.5 The effect of particle size on hydrolysis rate
2.6 甲壳素的表征与特性分析
根据Gershecker[16]的工作及研究表明,甲壳由表壳层、外壳层、含钙内壳层及非含钙内壳层组成。真皮层位于含钙内壳层内,真皮层内的色素细胞分泌黑色素。表壳层由酚类、脂肪、蛋白质所组成的薄膜状结构,在甲壳体表面起到类似涂层的保护作用[15]。
本研究比较了脱钙后虾壳经化学法脱蛋白及采用碱性蛋白酶水解蛋白后的电镜照片,并与甲壳素标准品作对比,结果见图6~图8。
图6~图7分别为甲壳素标准品和传统化学工艺制备的甲壳素的扫描电镜图,从图中可知,脱蛋白后,样品表面较为光滑,说明蛋白质、钙和脂肪已被基本除去,剩下的主要为甲壳素。图8为酶法改良工艺制备的甲壳素的扫描电镜图,可以看到甲壳素的组织结构,表面为网状结构,图中白点应是真皮层内的色素细胞分泌出的色素颗粒,表面很平整,说明蛋白质、脂肪和钙已基本被除去。比较从三种甲壳素的扫描电镜照片,可认为本实验采用的由虾壳制备甲壳素的工艺是合理的。

图6 甲壳素标准品电镜扫描图(×3000)Fig.6 SEM photographs of chitin standard substance(×3000)

图7 化学法甲壳素样品电镜扫描图(×3000)Fig.7 SEM photographs of chitin samples from chemical method(×3000)

图8 酶法甲壳素样品电镜扫描图(×3000)Fig.8 SEM photographs of chitin samples from enzyme method(×3000)
2.7 验证实验
向粉碎成20目的虾壳中加入5000U/g的碱性蛋白酶,底物质量浓度为2g/100mL,pH为8.5,于温度60℃保温水解6h,在此条件下,水解率达到78.3%。
3 讨论
一直以来,甲壳素的制备工艺以化学方法为多,化学方法虽然试剂易得,但是存在反应条件剧烈、设备要求高、产品质量差、容易造成环境污染等缺点。而采用酶法脱蛋白可降低试剂的用量,缩短提取时间,效果比化学方法好,而且酶法脱蛋白化学试剂用量少,蛋白质容易回收。后续实验还可以将其中的蛋白质水解为短肽、氨基酸等,将所得水解液经喷雾干燥制成蛋白粉,或者经调配制成虾油。进一步分析虾壳蛋白质水解液的多肽成分和多肽含量也是非常有价值的工作。
如果直接采用凯氏定氮法测定虾壳和虾头中蛋白质是不合理的,因为虾壳中含有大量的甲壳素,而甲壳素中含有丰富的氮,如果直接将其消化后测定,则甲壳素中的氮也被计算到蛋白质中,导致蛋白质测定值严重偏离实际含量。还有一些实验通过甲醛法测定氨基态氮的含量来测定水解度,由于实验过程中要监测体系pH的变化,较为繁琐复杂。因此,本实验首先用凯氏定氮法分别测定虾壳中总氮含量和用化学法制得的甲壳素中总氮的含量,再对酶法制备的甲壳素进行总氮含量的测定,通过1.2.6中的公式进行水解率的计算,从而既避免了甲壳素氮对蛋白质的测定量的影响,又简化了实验步骤。
4 结论
甲壳素是一种资源丰富,而且是存在于自然界中的唯一一种带阳离子能生物降解的高分子材料,甲壳素及其衍生物具有不污染环境、物理化学性质和生物特征优异的特点,在化工、纺织、印染、造纸、医药、环境保护、化妆品等领域都有广泛的应用前景。
本研究表明,酶法去除虾壳中蛋白质的最佳条件为:向粉碎成20目的虾壳中加入5000U/g的碱性蛋白酶,底物质量浓度为2g/100mL,pH为8.5,于温度60℃保温水解6h,在此条件下,水解率达到78.3%。通过扫描电镜分析测试,比较了甲壳素标准品、化学法甲壳素样品和酶法甲壳素样品的电镜扫描照片,可认为本实验采用的由虾壳制备甲壳素的工艺是合理的。
[1]段杉,丁惠心,熊云.酶法回收虾头和虾壳中的蛋白质[J].农产品加工,2008(1):43-46.
[2]蒋挺大.甲壳素[M].北京:化学工业出版社,2003:45-70.
[3]Brine C J,Austin P R.Chitin variability with species and method of preparation[J].Comparative Biochemisty and Physiology,1981,69B:283-286.
[4]Knorr D.Recovery and utilization of chitin and chitosan in food processingwaste management[J].Food Technology,1991,34:114-120.
[5]Jo GH,Jung W J,Kuk J H,et al.Sreening of protease producing Serratia marcescens FS-3 and its application to deproteinization of crab shell waste for chtin extraction[J].Carbohydrate Polymers,2008,74:504-508.
[6]P Charoenvuttitham,J Shi,GS Mittal.Chitin extraction from black tiger shrimp(Penaeus monodon)waste using organic acids[J].Separation Science and Technology,2006,41(6):1135-1153.
[7]姜锡瑞.新编酶制剂应用手册[M].中国轻工业出版社,2002.
[8]GB 5497-85.粮食、油料检验水分测定法[S].
[9]GB 5512-85.粮食、油料检验粗脂肪测定法[S].
[10]GB 5505-85.粮食、油料检验灰分测定法[S].
[11]侯佰立.凡纳滨对虾加工副产物制备甲壳素、壳聚糖改良工艺的研究[D].广东:广东海洋大学,2011(2).
[12]GB 5009.5-2010.食品安全国家标准食品中蛋白质的测定[S].
[13]马家骅,谭承佳,邓霞,等.蜣螂药渣中壳聚糖的回收与初步表征[J].中药材,2012,35(7):4.
[14]刘慧,邓春梅,杨丹,等.虾皮制备壳聚糖的扫描电镜观察[J].广州化工,2010,38(3):119-121.
[15]覃容贵,吴建伟,国果,等.蝇蛆甲壳素的制备技术研究[J].时珍国医国药,2010,21(5):1189-1191.
[16]何兰珍,陈亚胜,杨丹,等.虾壳不同部位制备甲壳素、壳聚糖的研究[J].食品科学,2006,27(12):308-310.
