高温淀粉酶法制备大麦饮料的工艺研究
2013-05-15贾可华马晓军
贾可华,马晓军
(江南大学食品学院,江苏无锡214122)
大麦是世界上最古老和分布广泛的作物之一,其产量居世界谷物的第五位[1]。大麦的营养丰富,在世界上的很多地方都是重要的食物来源。但是大麦面粉中缺少面筋以及可溶性纤维含量较大会导致高保水性,以小麦和稻谷为原料的产品因为能够提供更好的质量和口感,限制了大麦在食品中的应用。近年来大麦的研究越来越多。大麦中含有丰富的膳食纤维,尤其是β-葡聚糖的含量(因为地区差异)能达到2%~9%[2],已经有研究表明可以将β-葡聚糖用作脂肪替代品、稳定剂和增稠剂在食品中使用。
在国内,大麦一般用于啤酒的酿造、饲料的加工以及对其中功能营养因子的提取[3-4]。在大麦食品开发方面主要是大麦茶和麦片,目前还处于较低水平,对大麦的综合利用和深加工程度不够。有关大麦饮料的研究还很少,而且实验采用高温淀粉酶,节省了采用中温淀粉酶所需要的预糊化时间,节约了生产成本。随着现在液态快速消费品的需求急速增加,大麦饮料作为植物饮料的新品种符合健康生活的发展趋势[5],不仅能够充分保留谷物中对人体健康有益的营养成分,饮用更方便,吸收更容易,而且是解决现代生活中城市居民膳食营养失衡的途径之一。
1 材料与方法
1.1 材料与仪器
大麦 江苏丹绿米业有限公司;耐高温α-淀粉酶 无锡昌而盛贸易有限公司;3.5-二硝基水杨酸 化学纯;四水和酒石酸钾钠、氢氧化钠、苯酚、亚硫酸钠、葡萄糖 均为分析纯。
CFK-30G型长帝调温定时型电烤箱 佛山市伟仕达电器实业有限公司;粉碎机、电动筛 新乡市金禾机械有限公司;DK-S12型电热恒温水浴锅 上海森信实验仪器有限公司;RW20型搅拌器 广州仪科实验室技术有限公司;GZX-GF-MBS-1型电热恒温鼓风干燥箱 上海跃进医疗器械厂;UVmini-1240型紫外分光光度计 岛津制作所;YXQ-LS-18SI型立式压力蒸汽灭菌锅 上海东亚压力容器制造有限公司。
1.2 实验方法
1.2.1 大麦饮料工艺流程 大麦→烘焙→去皮过筛→酶解→离心→调配→均质→灭菌→灌装→成品[6]。
1.2.2 研究方法及操作要点 烘焙:将去杂后的大麦在180℃烘箱中烘烤15min,大麦烤成焦黄色并且伴有大量香气物质溢出。
去皮粉碎:将烘焙好的带壳大麦粉碎后过20目筛去皮,去皮后过40目筛作为制备大麦饮料的原料。酶解:本实验选择酶解温度、酶解时间、加酶量为单因素并且通过响应面来确定最佳的酶解条件。
1.2.3 料水比对原料利用率和总固形物含量的影响相同质量的过40目筛的大麦粉,分别以1∶8、1∶10、1∶12、1∶14、1∶16、1∶18的比例加入自来水,在加酶量为50U/g,酶解温度为80℃,酶解时间为60min的条件下进行酶解。测定原料利用率与总固形物含量。
1.2.4 酶解温度对还原糖含量和总固形物含量的影响 选取料水比为1∶8,加酶量为50U/g,酶解时间为60min,酶解温度分别为70、75、80、85、90、95、100℃下反应,测定还原糖和总固形物含量。
1.2.5 加酶量对还原糖含量和总固形物含量的影响选取料水比为1∶8,酶解温度为90℃,酶解时间为60min,加酶量为20、30、40、50、60、70U/g条件下反应,测定还原糖和总固形物含量。
1.2.6 酶解时间对还原糖含量和总固形物含量的影响 选取料水比为1∶8,酶解温度为90℃,加酶量为50U/g,酶解时间分别为20、30、40、50、60、70、80、90min条件下反应,测定还原糖和总固形物含量。
1.2.7 酶解工艺最优参数的确定 在单因素实验的基础上,以还原糖含量和总固形物含量为评价指标进行研究和分析,并确定三因素三水平响应面分析。实验设计因素水平表见表1。
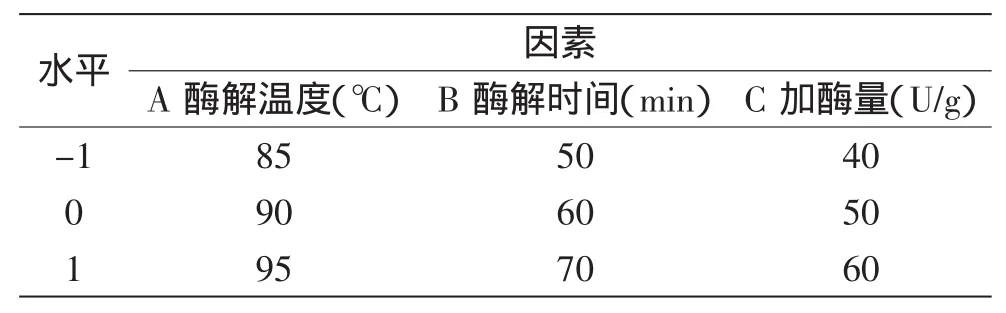
表1 中心组合设计因素水平表Table 1 Variables and levels in central composite design
1.3 分析方法
1.3.1 原料利用率的测定 原料利用率:X(%)=(m1-m2)/m1×100
式中,X—原料利用率;m1—原料大麦的质量/g;m2—残渣重量/g;原料质量和残渣质量均以干重计。
1.3.2 总固形物含量的测定 用105℃恒重法测得,取10mL样液至于平皿中,烘干至恒重。
1.3.3 还原糖含量的测定 3,5-二硝基水杨酸比色法[7]。以还原糖含量为横坐标,吸光值为纵坐标,标准曲线如图1所示。
2 结果与分析
2.1 料水比对原料利用率和总固形物含量的影响
料水比对原料利用率和总固形物含量的影响如图2所示。从图2中可以看出,料水比从1∶18到1∶8的过程中,原料利用率先增加后减小,在料水比为1∶14的时候达到最大值。总固形物的含量一直增加,在料水比为1∶8时最大。从原料利用率来看,料水比1∶14时值最高,达到55%,料水比1∶8时值最小,为45%;从总固形物含量来看,料水比1∶8时值最高,约是料水比1∶14时的两倍。考虑到料水比过大,固形物含量偏低,大麦饮料的风味不足,后续实验采用料水比1∶8。
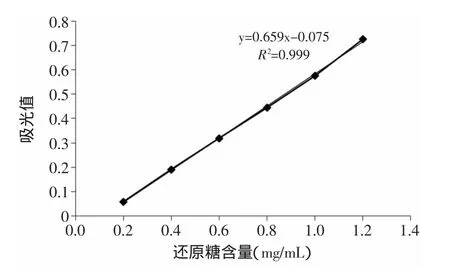
图1 葡萄糖标准曲线Fig.1 The standard curve of glucose
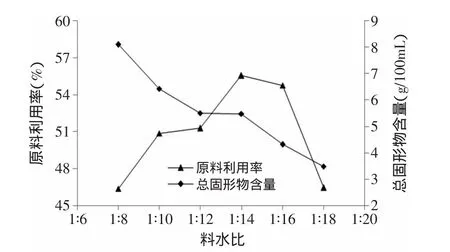
图2 料水比对原料利用率和总固形物含量的影响Fig.2 Effect of solid-liquid ratio on total solid content and utilization rate of raw materials
2.2 单因素实验结果与分析
2.2.1 酶解温度对还原糖和总固形物含量的影响酶解温度对还原糖含量和总固形物含量的影响如图3所示。从图3中可以看出,随着酶解温度的升高,还原糖含量先增加后减少。在酶解温度达到90℃时还原糖的含量达到最高值,温度大于90℃的时候还原糖的含量降低,可能是因为耐高温淀粉酶的最适温度为90℃,温度升高,酶活力减弱,还原糖含量降低。耐高温淀粉酶的最适活力在85~110℃之间,但是因为酶解的时间较长,酶在90℃以下时稳定性较90℃以上好,固形物的含量也是先增加后降低,在温度达到95℃时,含量达到最大值,90℃与95℃时差距很小。因此,实验酶解温度控制在90℃左右[8]。
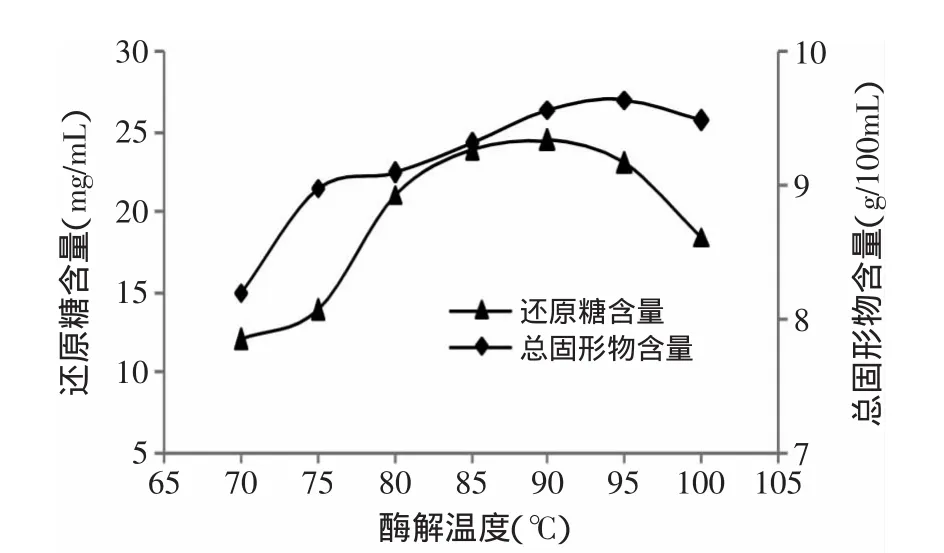
图3 酶解温度对还原糖和总固形物含量的影响Fig.3 Effect of temperature on total solid content and reducing sugar content
2.2.2 加酶量对还原糖和总固形物含量的影响 加酶量对还原糖和总固形物含量的影响如图4所示。从图4中可以看出,加酶量从20U/g增加到50U/g时,还原糖和总固形物含量快速增加,在加酶量大于50U/g的时候,还原糖含量曲线趋于平缓,增加缓慢;总固形物含量在加酶量达到50U/g时,达到最大值。因为当底物浓度达到一定浓度时,底物吸附的酶分子已经饱和,当再增加酶量时,减少单位酶的作用底物,降低淀粉的水解程度。而且增加酶量会增加生产成本,所以加酶量控制在50U/g。
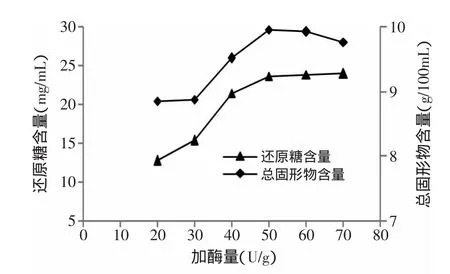
图4 加酶量对还原糖和总固形物含量的影响Fig.4 Effect of enzyme dosage on total solid content and reducing sugar content
2.2.3 酶解时间对还原糖和总固形物含量的影响酶解时间对还原糖和总固形物含量的影响如图5所示。从图5中可以看出随着酶解时间的延长,还原糖和总固形物含量先迅速增加,然后含量基本保持不变。酶解时间达到60min时,还原糖和总固形物含量增加缓慢,为节省生产成本,酶解时间控制在60min。
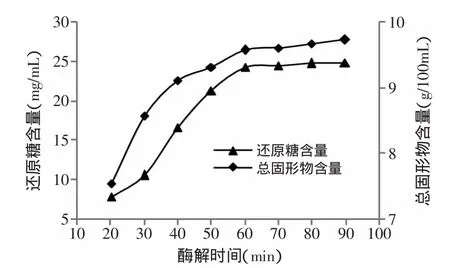
图5 酶解时间对还原糖和总固形物含量的影响Fig.5 Effect of hydrolysis time on total solid content and reducing sugar content
2.3 响应面法酶解条件的优化
在单因素实验的基础上,以文献[9-11]为参考,以还原糖和总固形物含量为响应值,利用响应面优化方法(RSM)中的Box-Behnken分析方法建立模型,对酶解条件进行优化。每组实验重复3次,响应面实验设计和结果如表2所示。
2.3.1 不同因素对还原糖含量的影响 利用Designexpert7.0软件进行分析,以还原糖含量为响应值得到方差分析表,利用软件进行非线性回归的二次多项式拟合,得到的预测模型如下:
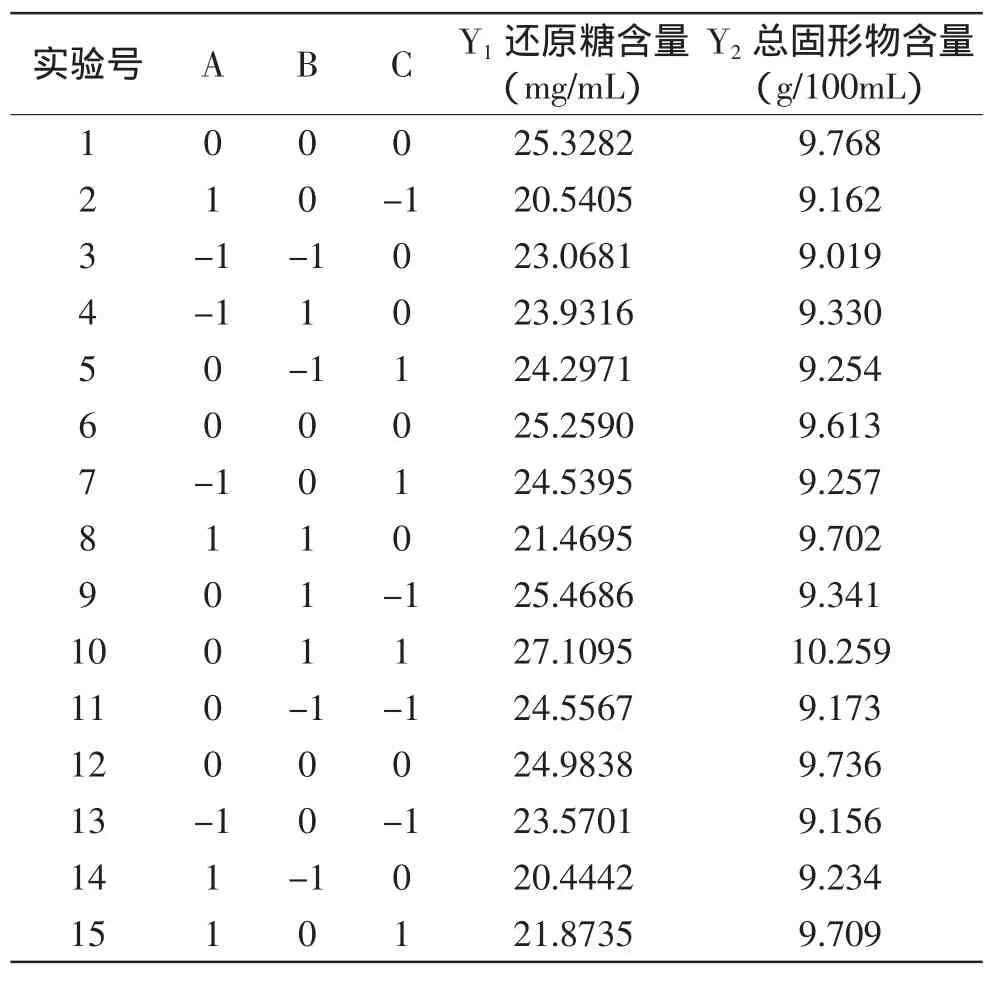
表2 响应面实验设计及结果Table 2 Process variables and levels in response surface central composite design and experimental results
Y1=25.19-1.35A+0.70B+0.46C+0.040AB+0.091AC+0.48BC-2.84A2-0.12B2+0.29C2,方差分析结果见表3。
该模型回归显著。R2=0.9878,R2adj=0.9659,说明该模型是可靠的,使用该方程模拟真实的三因素三水平的分析是可行的。由p值可以看出A、B、C、BC、A2对响应值Y1的影响显著,说明实验因子对响应值不是简单的线性关系,一次项、二次项和交互作用都有很大的影响。由表中的F值可以看出FA>FB>FC,说明酶解温度对还原糖含量的影响最大。
2.3.2 响应面图分析 采用Design-Expert 7.0软件根据多元回归拟合分析处理的3个因素对还原糖含量的响应面分析结果见图6~图8。
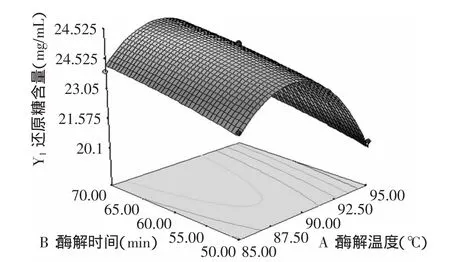
图6 酶解温度与酶解时间对还原糖含量的影响Fig.6 Effect of temperature and hydrolysis time on reducing sugar content
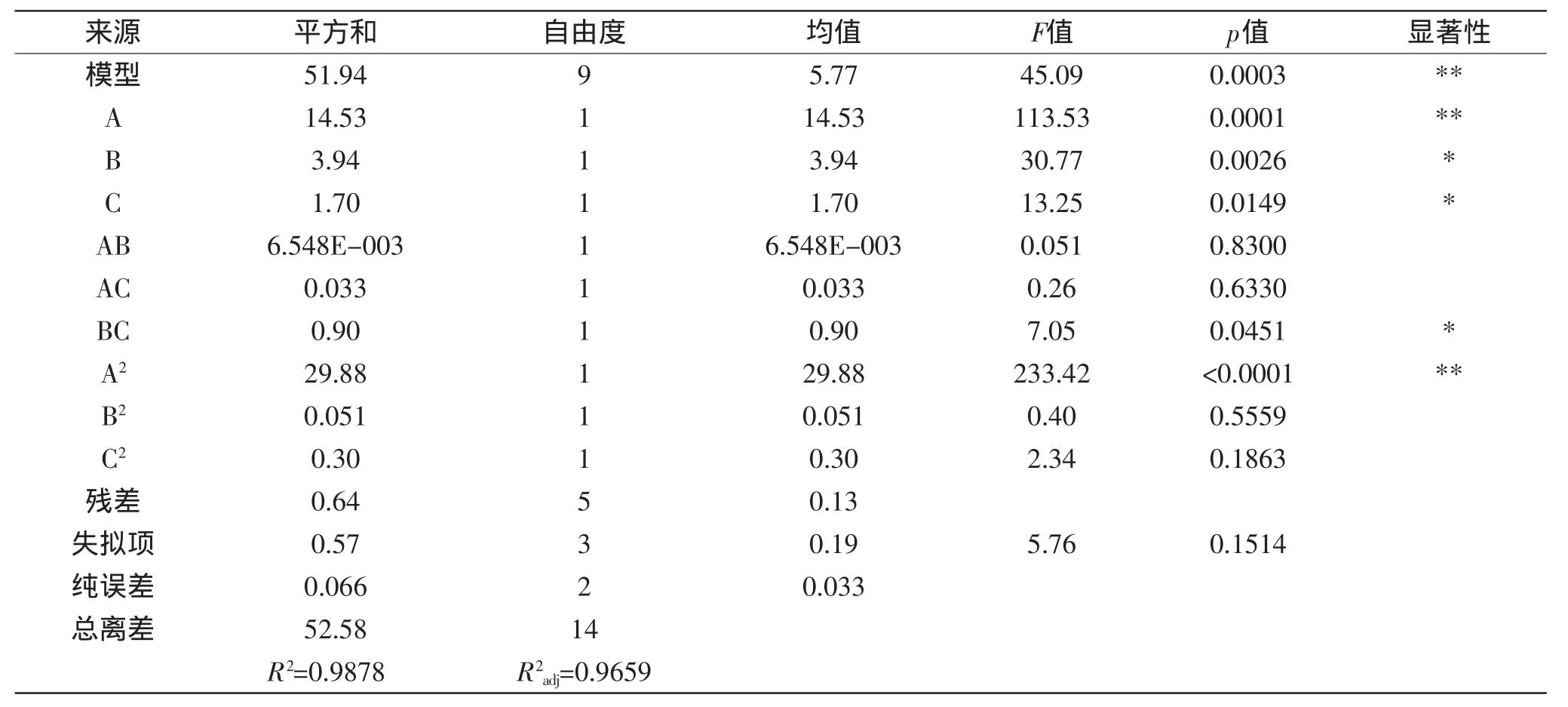
表3 还原糖含量回归方程方差分析表Table 3 Analysis of variance for regression model of reducing sugar content
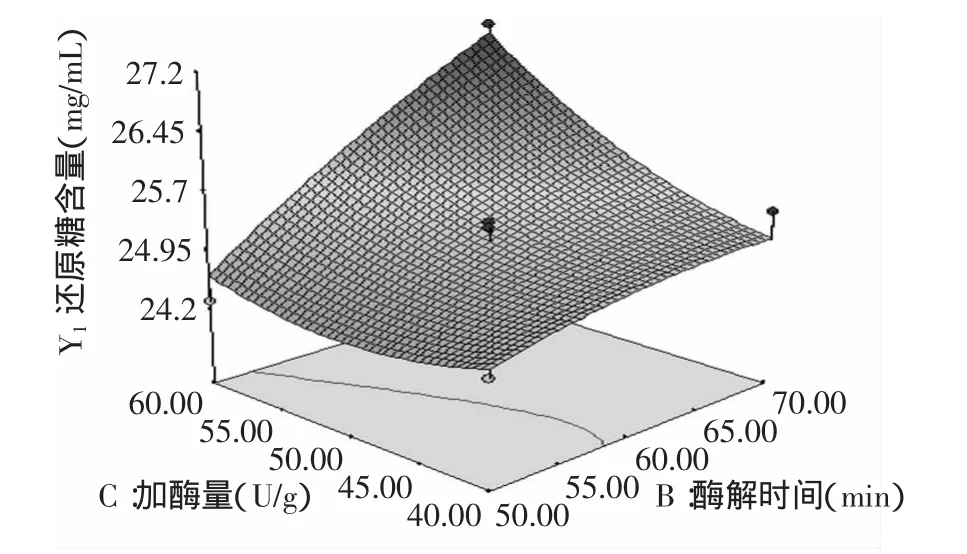
图7 酶解时间和加酶量对还原糖含量的影响Fig.7 Effect of hydrolysis time and enzyme dosage on reducing sugar content
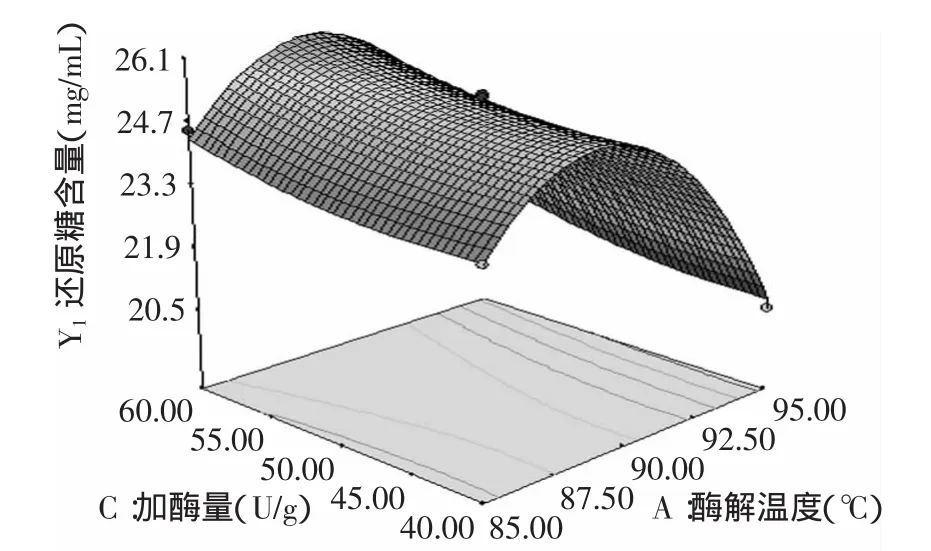
图8 酶解温度和加酶量对还原糖含量的影响Fig.8 Effect of temperature and enzyme dosage on reducing sugar content
由图6可以看出,酶解温度和酶解时间的交互作用不显著,还原糖含量随着酶解时间的增加而增加,随着酶解温度的增加先增加后减少,因此选用酶解时间为70min左右,酶解温度为90℃左右;由图7可以看出,酶解时间和加酶量交互作用显著,还原糖含量随着酶解时间和加酶量的增加而增加,因此选用酶解时间为70min左右,加酶量为60U/g左右;由图8可以看出,酶解温度和加酶量交互作用不显著,还原糖含量随着加酶量的增加而增加,随着酶解温度的增加先增加后减小,因此选用加酶量为60U/g左右,酶解温度为90℃左右。
2.3.3 不同因素对总固形物含量的影响 利用Design-expert7.0软件进行分析,以总固形物含量为响应值得到方差分析表,利用软件进行非线性回归的二次多项式拟合,得到的预测模型如下:
Y2=9.71+0.13A+0.24B+0.21C+0.039AB+0.11AC+0.21BC-0.29A2-0.099B2-0.100C2,方差分析结果见表4。
该模型回归显著。R2=0.9681,R2adj=0.9106,说明该模型是可靠的,使用该方程模拟真实的三因素三水平的分析是可行的。由p值可以看出A、B、C、BC、A2对响应值Y2的影响显著,说明实验因子对响应值不是简单的线性关系,一次项、二次项和交互作用都有很大的影响。由表中的F值可以看出FB>FC>FA,说明酶解时间对总固形物含量的影响最大,与影响还原糖含量的次序不同。综合两个考察指标可知,酶解温度、时间和加酶量对酶解条件均有很大的影响。
2.3.4 响应面图分析 采用Design-Expert 7.0软件根据多元回归拟合分析处理的3个因素对固形物含量的响应面分析结果见图9~图11。
由图9可以看出,酶解温度和酶解时间的交互作用不显著,总固形物含量随着酶解时间的增加而增加,随着酶解温度的增加先增加后降低,因此选用酶解时间为70min左右,酶解温度为90℃左右;由图10可以看出,酶解时间和加酶量交互作用显著,总固形物含量随着酶解时间和加酶量的增加而增加,因此选用酶解时间为70min左右,加酶量为60U/g左右;由图11可以看出,酶解温度和加酶量交互作用不显著,总固形物含量随着加酶量的增加而增加,随着酶解温度的增加先增加后减小,因此选用加酶量为60U/g,酶解温度为90℃。
2.3.5 酶解条件的确定 三个因素中对还原糖含量影响大小顺序为:酶解温度>酶解时间>加酶量,对总固形物含量影响大小顺序为:酶解时间>加酶量>酶解温度。综合考虑两个响应值,利用Designexpert 7.0软件进行最优条件的选择,选择条件为酶解温度90.12℃,酶解时间为70min,加酶量为60U/g。预测的固形物含量为10.177g/100mL,还原糖含量为26.9401mg/mL。为方便操作,实验中酶解温度为90℃,经过验证实验,得到还原糖含量平均值为27.2445mg/mL,总固形物含量平均值为10.334g/100mL。
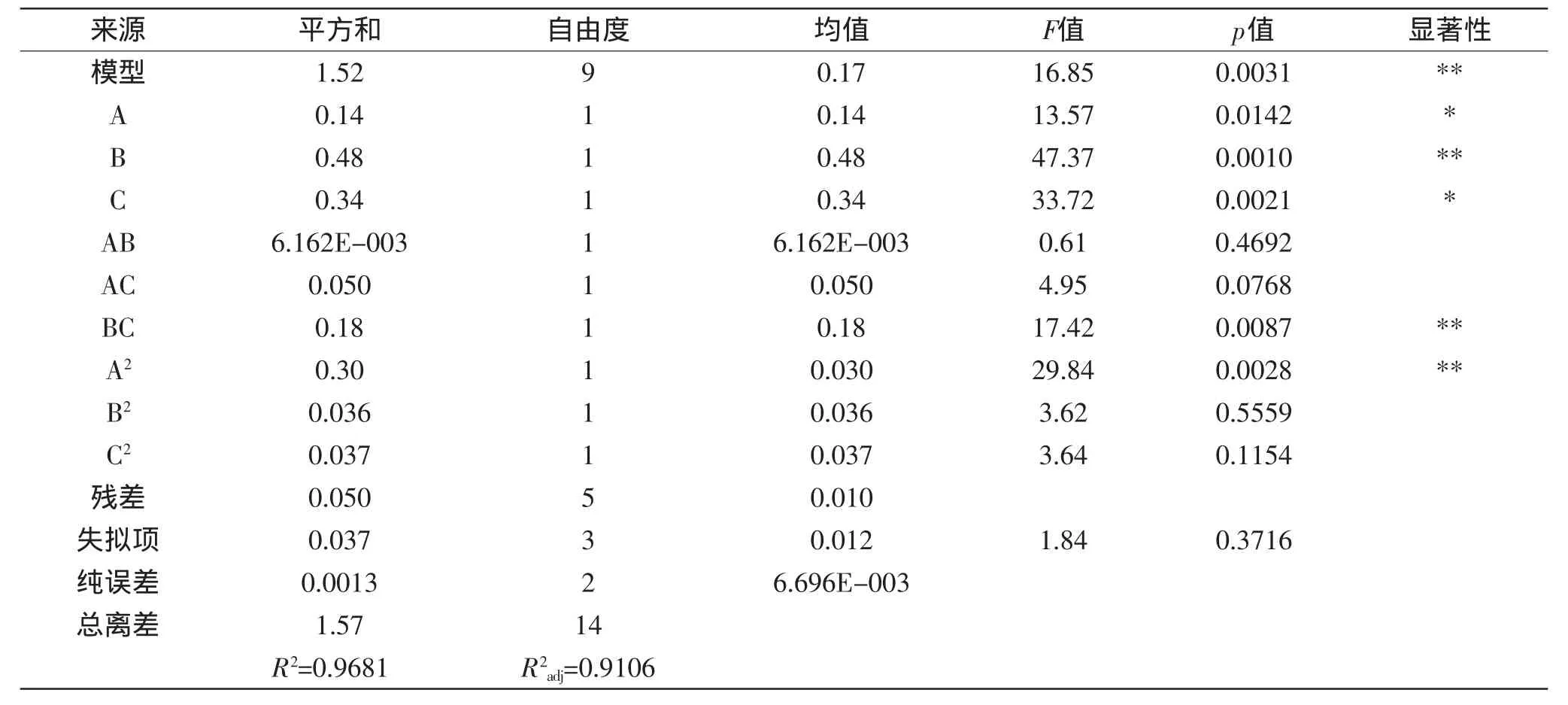
表4 总固形物含量回归方程方差分析表Table 4 Analysis of variance for regression model of total solid content
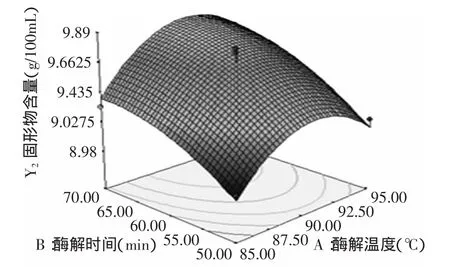
图9 酶解温度和酶解时间对固形物含量的影响Fig.9 Effect of temperature and hydrolysis time on total solid content
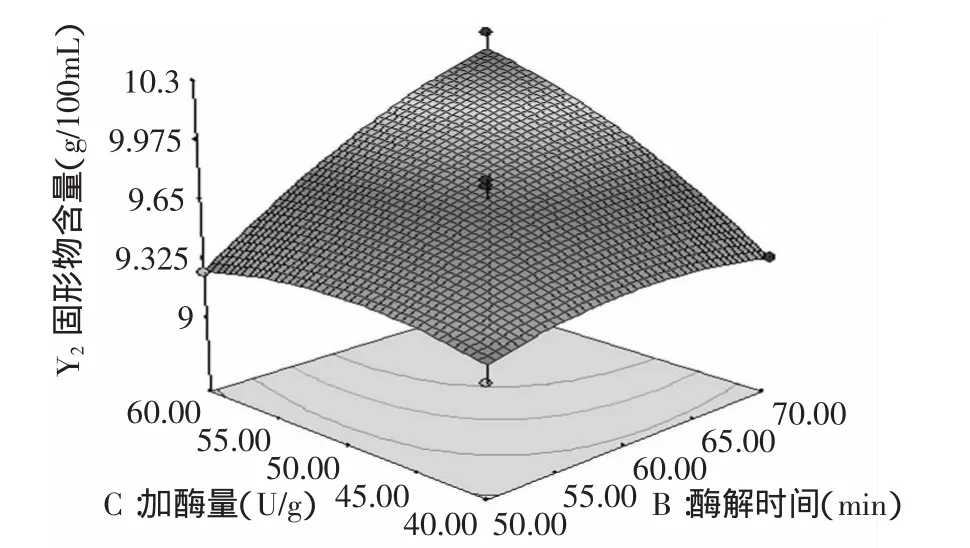
图10 酶解时间和加酶量对固形物含量的影响Fig.10 Effect of hydrolysis time and enzyme dosage on total solid content
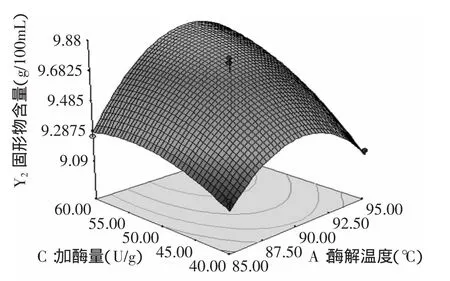
图11 酶解温度和加酶量对固形物含量的影响Fig.11 Effect of temperature and enzyme dosage on total solid content
3 结论
本研究以大麦为原料,采用高温淀粉酶制备大麦饮料,在料水比为1∶8的条件下,以还原糖含量和总固形含量为工艺指标,通过响应面分析得到酶解的最优条件为:酶解温度90℃,酶解时间70min,加酶量60U/g。与文献[10]与[12]得到的酶解条件基本符合,但因为原料的不同,酶解时间与加酶量会有稍许不同;与文献[9]的差异较大,原因是文献[9]中所用的酶为中温淀粉酶,原料的预处理也不相同。目前关于大麦饮料的研究报道比较少,本文为大麦饮料的开发提供理论依据。
[1]Byung-Kee Baik,Steven E Ullrich.Barley for food:Characteristics,improvement,and renewed interest[J].Journal of Cereal Science,2008,48:233-242.
[2]Zhang Guoping,Wang Junmei,Chen Jinxin.Analysis of βglucan content in barley cultivars from different locations of China[J].Food Chemistry,2002,79:251-254.
[3]袁亚,周利亘,龚启明,等.大麦麦绿素提取技术研究[J].食品工业科技,1999,20(2):26-29.
[4]陈红歌,赵玮莉,赵柏叶,等.从脱壳大麦中提取和纯化β-葡聚糖的研究[J].食品与发酵工业,2005,31(2):45-47.
[5]程朝阳,莫树平,柏建玲,等.我国谷物饮料研究进展与生产概况[J].饮料工业,2012,15(6):6-9.
[6]李建磊,陆淳,王东泽,等.燕麦谷物饮料的研制[J].食品科技,2012,37(3):178-181.
[7]苟琳,单志.生物化学实验[M].成都:西南交通大学出版社,2010.2:57.
[8]涂清荣.米乳饮料的制备及其稳定性的研究[D].无锡:江南大学,2005.
[9]夏肖肖,张晖,齐希光,等.大麦饮料制备工艺的研究[J].粮食与饲料工业,2012(10):18-21.
[10]郭晓娜,张少兵,张晖,等.燕麦乳饮料制备工艺研究[J].粮食与油脂,2011(7):44-46.
[11]张勤良,王璋,许时婴.酶法生产速溶焦大麦饮料的工艺条件[J].食品与发酵工业,2005,31(1):152-156.
[12]徐康,傅亮,孙颖莺,等.酶法制备燕麦乳饮料的工艺研究[J].食品与机械,2009,25(4):138-140.
