海参皂苷对自发性糖尿病小鼠的降血糖作用
2013-05-15王佳慧刘丰海王玉明薛长湖
温 敏,王佳慧,刘丰海,王玉明,薛长湖,薛 勇,*
(1.中国海洋大学食品科学与工程学院,山东青岛266003;2.青岛市市立医院检验科,山东青岛266003)
糖尿病是一种糖代谢紊乱疾病,可分为Ⅰ型糖尿病和Ⅱ型糖尿病,后者在糖尿病患者中约占90%,主要表现为高血糖、高胰岛素血症及胰岛素抵抗。因此,控制血糖是预防和治疗糖尿病的有效方法[1]。研究发现,通过抑制α-糖苷酶的活性以延缓葡萄糖的吸收是控制餐后血糖升高的有效途径[2]。目前,市售的阿卡波糖、伏格列波糖等α-糖苷酶抑制剂类药物已经在临床得到广泛利用,但是它们存在着一些副作用,如腹泻、腹胀、胀气和轻度皮疹等[3]。已有较多的研究表明,食物中也存在着能够抑制α-糖苷酶活性的功效成分。对于存在糖耐异常,但未达到糖尿病诊断标准的人群来说,通过摄取食品功效成分抑制餐后血糖的升高是预防糖尿病的有效方法。海参,是我国传统的保健食品,研究者发现其含有多种生物活性物质。海参皂苷是海参体内所特有的一类三萜皂苷,在海参的体壁、内脏和腺体等组织中均有分布。目前关于海参皂苷抗肿瘤[4]、抑菌[5]、免疫调节[6]和减肥[7]等方面的研究多有报道。但鲜有海参皂苷对于糖代谢影响的研究。本研究分别从海参皂苷对α-糖苷酶及淀粉酶的体外抑制活性和对糖尿病小鼠糖代谢的影响两方面进行探讨,进一步为海参皂苷的开发应用提供理论依据。
1 材料与方法
1.1 材料与仪器
C57BL/KsJ(db/db)小鼠共计12只 SPF级,雄性,体重20~25g;C57BL/KsJ小鼠 5只,SPF级,雄性,体重18~22g,购自南京青紫兰;雄性Wistar大鼠 4只,SPF级,100~120g,购自青岛药检所;酵母α-1,4-糖苷酶、4-硝基苯-α-D-吡喃葡萄糖苷(PNPG)、猪胰α-淀粉酶 美国Sigma公司;阿卡波糖(acarbose) 拜耳医药保健有限公司;DNS(3,5-二硝基水杨酸)、可溶性淀粉 国产分析纯;葡萄糖酶法测定试剂盒 北京中生北控生物科技股份有限公司;胰岛素ELISA试剂盒 美国R&D公司。
721型分光光度计 上海精密科学仪器有限公司;JY92-IIN型超声波细胞粉碎机 宁波新芝生物科技股份有限公司;电热恒温水浴锅 国华电器有限公司HH4;CP100MX型-离心机 日本日立公司;Model680型-酶标仪 美国Bio RAD公司;
1.2 实验方法
1.2.1 海参皂苷的制备 海参干粉在室温下以60%的乙醇浸提,浸提液减压浓缩后得浸提膏,以水饱和正丁醇萃取浸提膏,正丁醇部分减压浓缩后蒸干,过大孔树脂纯化的海参皂苷[8]。
1.2.2 大鼠小肠α-糖苷酶的提取 雄性Wistar大鼠乙醚麻醉,剪取整段小肠,在冷的0.9%生理盐水中反复冲洗三次,剖开肠腔,以0.9%的生理盐水冲洗,用载玻片轻轻刮取小肠内表面,将刮取物与冷的0.1mol/L磷酸盐缓冲液(pH6.8)按照1∶10混匀,冰浴匀浆2min,匀浆液10000r/min离心(4℃)30min,取上清液,分装后-20℃保存备用[9]。
1.2.3 酵母α-糖苷酶、鼠肠α-糖苷酶活性测定 配制20mmol/L的底物PNPG(对硝基苯酚葡萄糖酯)和酶(酵母α-糖苷酶、鼠肠α糖苷酶)液。反应体系为200μL,于各离心管中加入以磷酸盐缓冲液(0.1mol/L,pH6.8),然后加不同浓度的海参皂苷溶液140μL(或10μL),使各管海参皂苷浓度分别为(0、0.02、0.04、0.06、0.1mg/mL),再加入20μL酵母α-糖苷酶(或180μL鼠肠α-糖苷酶)液混匀,37℃水浴5min。加入40μL(或10μL)20mmol/L PNPG(对硝基苯酚葡萄糖酯)为底物,于37℃水浴中反应15min后,以1mL 0.1mol/L的Na2CO3终止反应,于405nm处比色[10]。
1.2.4 海参皂苷对酵母-α糖苷酶抑制作用类型的确定 参照文献[11]方法,海参皂苷溶液浓度分别为0、0.06、0.1mg/mL,底物PNPG体系终浓度为0.1、0.3、0.5、0.8、1.0mg/mL。按照1.2.2方法,以底物浓度的倒数(1/[S])为横坐标,以反应初速度对应的吸光度的倒数(1/OD)为纵坐标双倒数法作图,判断海参皂苷对酵母α-糖苷酶的抑制类型。
1.2.5 对α-淀粉酶的抑制作用 参照文献[12]反应体系加入100μL海参皂苷溶液或阿卡波糖溶液200μL猪胰α-淀粉酶、2mmol/L磷酸盐缓冲液(pH6.9)200μL,混匀后37℃水浴15min,再加入1%可溶性淀粉100μL,37℃水浴反应5min,向各管分别加入500μL DNS显色剂,沸水浴5min,冰浴冷却后稀释至5mL,于540nm比色。
抑制率(%)=(A1-A2)/A1×100
式中A1、A2分别代表无抑制剂和有抑制剂时的吸光值。
1.2.6 动物分组 实验动物分为三组,雄性C57BL/KsJ(db/db)分为模型组和皂苷组(每组6只)。C57BL/KsJ小鼠为正常对照组(5只),实验饲料根据标准AIN-76配方配制,模型组和对照组喂正常实验饲料,皂苷组在实验饲料中添加0.07%的海参皂苷,喂养4周后,进行葡萄糖耐量的测定,喂养5周后,取全血,测空腹血糖和胰岛素。
1.2.7 葡萄糖耐量、空腹血糖及血胰岛素的测定 实验前禁食不禁水10h,按照2.5g/kg体重灌胃葡萄糖,分别于灌胃后0、30、60和120min后尾静脉取血,利用葡萄糖氧化酶试剂盒测定各时间点的血糖浓度,评价葡萄糖耐量。空腹血清胰岛素水平采用ELISA胰岛素试剂盒测定。
1.2.8 统计学分析 数据分析采用SPSS11.0软件进行单因素方差分析,以p<0.05为具有统计学意义上的差异。
2 结果与分析
2.1 海参皂苷对α-糖苷酶活性的影响
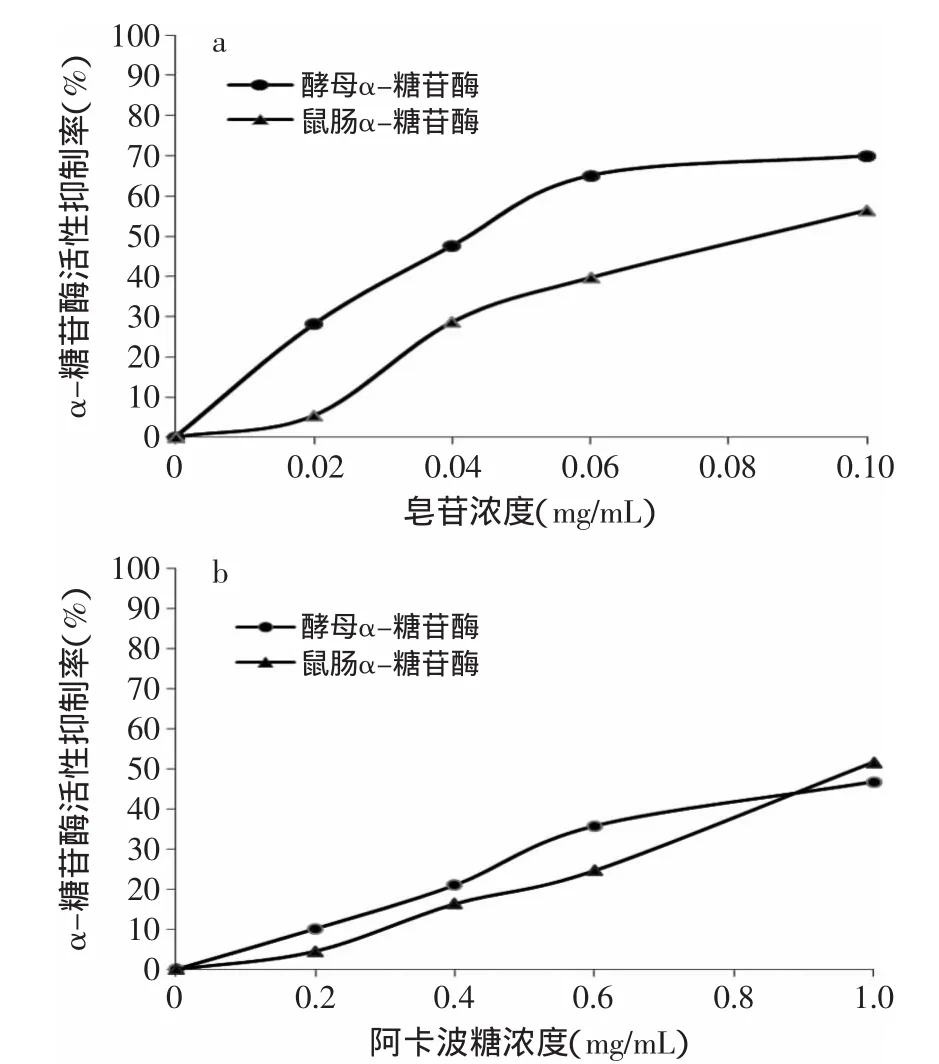
图1 皂苷、阿卡波糖对酵母α-糖苷酶及对鼠肠α-糖苷酶的抑制作用Fig.1 Inhibition of sea cucumber saponin and acarbose on the α-glycosidase of yeast and rat intestinal
由图1(a,b)可以看出海参皂苷可显著抑制酵母α-糖苷酶的活性,IC50为0.042mg/mL;且对酵母α-糖苷酶的抑制作用优于阳性对照阿卡波糖(IC50为1.062mg/mL)。对比图1(a,b)可知海参皂苷对鼠肠α-糖苷酶的抑制作用明显低于阳性对照阿卡波糖。
2.2 海参皂苷对酵母-α糖苷酶抑制作用类型的确定
对海参皂苷抑制酵母α-糖苷酶的作用类型进行酶促动力学分析,结果如图2所示。在以对PNPG(硝基苯酚葡萄糖酯)为底物的酵母α-糖苷酶酶促反应中加入2种不同浓度(0.06、0.1mg/mL)的海参皂苷溶液后,α-糖苷酶水解底物PNPG的作用明显被抑制;随着海参皂苷浓度的增大,最大反应速度(Vmax)减小,而表观米氏常数(Km)增大;三条双倒数直线的交点在横轴上,因此推断抑制作用类型属于非竞争性抑制。

图2 海参皂苷对酵母α-糖苷酶抑制作用双倒数曲线Fig.2 Lineweaver-Burk plot of the saponin from sea cucumber against yeast α-glycosidase at different concentrations of pNPG
2.3 海参皂苷对α-淀粉酶活性的影响

图3 海参皂苷和阿卡波糖对猪胰α-淀粉酶的抑制作用Fig.3 Inhibition of sea cucumber saponin and acarbose on porcine pancreatic α-amylase
海参皂苷对α-淀粉酶活性的抑制作用见图3(a)。海参皂苷对α-淀粉酶有一定的抑制作用,但是抑制率均较低。阿卡波糖对α-淀粉酶的抑制作用较强,且呈现明显的剂量关系(IC50为0.004mg/mL),见图3(b)。
2.4 海参皂苷对自发性糖尿病小鼠空腹血糖、胰岛素水平及葡萄糖耐受量的影响
结果如图4(a、b)所示,模型组空腹血糖和空腹胰岛素水平高于正常组,分别高达15.25mmol/mL和4.19ng/mL,模型组灌胃前血糖值及灌服葡萄糖后各时间点血糖值均明显高于正常组,已形成Ⅱ型糖尿病。喂食海参皂苷后,小鼠葡萄糖耐受量明显得到改善(图4c)。实验结束时,海参皂苷组小鼠空腹胰岛素水平、空腹血糖值均显著低于模型组(图4a、b)。由此可见,海参皂苷可降低自发性糖尿病小鼠空腹血糖和空腹胰岛素水平,并改善其糖耐量异常。

图4 海参皂苷对自发性糖尿病小鼠空腹血糖、空腹胰岛素水平及葡萄糖耐受量的影响Fig.4 Effects of sea cucumber saponin on FBG、FINS and Glucose tolerance of saontaneous diabetes mice
3 讨论
Ⅱ型糖尿病症状主要表现为空腹高血糖、餐后高血糖并伴随有胰岛素抵抗。近年来研究发现餐后高血糖是引发糖尿病及其并发症的主要因素,特别是对于Ⅱ型糖尿病人,餐后高血糖对机体造成的危害远远超过空腹高血糖,所以降低餐后高血糖是预防和治疗糖尿病的重要靶点。α-糖苷酶主要分布于小肠上皮绒毛上,膳食中的多糖,如淀粉,经口腔唾液、胰淀粉酶被优先消化为分子量较小的低聚糖,随后α-糖苷酶作用于这些低聚糖的非还原末端,切断α-1,4糖苷键,释放出葡萄糖,葡萄糖被小肠吸收后进入血液循环,变为血糖[13]。α-糖苷酶抑制剂通过对小肠刷状边缘α-糖苷酶活性的可逆性抑制作用,延缓多糖、双糖向葡萄糖的转化,减缓餐后血糖的升高,从而达到防治糖尿病及其并发症的目的[14]。本实验通过体外研究发现,海参皂苷可明显降低α-糖苷酶(酵母α-糖苷酶、鼠肠α-糖苷酶)和猪胰α-淀粉酶的活性,抑制作用与海参皂苷的浓度呈一定的剂量关系。阿卡波糖是临床应用α-糖苷酶抑制剂,对哺乳动物的α-糖苷酶具有很好的抑制作用[15],阿卡波糖对鼠肠α-糖苷酶的抑制效果虽优于海参皂苷,但是在抑制酵母α-糖苷酶活性方面的作用明显低于海参皂苷,这与之前的研究结果相吻合[16]。由此可见,利用微生物源的生物酶对生物活性物质进行筛选或许不尽合理。
本实验采用添加0.07%海参皂苷的饲料喂养C57db/db小鼠,证实海参皂苷可明显抑制口服葡萄糖负荷后血糖的升高,这可能是通过抑制小肠刷状边缘α-糖苷酶的活性,减少葡萄糖的吸收来实现的。同时,海参皂苷还可以改善自发性糖尿病小鼠(C57db/db)的胰岛素抵抗。与模型组相比,海参皂苷组空腹胰岛素水平降低了20%,空腹血糖值降低了24.6%,由此推测,海参皂苷可能通过提高胰岛素的敏感性增加葡萄糖的利用从而控制血糖。
4 结论
本文验证了海参皂苷对自发性糖尿病小鼠的降血糖作用,对其可能的作用机制进行初步探究,发现海参皂苷可体外抑制α-糖苷酶、α-淀粉酶的活性,改善自发性Ⅱ型糖尿病小鼠空腹血糖、空腹胰岛素和胰岛素抵抗,可用于Ⅱ型糖尿病的饮食预防和干预。
[1]The Diabetes Control and Complications Trial Research Group.The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus[J].N Engl J Med,1993,329:977-986.
[2]Lebovitz HE.Alpha-glucosidase inhibitors[J].Endocrinol Metab Clin,1997,26:539-551.
[3]H Bischoff bayer AG.Pharmacology of a-glucosidase inhibition[J].European Journal of Clinical Investigation,1994,24:3-10.
[4]Nguyen Hai Dang,NguyenVan Thanh,Phan Van Kiem,et al.Two new triterpene glycosides from the Vietnamese sea cucumber Holothuria scabra[J].Archives of Pharmacal Reaserch,2007,30(11):1387-1391.
[5]Rajesh Kumar,Ashok Kumar Chaturvedi,Praveen Kumar Shukla,et al.Antifungal activity in triterpene glycosides from the sea cucumber Actinopyga lecanora[J].Bioorganic&Medicinal Chemistry Letters,2007,17(15):4387-4391.
[6]Mamelona J,Pelletier É,Lalancette KG,et al.Quantification of phenolic contents and antioxidant capacity of Atlantic sea cucumber,Cucumaria frondosa[J].Food Chem,2007,104:1040-1047.
[7]胡晓倩,王玉明,任兴兵,等.海参主要活性成分对大鼠脂质代谢影响的比较研究[J].食品科学,2009,30(23):393-396.
[8]于林芳,王超,王玉明,等.大孔树脂纯化革皮氏海参总皂苷工艺[J].食品科学,2011,32(12):1-4.
[9]张素军,瞿伟菁,周淑云.蒺藜皂苷对大鼠小肠α-普通糖苷酶的抑制作用[J].中国中药杂志,2006,3(11):910-913.
[10]Yong-Mu Kim,Youn-Kab Jeong,Myeong-Hyeon Wang,et al.Inhibitory effect of pine extract on α-glucosidase activity and postprandial hyperglycemia[J].Nutrition,2005(21):756-761.
[11]田丽梅,王旻,陈卫.枸杞多糖对α-糖苷酶抑制作用的系列研究[J].中药药理与临床,2005,21(3):23-25.
[12]SangeethaR,VedasreeN.Invitroα-amylaseinhibitoryactivity of the leaves ofthespesia populnea[J].ISRN Pharmacol,2012,3:1-4.
[13]石雪萍,姚慧源.苦瓜皂苷降糖机理研究[J].食品科学,2008,29(2):366-368.
[14]王翼,张旭.α-糖苷酶抑制剂的研究进展[J].海峡药学,2009,21(9):4-6.
[15]Siric hai Adisakw attana,Orathai Ler dsuwan kij,Ubonwan Poputtachai,et al.Inhibitory activity of cinnamon bark species and their comb ination effect with acarbose against intestinalαglucosi dase and pancreatic α-amylase[J].Plant Foods Hum Nutr,2011(66):143-148.
[16]Han Nguyen,Byung Hun Um,Sang Moo Kim.Two unsaturacidswith potentα-glucosidase inhibitory activity purified from the body wall of Sea Cucumber(Stichopus japonicas)[J].Journal of Food Science,2011,76:208-214.
