响应面分析法对α-淀粉酶抑制剂筛选方法的优化
2013-05-15许云青龙盛京
许云青,龙盛京
(广西医科大学药学院,广西南宁530021)
随着世界人口老龄化,糖尿病已经成为一种严重影响健康的常见病、多发病,是继肿瘤、心脑血管疾病之后的第三位杀手。在我国,糖尿病发病率近10年逐年上升,平均每年增加100多万,其中Ⅱ型糖尿病占到90%以上,Ⅰ型糖尿病不到10%[1]。在Ⅱ型糖尿病的治疗中α-淀粉酶抑制剂发挥着重要的作用。α-淀粉酶抑制剂能抑制肠道内唾液、胰淀粉酶的活性,阻碍或延缓人体对食物中主要碳水化合物的水解和消化,降低食物淀粉糖类物质的分解吸收,降低血糖,抑制血糖浓度的升高,从而有利于糖尿病患者的饮食治疗。对于肥胖患者,可减少糖向脂肪转化,延缓肠道排空,增加脂肪消耗以减轻体重[2]。国外已经把α-淀粉酶抑制剂应用在减肥和保健食品上[3]。因此筛选和寻找安全、有效的α-淀粉酶抑制剂仍是药物学家们关注的热点之一。
目前在α-淀粉酶抑制剂的体外筛选实验中,α-淀粉酶的主要来源多为胰α-淀粉酶,胰α-淀粉有着来源不易、成本高等缺点。α-淀粉酶抑制剂测定方法多采用3,5-二硝基水杨酸法,其测定原理:α-淀粉酶抑制剂特异性地抑制α-淀粉酶,减少α-淀粉酶对淀粉水解,使得淀粉降解产物减少,3,5-二硝基水杨酸与还原糖共热后被还原的棕红色氨基化合物减少,在一定波长下吸光度值降低。通过对添加抑制剂前后生产还原糖的量进行定量测定,可从前后变化测得α-淀粉酶抑制剂的活性[4]。在Bemfeld法[5]测定α-淀粉酶活性中,要求调整抑制剂及α-淀粉酶液浓度使得A值在0.4~0.7之间,范围较窄,不利于比较不同抑制剂活性及量效关系。本实验以工业α-淀粉酶代替胰α-淀粉酶,运用响应面分析法对原有的Bemfeld法进行优化设计,优化后的方法稳定可靠、实用,可运用于α-淀粉酶抑制剂的筛选。
1 材料与方法
1.1 材料与仪器
α-淀粉酶 天津福辰试剂厂,批号:20120502,酶活力单位1000~2000U/mg;可溶性淀粉 天津市大茂化学试剂厂;阿卡波糖 规格:每片50mg,拜耳医药保健有限公司,批号:H19990205;3,5-二硝基水杨酸 成都科龙化学试剂厂,批号:20120701;磷酸氢二钠、磷酸二氢钠、氢氧化钠、丙三醇 均为国产分析纯;药材水提物 待测样品,笔者自提;α-淀粉酶液 用0.2mol·L-1磷酸缓冲液配制,现配现用;可溶性淀粉液 用0.2mol·L-1磷酸缓冲液配制,现配现用;3,5-二硝基水杨酸试液 取3,5-二硝基水杨酸6.5g,加入325mL的2mol·L-1氢氧化钠和45mL丙三醇,加蒸馏水至1000mL,溶解,室温存放备用。
紫外可见分光光度计、扭力托盘天平 上海精密科学仪器有限公司;pH计 梅特勒-托利多仪器有限公司;漩涡混合器 江苏海门麒麟医用仪器厂;超声仪 昆山市超声仪器有限公司;不锈钢电热恒温水浴 北京市医疗设备厂。
1.2 实验方法
1.2.1 a-淀粉酶活性测定体系的测定方法 α-淀粉酶活性的测定采用Benfield法[5]:总反应体系为1mL[6]。取0.2mL α-淀粉酶于试管中,加入0.4mL可溶性淀粉液,加入0.4mL磷酸缓冲液(测定抑制率时为0.2mL样品液+0.2mL磷酸缓冲液),充分混匀,置于50℃水浴中孵化30min后,加入6.5g·L-1的3,5-二硝基水杨酸显色剂3.0mL,混匀,于沸水浴中反应10min,室温冷却,取其反应液0.5mL,加入蒸馏水4.5mL,混匀。在紫外可见分光光度计520nm波长下测定吸光度值。酶的抑制率按下式计算:

1.2.2 影响α-淀粉酶活性的单因素考察 α-淀粉酶的活性测定的影响因素主要为pH、底物浓度、酶浓度、酶与底物浓度的比例、温度、金属离子等,影响酶活性的金属离子较多,本文在此不做研究,主要对pH、底物浓度、酶浓度、酶与底物浓度比例、温度进行探讨。本次实验所用α-淀粉酶的最适温度为50~70℃,因此在最终确定孵化温度之前所用的孵化温度均为50℃。
1.2.2.1 缓冲体系pH的确定 配制pH范围为5.8~7.6的磷酸盐缓冲体系,10g·L-1的α-淀粉酶液及2%可溶性淀粉液用蒸馏水配制。按1.2.1α-淀粉酶活性的测定方法,测定α-淀粉酶在此pH范围的活性变化。
1.2.2.2 α-淀粉酶浓度的选择 用1.2.2.1中确定的0.2mol·L-1pH6.6的磷酸缓冲液配制浓度为0.1、0.2、0.4、1.0、2.0、4.0、6.0、8.0、10.0g·L-1的α-淀粉酶溶液,然后各取0.2mL,再用0.2mol·L-1pH6.6磷酸缓冲液补充至1mL,混匀。按1.2.1方法,测定A520nm的值,绘制曲线。
1.2.2.3 可溶性淀粉浓度的选择 用0.2mol·L-1pH6.6的磷酸缓冲液配制含0.1、0.2、0.4、1.0、2.0、4.0、6.0、8.0、12.0、14.0、15.0、16.0、18.0、20.0g·L-1的可溶性淀粉液,然后各取0.4mL,再用0.2mol·L-1pH6.6磷酸缓冲液补充至1mL,混匀。按1.2.1方法测定A520nm,绘制曲线。
1.2.2.4 体系中α-淀粉酶与可溶性淀粉比例的确定在1.2.2.2中确定1mL反应体系中α-淀粉酶的终浓度为10g·L-1后,按照1.2.1的操作方法考察不同浓度淀粉液对酶活性测定中A值范围的影响。
(1)加强对品管圈护理人员与患者的教育与知识宣传,向患者讲解内瘘穿刺的原理方法以及在穿刺时对患者的要求,并鼓励家属共同参与,提高护理人员及患者对内瘘穿刺点渗血的认识,以达到减少并尽量避免动静脉内瘘穿刺点渗血的效果。
1.2.2.5 孵化温度的确定 用0.2mol·L-1pH6.6的磷酸缓冲液配制浓度为10g·L-1α-淀粉酶液及2%可溶性淀粉液。按照1.2实验操作方法测定不同孵化温度对酶活性的影响。
1.2.3 采用响应面法优化α-淀粉酶活性的测定 根据Box-Benheken中心组合实验原理,综合各单因素对α-淀粉酶活性影响的大小,最终选择酶-淀粉比例、缓冲pH、孵化温度
3个因素,以测定的吸光度值为响应值,在单因素实验的基础上,最终确定A(酶-淀粉比例)、B(缓冲pH)、C(孵化温度)的水平值,响应面分析的因素与水平表见表1。
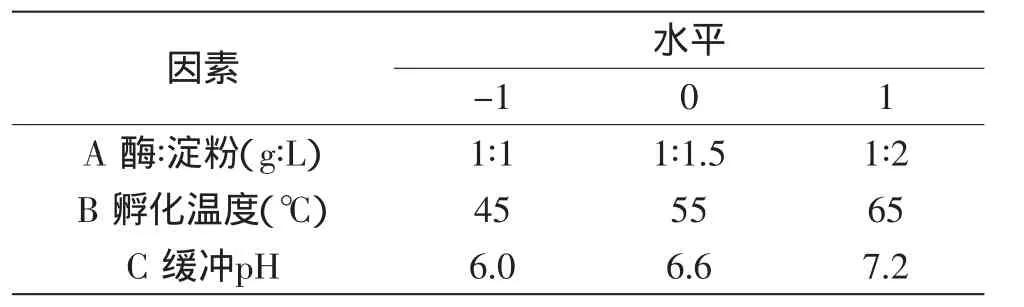
表1 响应面分析的因素与水平表Table 1 Factors and levels of response surface method
1.2.4 中药水提物对α-淀粉酶活性影响 取中药材粉末10.00g,加入100mL蒸馏水,95℃水浴提取30min,过滤,残渣加入80mL蒸馏水,95℃水浴提取30min,过滤,残渣加入60mL蒸馏水,95℃水浴提取30min,过滤,合并三次滤液,定容至250mL,取实验用量离心,作为待测液。在选定最佳条件下,按照1.2.1实验方法,在1mL反应体系中测定待测液对α-淀粉酶的抑制作用。
2 结果与讨论
2.1 单因素考察
2.1.1 磷酸缓冲体系pH的确定 体系的pH对酶活力影响较大,通常在最佳pH下,酶相对比较稳定,在此条件下反应能最大程度发挥酶的活力,提高酶反应效力。从图1的结果得出,pH在6.2~6.6区段α-淀粉酶活性基本保持不变,pH6.8后,随pH增大,酶活性减小。所以选取pH为6.6左右。

图1 α-淀粉酶活性与pH的关系Fig.1 The relationship between α-amylase and pH
2.1.2 α-淀粉酶浓度的选择 1mL反应体系中,加入浓度为0.1~10g·L-1α-淀粉酶,结果表明,不同浓度的α-淀粉酶对反应体系的影响不大,吸光度值在0.055~0.06微小范围内变化。本实验所用的α-淀粉酶活单位为1000~2000U/mg,活性较低,为保证整个反应系统的完全反应,本实验选择α-淀粉酶的浓度为10g·L-1。
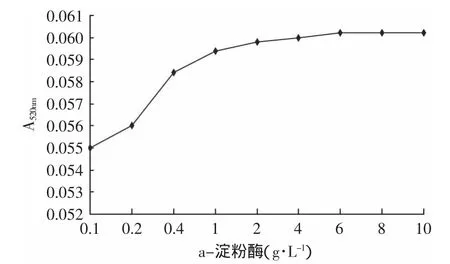
图2 不同浓度α-淀粉酶对系统本底A值的影响Fig.2 Effect of different α-amylase content on A520nm
2.1.3 可溶性淀粉浓度的选择 1mL反应体系中,加入可溶性淀粉浓度为0.1~20.0g·L-1,结果表明淀粉浓度对系统A值影响较大,随淀粉浓度增大吸光度值增大。

图3 不同浓度淀粉对系统本底A值影响Fig.3 Effect of different starch content on the absorbance at 520nm
2.1.4 体系中α-淀粉酶与可溶性淀粉比例的考察 在无α-淀粉酶抑制剂存在时,系统反应A值在0.8~1.4范围有利于抑制剂活性强弱的比较。所以本实验选择A值在1.2左右时的淀粉浓度(15g·L-1)。在1mL反应体系中确定α-淀粉酶和可溶性淀粉的浓度比为1∶1.5左右。
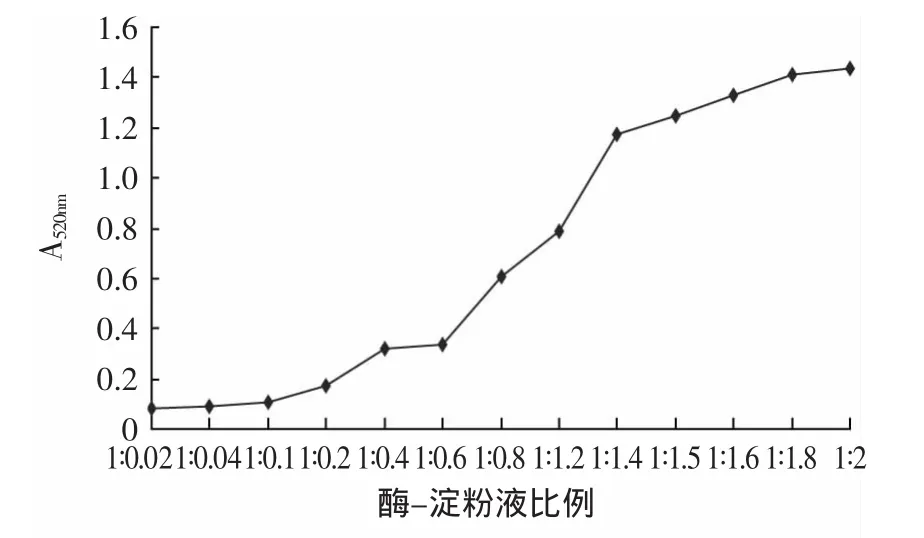
图4 酶-淀粉液不同比例对反应体系A值影响Fig.4 Effect of different the proportion of the enzyme starch solution on the absorbance at 520nm
2.1.5 孵化温度对α-淀粉酶活性的影响 酶的活性受温度影响较大,实验结果显示孵化温度为55~60℃时,温度对酶活性的影响基本保持不变,温度大于60℃后,随温度增加体系A值减小。温度太低或太高,均对α-淀粉酶活性不利,本实验选取中间温度即55℃左右。
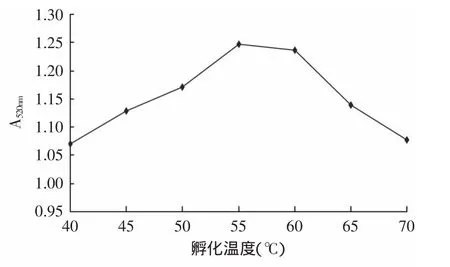
图5 不同孵化温度下反应体系A520nmFig.5 Effect of different temperature on A520nm
2.2 响应面分析结果
2.2.1 响应面设计方案 响应面实验设计结果及分析见表2。

表2 响应面分析实验结果Table 2 Results of response surface central composite design
2.2.2 回归方程和方程分析 Box-Behnken实验拟合出的回归方程为:
Y=-5.2286+0.2468A+0.017B+0.013C+0.02AB-0.018AC+0.0045BC+0.053A2-0.095B2-0.023C2
回归方程各项的方差分析见表3。
由表3可知,用上述回归方程描述各因素与响应值之间的关系时,因变量和全体自变量之间的线性关系显著(r=模型平方和/总离差平方和[7],即r=0.9904),模型的显著水平小于0.0001,说明此模型是高度显著的,该实验方法是可靠的。从回归方程各项的方差分析可以看出,方差的失拟项较小,而且不显著,表明该方程对实验结果拟合良好,实验结果误差小,因此可用该回归方程代替实验真实点对实验结果进行分析和预测。从显著性可以看出,α-淀粉酶与可溶性淀粉比例对α-淀粉酶活性的影响最为显著。
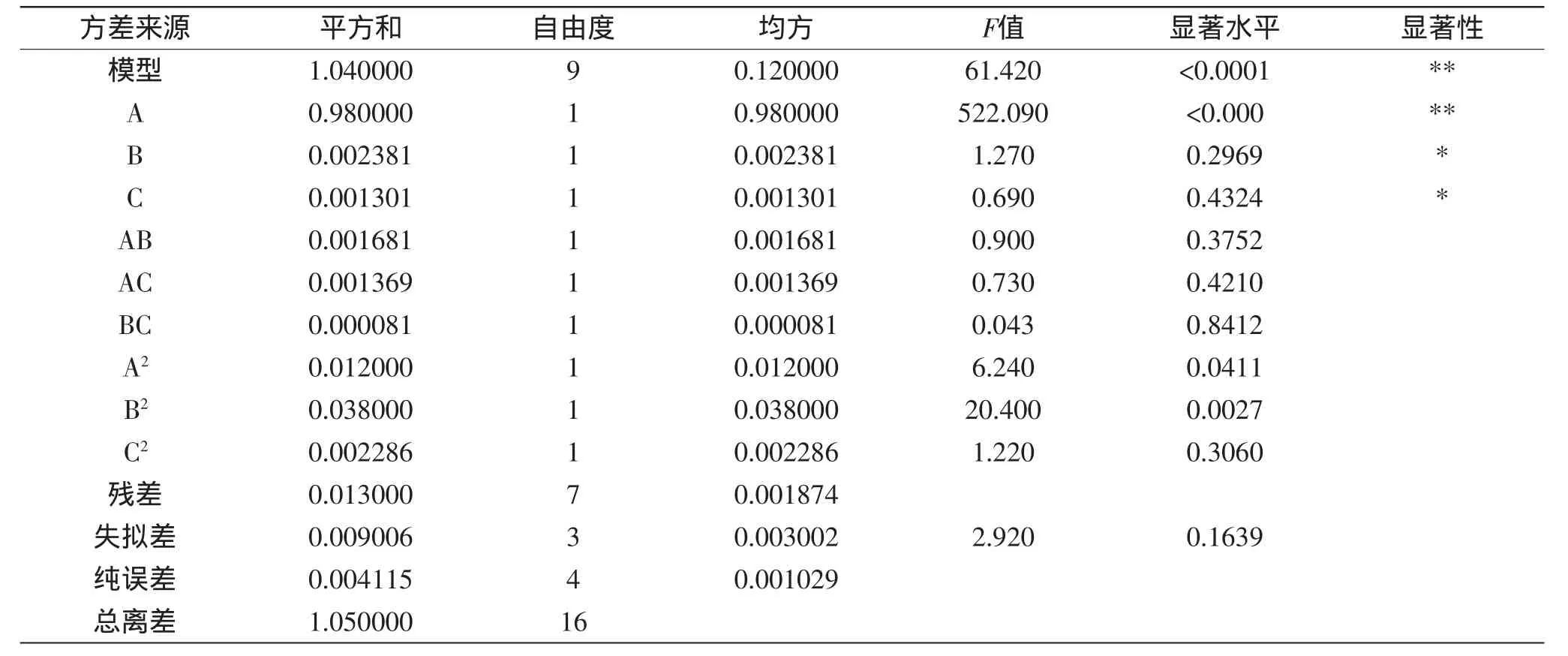
表3 回归模型方差分析Table 3 ANONA(analysis of variance)of terms of regression equation
2.2.3 响应面图分析 RSM方法图形是特定的响应面Y值对应的因素A、B、C构成的一个三维空间在二维平面上的等温图,可以直观地反应各因素对响应面值的影响,从实验所得的响应面分析图上可以找到其在反应过程中的相互作用[8]。回归响应面曲线见图6。
图6直观反映了各因素对响应值的影响,比较可知:酶-淀粉比例对α-淀粉酶的活性影响大,表现为曲线较陡。各因素的交互作用不显著。
预测最优条件:pH6.54、孵化温度55.94℃、酶-淀粉比例1∶2,吸光度值达1.69,考虑到操作便利,α-淀粉酶活性测定选取pH6.6,孵化温度55℃,酶-淀粉比例1∶2。按照此条件平行三次验证实验,得到平均吸光度值为1.63,与预测值(1.69)基本相符合。酶-淀粉比值为1∶2时,吸光度值大于1.4,不利于抑制活性强弱比较,所以选择次优值,控制吸光度值在1.2左右。由于酶-淀粉比例对α-淀粉酶活性影响最大,最终选取酶-淀粉比例为1∶1.5,此时的预测值为1.259。选定pH6.6、孵化温度55℃、酶-淀粉比例1∶1.5测定吸光度值,平行三次实验,平均结果为1.222,与预测值(1.259)基本相符。且此吸光度值利于在比色测定时抑制剂对α-淀粉酶抑制作用的分辨。最终选择条件磷酸缓冲液pH6.6、孵化温度55℃、酶-淀粉比例1∶1.5。
2.2.4 中药材水提物对α-淀粉酶活性影响 结果见表4。实验表明黄芪对α-淀粉酶有明显抑制作用,牛蒡子、桑寄生、玄参、乌梅、鸡血藤对α-淀粉酶无明显抑制作用。6种药材对α-淀粉酶抑制作用均小于阿卡波糖。
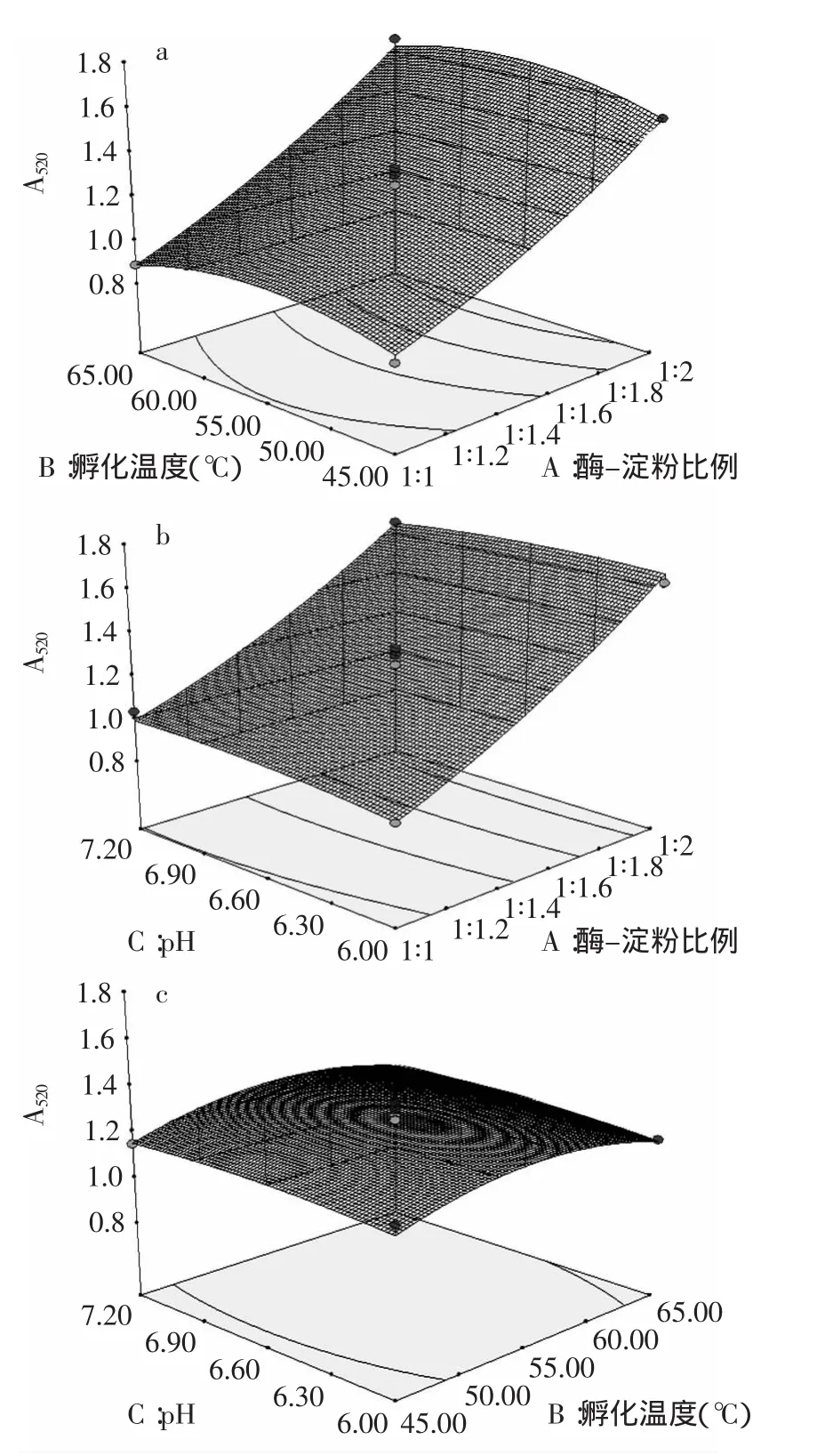
图6 回归优化响应面曲线图Fig.6 Optimization of response surface by regression

表4 中药水提液对α-淀粉酶活性的影响Table 4 Effect of water-extract from traditional Chinese medicine onα-amylase activity
3 结论
本实验对Bemfeld法中pH、孵化温度、α-淀粉酶浓度、可溶性淀粉浓度及α-淀粉酶与可溶性淀粉比例进行一系列考察,并运用响应面分析法进行优化组合,最终确定反应体系的最佳条件为:pH6.6、孵化温度55℃、α-淀粉酶-可溶性淀粉比例1∶1.5。
原测定法中要求A值测试区间设在0.4~0.7之间,范围较窄,不利于比较不同抑制剂活性剂量效关系。目前国内常见的可见分光光度计多采用每毫米1200条衍射光栅,光度范围达到2.5A,光度值也提高到0.5%T,因此在0.2~1.5范围内测定A值,误差影响不大[6]。本实验运用响应面分析法,结合使用可见分光光度计,优化模型测定体系,提高了A值的测定范围,更有利于比较α-淀粉酶抑制剂活性强弱的研究。优化后的α-淀粉酶抑制剂测定方法适用范围广,通过重复实验证明此模型稳定、通过中药水提液及阳性对照物阿卡波糖对α-淀粉酶抑制作用实验证明此模型可行。表明本实验优化后的测定方法可运用于α-淀粉酶抑制剂的筛选。
[1]陈浙江,袁萍,叶晓平,等.治疗糖尿病常用中药对α-葡萄糖苷酶和α-淀粉酶的抑制活性研究[J].中成药,2008(11):1661-1664.
[2]赵蓉,李多伟,沈晓东,等.白芸豆中α-淀粉酶抑制剂的研究[J].中成药,2008,30(9):3.
[3]Sharma A,Gupta M.Three phase partitioning as a largescale separation method for purification of a wheat germ bifunctional protease/amylase inhibitor[J].Process Biochemistry,2001,37(2):193-196.
[4]赵蓉,李多伟,任涛,等.Dns比色法测定白芸豆中α-淀粉酶抑制剂活性的方法研究[J].中成药,2013(3):573-576.
[5]贾光锋.Α-淀粉酶抑制剂的制备及检测[J].食品与药品,2007(2):34-36.
[6]赵修南,贾启燕,单俊杰.Α-淀粉酶抑制剂筛选方法的优化[J].国际药学研究杂志,2008,35(5):4.
[7]魏锐,田惠玲,周建军,等.响应面分析法优化杜仲叶中绿原酸水提工艺[J].安徽农业科学,2011,39(7):3965-3967,3970.
[8]李盈蕾,陈建华,孙吉佑,等.响应面分析法优选黄花菜多糖提取工艺[J].中国酿造,2010(7):72-74.
