速冻水饺细菌总数FISH检测技术的优化*
2013-05-05井洪珍罗剑飞林炜铁何庆
井洪珍,罗剑飞,林炜铁,何庆
(华南理工大学生物科学与工程学院,广东 广州,510006)
随着人们生活节奏的加快,速冻食品行业近年来也有了长足的发展,低温储存和运输不仅延长了食品保质期,且最大限度地保持了食品的形状,食用方便。但是人们对生活品质的要求越来越高,对食品安全尤为关注,食源性微生物引发的疾病已成为目前世界上最受关注的公共卫生问题之一[1]。而速冻水饺为速冻食品中最主要的品种之一,与人们的生活息息相关。“思念”、“三全”和“湾仔码头”等国内速冻食品知名品牌相继被检出金黄色葡萄球菌后,使得速冻食品行业陷入“细菌门”。速冻水饺为带馅食品,原材料中细菌超标和运输过程中的温度波动是导致细菌总数超标的两大主要原因,其污染物控制较难。传统国标法检测细菌总数,操作流程繁琐,耗时耗力,检测周期长[2-3],因此,探索简便、灵敏度高、省时省力的快速检测方法迫在眉睫。
荧光原位杂交(fluorescence in situ hybridization,FISH)技术,是利用荧光标记的寡核苷酸探针来检测特定微生物的一种非放射性的分子遗传学技术。它不需要破坏细胞形态,主要步骤有玻片的制备、细胞的固定、杂交、探针的洗脱和镜检,操作简便、安全、检测信号强、检测周期短,5~8 h就可以得到结果。与传统国标法相比简便、快速、准确度高。在检测致病菌中不依赖PCR,结合显微镜的可视性,可以获得微生物的大小、形态及空间分布等信息,实现对微生物的定位、定量。但该技术对实验条件要求高,且速冻水饺中成分复杂,面粉、胶质、油脂等都会影响实验结果的准确性,因此样品的预处理非常关键。本研究通过优化FISH技术检测速冻水饺中的细菌总数,从而构建快速检测速冻水饺中微生物的FISH实验流程,为提高食品安全提供理论支持。
1 材料和方法
1.1 实验材料
实验室保藏大肠杆菌菌种,市售芹菜猪肉、玉米蔬菜猪肉、韭菜猪肉、香菇鸡肉4种馅料的速冻水饺。
1.1.1 寡核酸探针及所标记荧光素
根据细菌的16S rRNA序列选择通用探针EUB338[4],序列为 5,-3,GCTGCCTCCCGTAGGAGT,靶位点为16S rRNA 338-355,可以检测大多数的细菌,是荧光原位杂交中最常用的探针,也可以检测真菌。5,端用四甲基-6羧基罗丹明(TAMRA)标记,最大吸收波长为550 nm,最大发射波长为620 nm,呈橙红色荧光,探针由生工生物工程有限公司合成。
1.1.2 主要仪器及设备
BX51荧光生物显微镜(OLYMPUS);BS224S电子天平(北京赛多利斯科学仪器有限公司);TDL-5000B飞鸽牌离心机(上海安亭科学仪器厂);Master-Q超纯水制备仪(上海和泰仪器有限公司);BPG-9240A电热鼓风干燥箱(上海一恒科学仪器有限公司);HH-S恒温水浴锅(巩义市予华仪器有限责任公司);PB-10 PH计(北京赛多利斯科学仪器有限公司)。
1.1.3 实验用试剂的配制
杂交液配制[5]:SDS 0.01%(W/V),Tris-HCl(pH 7.2)20 mmol/L,NaCl 900 mmol/L,去离子甲酰胺(DAF)浓度由实验确定,pH7.2。
洗脱液配制[5]:Tris-HCl(pH7.2)20 mmol/L ,SDS 0.01%(W/V),EDTA 5 mmol/L,NaCl浓度由正交试验确定,用去离子水定容至100 mL,最后用1 mol/lHCl调pH值至7.2。
4%多聚甲醛(Pareforaldehyde)的配制:称取40 g多聚甲醛溶于装有500 mL ddH2O的烧杯中,持续加热磁力搅拌至60℃,使成乳白色悬液。用1.0 mol/L的NaOH调pH值至7.0,使呈清亮状,再加入约100 mL 10×PBS,充分混匀(在冰浴或冷水浴中),保证pH7.0,过滤后定容至1 000 mL,4℃保存备用。
PBS缓冲液(pH 7.4):NaCl 137 mmol/L,KCl 2.7 mmol/L,Na2HPO44.3 mmol/L,KH2PO41.4 mmol/L,称 7.9g NaCl,0.2g KCl,0.24g KH2PO4(or 1.44g Na2HPO4)和1.8g K2HPO4,溶于800 mL蒸馏水中,用HCl调节溶液的pH值至7.4,最后加蒸馏水定容至1 L,保存于4℃冰箱中即可。
1.2 实验方法
1.2.1 玻片处理
玻片清洗 热肥皂水浸泡并清洗玻片,然后用蒸馏水冲洗3~5次,浸泡在1%的HCl中24 h,备用。
硅化处理:将玻片浸没在质量分数1%的HCl中煮沸10 min,捞出并置于蒸馏水中1 min,然后用蒸馏水冲洗3次,50℃烘干1 h,锡纸包好,4℃保存即可。
明胶涂片:称取0.1g明胶溶于50~80 mL蒸馏水中,加热搅拌,溶解后,稀释至100 mL,保持60℃,将烘干的玻片放入明胶中浸泡10 min,60℃烘干备用。
1.2.2 取样及预处理
1.2.2.1 取样
本实验中的大肠杆菌菌种为实验室保藏菌种,挑取大肠杆菌菌落接种于LB液体培养基内,37℃活化培养24 h,适量菌液涂布于培养皿中,培养24 h后挑取单菌落于加有1 mL PBS缓冲液的离心管中,制成菌悬液,备用。
水饺样品采购后1 h内放进冰箱,实验前解冻,解冻时45℃以下不超过15 min[6],按照GB 4789.1-2010采样标准采样。取20 g样品,研磨,加入装有35 mL的灭菌生理盐水中(8.5%),加入适量玻璃珠,置37℃摇床中30 min,用4层纱布过滤,得到菌悬液,分装于2 mL离心管中,12 000 r/min离心5 min,移去上清,加入1 mL的PBS(pH7.4)缓冲液,重新悬浮,12 000 r/min离心5 min,重复3次,直至液体澄清。
用油性笔在处理好的玻片上分别标出边长为1.5 cm的正方形区域,并取10 μL分散好的菌液均匀涂于玻片上。
1.2.2.2 样品的热固定
热固定温度为46℃,热固定时间为1~3 h,具体时间由实验确定。
1.2.2.3 4%多聚甲醛固定
热固定后,用 4%多聚甲醛(pareforaldehyde,PFA)于4℃条件下固定10~20 min,具体时间由实验确定。用PBS缓冲液洗脱3次,自然风干。
1.2.2.4 细胞的通透性处理
样品固定后,加入25μL的溶菌酶,37℃,10 min,用无菌超纯水将残余的溶菌酶溶液清洗掉,依次在50%,80%,98%的乙醇溶液脱水,脱水时间由正交试验确定。
然后加入 20 μL 的蛋白酶 K,37℃,10 min,用无菌超纯水洗脱,依次在50%,80%,98%的乙醇溶液中脱水,室温干燥。
1.2.3 原位杂交
在密闭杂交盒中放入吸水纸,适量杂交液湿润.在固定菌体的区域内加入杂交液19 μL、EUB338探针1 μL,放入不透光的湿润杂交盒内,46℃下杂交2~4 h,为保持杂交盒湿润,可置于46℃密闭水浴锅中预热,探针质量浓度为100 ng/μL,杂交温度和杂交时间由正交试验确定。
1.2.4 探针的洗脱
杂交完毕,取出载玻片,放入48℃杂交洗脱液(洗脱盐浓度由正交试验确定)中洗脱15 min,无菌超纯水漂洗3次 ,自然风干,避光。
1.2.5 镜检与计数
制好的玻片用甘油/PBS缓冲液(pH8.5,体积比为9∶1)封片[7]。然后置于荧光显微镜下镜检并计数。
将玻片置于OLYMPUS BX51型荧光显微镜下观察,激发光经过3号滤光片,即绿色激发光,阳性结果显示为橙色荧光;目镜放大倍数为10,物镜放大倍数Mob为40,视场数FN为22。每张玻片观察10个视野,拍照保存。每个视野拍摄2张照片,一张是在激发光下的荧光照片,另一张为在普通光源下的普通照片。用IPP(Image-Pro Plus)软件对照片进行分析和计数。细菌浓度为E(cells/mL):
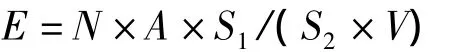
其中:N为样品的稀释倍数;A为视野中荧光细胞平均数;S1为样品涂抹的面积(mm2);S2为视野面积(mm2);视场直径F=FN/Mob=22/40=0.55 mm;视野面积S2=π(F/2)2;V为样品体积(mL)。
1.2.6 对照试验
为避免实验结果出现假阳性,需设置阴性对照和阳性对照[5]:阴性对照不加探针,其他处理均相同;阳性对照不加样品。
1.3 FISH实验条件优化
1.3.1 玻片处理
分别比较硅化和包埋对FISH的影响,得到最佳的处理方法。
1.3.2 细胞固定
分别比较46℃热固定、4%多聚甲醛固定和热固定+多聚甲醛固定3种固定方法对FISH的影响,得到最佳的细胞固定方法。
1.3.3 去离子甲酰胺浓度
分别比较20%,30%,40%的甲酰胺浓度对FISH的影响,得到最佳的去离子甲酰胺处理浓度。
1.3.4 预处理正交试验优化
根据上述比较试验结果,选取合适的玻片处理方法、细胞固定方法和去离子甲酰胺浓度处理样品,对预处理过程中热固定时间、乙醇脱水时间和多聚甲醛固定时间进行正交试验优化,根据文献常用水平,设置各因素水平见表1。

表1 预处理正交试验因素水平Table 1 the level of orthogonal factors
1.3.5 杂交实验条件优化
从样品的预处理正交试验结果出发,对杂交实验条件进行优化。根据文献中常用各因素水平,设置正交试验各因素水平见表2。
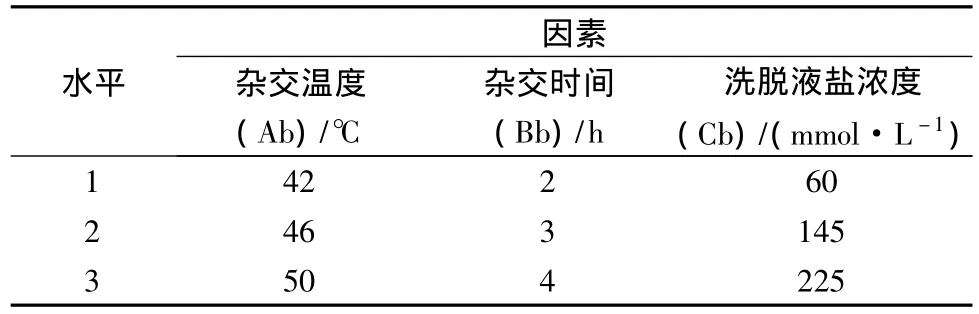
表2 杂交条件正交试验因素水平Table 2 the level of orthogonal factors
2 结果与讨论
2.1 硅化与明胶包埋结果比较
由玻片硅化处理和明胶包埋效果图(图1)比较可知,对于同一样品,明胶包埋效果明显优于硅化处理的玻片,硅化处理的玻片,细胞流失较多,不利于细胞的附着,而明胶包埋的玻片,由于明胶的粘附作用,可以很好地结合细胞,在杂交和探针清洗过程中减少细胞流失,从而保证杂交的充分性。

图1 玻片不同处理方式与荧光信号之间的关系(400)Fig.1 The relationship between slide of different approach and flurescence signal(400)
2.2 不同固定方式对实验结果的影响
通过比较3种固定方法可知,样品热固定后再用4%多聚甲醛固定杂交效果最好(图2);虽然4%多聚甲醛能够较好的保持细胞形态,但单独用其中的一种方法来固定细胞,丢失较严重,从而影响杂交效果,所以采用热固定和多聚甲醛固定结合的方法对样品中微生物细胞进行固定。
2.3 不同甲酰胺浓度比较
通过比较观察图片(图3)可知,杂交液中含有20%去离子甲酰胺的杂交信号较强,并且杂交比较充分,去离子甲酰胺浓度为30%时,杂交信号弱,细菌荧光数少,当浓度增加到40%时,杂交信号模糊,杂交不完全,特异性差。
2.4 不同洗脱盐浓度比较
杂交试验中,样品的洗脱效果主要受洗脱液中NaCl浓度的影响,本实验分别比较了NaCl浓度为60 mmol/L、145 mmol/L、和225 mmol/L时的杂交效果,如图4所示,可以看出C(NaCl)为60 mmol/L时,洗脱不充分,背景出现粘连,模糊不清;NaCl浓度为225 mmol/L时的杂交信号比较强,背景干扰较少。

图2 不同的固定方式与荧光信号之间的关系(400)Fig.2 The relationship between the different fixed slides and fluorescence signal(400)

图3 不同甲酰胺浓度与荧光信号之间的关系(400)Fig.3 The relationship between formamide concentration and fluorescence signal(400)

图4 洗脱盐浓度与荧光信号之间的关系(400)Fig.4 the relationship between salt concentration and fluorescence signal(400)
2.5 不同杂交温度比较
实验分别比较了杂交温度为42、46、50℃时的杂交效果,其他处理均相同,由图片比较可知杂交温度为46℃时,杂交最为充分、信号强度也较亮,50℃时,出现假阳性。
2.6 杂交时间不同
由杂交得到的图片(图6)可知,杂交时间3h时效果最佳,杂交比较充分,检测信号强。杂交时间太短,检测得到的杂交信号较弱,杂交率也比较低;杂交时间过长,则非特异性杂交会增多,从而影响实验结果的准确性。
2.7 样品预处理条件的正交优化
对样品的热固定时间、乙醇脱水时间和多聚甲醛固定时间设计3因素、3水平的正交表L9(34),每组设2个平行,并设置阴性和阳性对照,镜检,拍照并记录单个视野中的荧光细胞数P,实验结果见表3。

图5 杂交温度与荧光信号之间的关系(400)Fig.5 The relationship between the hybridization temperature and the fluorescence signal(400)

图6 杂交时间与荧光信号之间的关系(400)Fig.6 The relationship between hybridization time and the fluorescence signal(400)
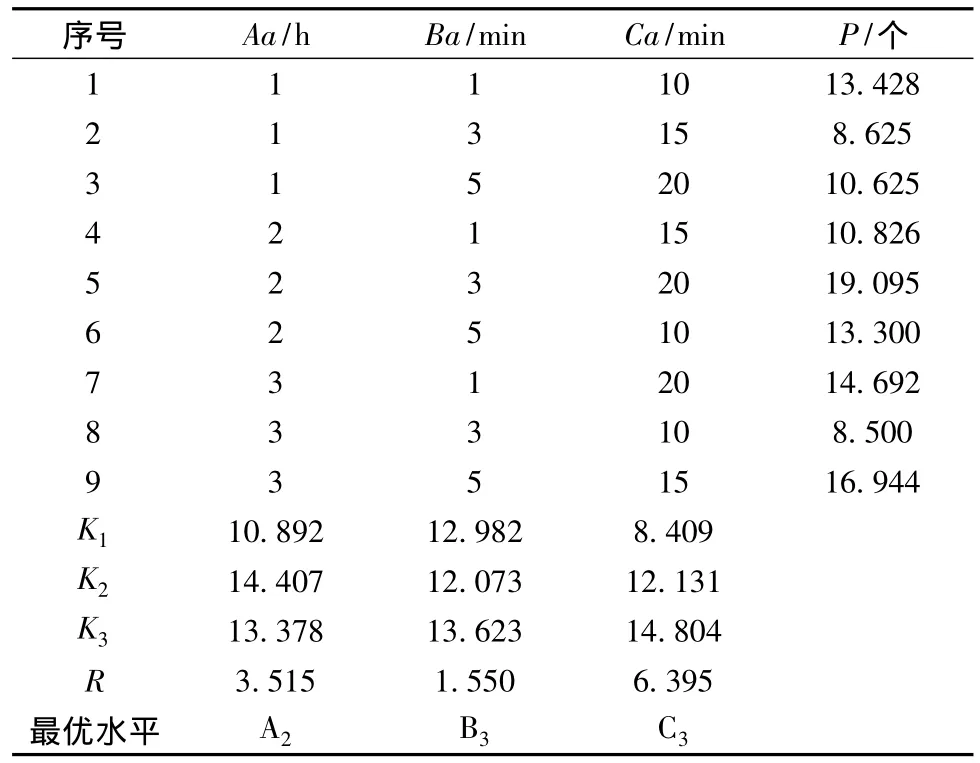
表3 预处理条件正交试验结果Table 3 The pretreatment orthogonal test results
由正交试验和极差分析结果可知,预处理各因素对荧光原位杂交效果影响大小顺序为:Ca(4%多聚甲醛固定时间)>Aa(热固定时间)>Ba(乙醇脱水时间),即4%多聚甲醛的固定时间对实验结果影响最大,其次是热固定时间,乙醇脱水时间对结果影响较小。各因素对应的K值中的最大值所对应的水平,即为该因素最优水平。从表中可知,Aa因素对应的最优水平为2,Ba因素对应的最优水平为3,Ca因素对应的最优水平为3,即预处理条件的最优组合为:46℃热固定2 h,系列梯度乙醇脱水5 min,4%多聚甲醛固定20 min。
2.8 杂交条件的正交试验优化结果
荧光原位杂交试验中,杂交温度高于50℃,会出现杂交信号减弱和非特异性结合增多等问题[8],因此本实验对杂交温度、杂交时间和洗脱盐浓度设计3因素、3水平的正交表,用单个视野中的荧光细胞数(Y)与普通光源下的细胞数(K)的比值(Y.K-1)作为依据,其中Y.K-1越接近1,表示杂交越充分,杂交率越高。通过极差分析来得到杂交条件的最优组合,其正交实验结果见表4。
由正交试验和极差分析结果可知,Ab(杂交温度)>Cb(洗脱盐浓度)>Bb(杂交时间),即杂交各因素中,杂交温度对杂交实验结果影响最大,其次是洗脱盐中NaCl浓度,杂交时间也有一定的影响,各因素对应的最大K值所对应的水平,即为该因素最优水平。由表中可知,Ab因素对应的最优水平为2,即杂交温度为46℃;Bb因素对应的最优水平为2,即杂交时间为3 h;Cb因素对应的最优水平为3,即洗脱盐中NaCl浓度为225 mmol/L。因此,样品杂交条件的最优组合为:杂交温度46℃,杂交时间3 h,洗脱盐浓度为225 mmol/L。

表4 杂交条件正交试验结果Table 4 The Hybridization Orthogonal test results
2.9 水饺样品检测结果
由上述优化方案可知,最优杂交试验条件为热固定3 h,多聚甲醛固定20 min,乙醇脱水5 min,杂交温度46℃,杂交时间3 h,最后用C(NaCl)=225 mmol/L的洗脱液洗去多余探针。按照上述优化方案检测4种速冻水饺,每种随机取2个样检测,并设置阴性和阳性对照,FISH检测结果如图7所示,菌体分散均匀,检测荧光信号强,计数统计结果如表5所示。
从表5可以看出,随机抽样检测的样品中细菌总数在106cells/g左右,而速冻水饺中的细菌总数在103~106CFU/g水平之间[9],研究结果与之相符,且细菌总数含量都较高,所检测的8个样品中有2个样品细菌总数超标,加强食品安全迫在眉睫。

图7 水饺样品检测结果(1000)Fig.7 The dumplings samples test results(1000)

表5 FISH检测样品细菌总数结果Table 5 The results of total bacteria by FISH
3 结论
利用FISH技术检测速冻水饺中细菌总数,水饺样品的预处理是其中的一个难题,针对速冻水饺中的各不同成分,加入玻璃珠振荡、离心、过滤,可以很好地使菌体与杂质分离,去除多余的胶质及其他杂质;PBS缓冲液不仅能够洗去多余油脂,制成菌悬液,还可以使细胞充分扩散;适量的溶菌酶处理,可以溶解膜脂和蛋白质,增大细胞膜的通透性,从而促使探针进入细胞;适当浓度的蛋白酶处理,可以溶解多余的蛋白质,促进探针进入细胞核,且不会破坏细胞形态。另外,系列浓度乙醇脱水和SDS都可以除杂并增大细胞膜的通透性;这些问题的解决为之后的杂交奠定了基础。由于杂交液中添加了质量浓度为20%的甲酰胺,降低了杂交温度,在46℃杂交可以避免样品与探针的非特异性结合,控制杂交时间可以降低假阳性,提高实验结果的准确性。
荧光原位杂交中,采用人工合成的寡聚核苷酸作为探针,具有特异性好、易获得和成本低的特点[10],为研究和应用提供了充分的条件,荧光原位杂交与其他方法相比具有简便、快捷、特异性强的优点[11]。优化利用FISH方法检测速冻水饺中的细菌总数,与传统的国标检测方法相比,具有简便、快捷、灵敏度高的特点,与流式细胞术(FCM)结合可以定量检测废水中的微生物[12],为食品中微生物的快速检测奠定了基础。
针对速冻水饺行业,要把微生物控制在低水平范围内还存在很大的困难,目前市场上存在的不规范的储运,使得食品安全受到严重威胁。速冻水饺馅料中的肉类由于原料营养丰富,是微生物污染的重要诱因,同时温度波动也是影响其品质的又一因素。保障食品安全,不仅要从原材料抓起,其输送条件的控制也很重要,要严格控制温度,使运输和保藏过程中温度波动不超过2℃。另外,工厂的生产工艺条件,生产设备及环境也会影响速冻水饺中的微生物含量,保障食品安全仍需努力。
[1] Malorny B.Standardization of diagnostic PCR for the detection of foodborne pathogens[J].Int J Food Microbiol,2003,83(1):39 -48.
[2] 唐漪灵,郭奕芳.Petrifllm纸片法和国际法检测奶制品细菌总数和大肠菌群数的结果比较[J].中国卫生检验杂志,2000,10(3):325-327.
[3] 吴清平,周艳红,蔡芷荷.卫生微生物特异性显色培养基的研究与应用[J].中国卫生检验杂志,2005,15(1):124-126.
[4] Amann R I.Combination of 16S rRNA-targeted oligonucleotide probes with flow cytometry for analyzing mixed microbial populations[J].Appl Environ Microbiol,1990,56(6):1 919-1 925.
[5] Lorenzen J.Biosensor determination of the microscale distribution of nitrate,nitrate assimilation,nitrification,and denitrification in a diatom-inhabited freshwater sediment[J].Appl Environ Microbiol,1998,64(9):3 264 -3 269.
[6] GB 4789.1-2010食品安全国家标准 食品微生物学检验总则[S].
[7] 龚春明.应用FISH技术对土壤中大肠杆菌的快速特异性检出[J].海峡科学,2009,17(3):26-28.
[8] Roller C.In situ probing of gram-positive bacteria with high DNA G+C content using 23S rRNA-targeted oligonucleotides.Microbiology[J],1994,140(Pt 10):2 849-2 858.
[9] 史艳宇,刘金华,华蕾,等.速冻水饺中主要微生物学指标调查研[J].中国卫生检验杂志,2008,18(12):2 741-2 742.
[10] 陈瑛.微生物荧光原位杂交 (FISH)实验技术[J].哈尔滨工业大学学报,2008,40(4):546-549.
[11] Yuregir O O.Fluorescent in situ hybridization studies in multiple myeloma[J].Hematology,2009,14(2):90 -94.
[12] 张燕燕,陈进军.FISH-FCM方法检测酵母-细菌二元体系中微生物数量[J].生态学报,2008,28(10):4 849-4 855.
