云南腾冲雪鸡肌肉蛋白质组学研究
2013-04-29廖国周王桂瑛程志斌等
廖国周 王桂瑛 程志斌等
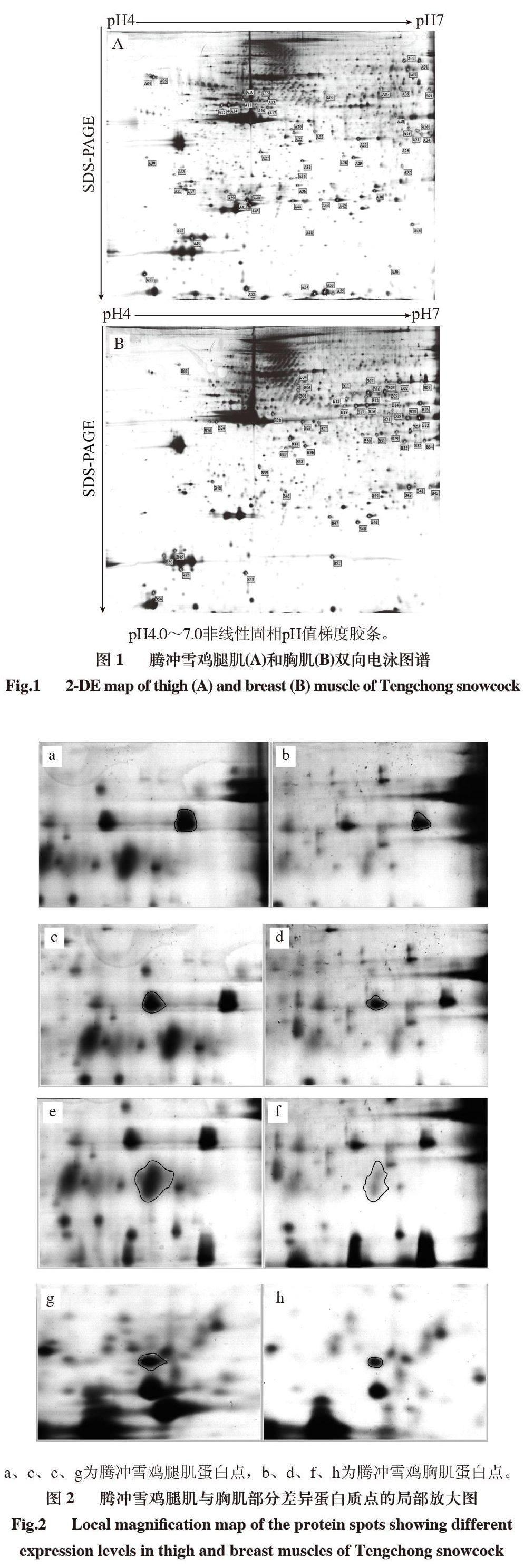
摘要:腾冲雪鸡是云南省腾冲县的一个地方优良家鸡品种,具有羽毛洁白、肉骨乌黑、肉质好、抗病性强等优良特性。本研究以140日龄腾冲雪鸡为对象,采用双向电泳(DE)分析其腿肌与胸肌中蛋白表达差异,并以基质辅助激光解析电离-串联飞行时间质谱(MALDI-TOF/TOF MS)鉴定腿肌与胸肌中差异蛋白质点。结果表明,经双向电泳图谱分析所获得的肌肉组织蛋白点分布于pH4.0~7.0之间,蛋白点清晰,图谱分辨率较好,其中腿肌中检测到1421±34个蛋白点,胸肌中检测到1329±25个蛋白点,对比分析腿肌和胸肌组织的DE图谱,发现有110个点存在明显的表达差异,在腿肌中高表达的点有56个,在胸肌中高表达的点有54个;选取的蛋白质点经鉴定为核纤层蛋白A、磷酸葡萄糖变位酶1、β-烯醇酶、超氧化物歧化酶、肌酸激酶M型、乙二醛酶1、原肌原蛋白1,以及一些假设蛋白和非特征性蛋白。
关键词:腾冲雪鸡;蛋白质组学;双向电泳
中图分类号:TS207.3 文献标志码:A 文章编号:1001-8123(2013)07-0001-05
腾冲雪鸡是云南省腾冲县的一个优良地方家鸡品种,产于冬季积雪的高黎贡山地区,因羽毛洁白无斑而得名。其生长速度快,体型中等,具有肉骨乌黑、味香肉嫩、抗病力强等特性。目前,研究者已从体型外貌特征[1]、血液生化指标[2]、肌肉营养成分[3]、屠宰性能[4]、肌纤维特性[5]与遗传多样性[6]等方面对其进行探讨。鉴于腾冲雪鸡是具有地方特色的家鸡遗传资源,需要从不同角度对其开展深入的系统研究。
蛋白质是生命活动过程的功能单位,而蛋白质组是指在特定的时间和环境条件下一个细胞内所有蛋白质的表达。由于肌肉的主要成分是水和蛋白质,因此对蛋白质组进行分析,就可获得大量的信息,进而阐明鉴定肉质的各种蛋白质的结构和功能[7-8],并从全新的角度来分析已知的或新出现的肉质问题[9]。目前,与家禽肉质相关的蛋白质组研究还很少,且对于腾冲雪鸡肌肉蛋白质组学研究尚未见报道,本研究旨在通过双向电泳(dimensional electrophoresis,DE)分离腾冲雪鸡肌肉蛋白,分析腿肌与胸肌中蛋白表达差异,并以基质辅助激光解析电离-串联飞行时间质谱(matrix assisted laser desorption ionization-time-of-flight mass spectrometry,MALDI-TOF/TOF MS)对分离的差异蛋白点进行鉴定,为探讨腾冲雪鸡不同部位肌肉品质差异的内在机理奠定基础,并进一步为腾冲雪鸡种质资源的保护和开发利用提供依据。
1 材料与方法
1.1 材料与试剂
140日龄腾冲雪鸡由云南农业大学实验种鸡场提供,屠宰后分别选取腿肌和胸肌作为样品,并置于-80℃条件下待分析。
N,N-亚甲基双丙烯酰胺、碳酸氢铵与牛血清蛋白(bovine serum albumin,BSA)标准品 美国Sigma公司;三氯乙酸(trichloroacetic acid,TCA)、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、丙烯酰胺、二硫苏糖醇(dithiothreitol,DTT)、三羟甲基氨基甲烷(Tris-base)和3-[(3-胆酰胺丙基)-二乙胺]-丙磺酸、N,N,N,N-四甲基乙二胺(tetramethyl ethylenediamine,TEMED)、过硫酸铵(ammonium persulfate,AP)与碘乙酰胺 美国Amersham公司;胰酶与十二烷基磺酸钠(sodium dodecyl sulfate,SDS) 普洛麦(北京)生物技术有限公司;固相pH梯度(immobilized pH gradients,IPG)缓冲液(pH4.0~7.0) 美国GE公司;固相pH梯度(IPG)干胶条(24cm,pH4.0~7.0) 美国Bio-Rad公司;其他试剂均为国产分析纯产品。
1.2 仪器与设备
Ettan IPGphor Ⅲ等电聚焦电泳仪、Ettan DALTsix二向SDS聚丙烯酰胺凝胶电泳仪 美国GE公司;Powerlook1100凝胶扫描仪 美国Umax公司;Autoflex speed? MALDI-TOF/TOF质谱仪 德国Bruker Dalton公司。
1.3 方法
腾冲雪鸡腿肌和胸肌中蛋白质组分析参考文献[10]的方法并稍作修改。
1.3.1 蛋白质的提取及纯化
取1g腾冲雪鸡肉样以液氮研磨成粉,加入10倍体积-20℃预冷的10% TCA/丙酮溶液,-20℃沉降过夜,随后在4℃、12000r/min离心20min,弃上清液,沉淀物加预冷丙酮洗涤,在4℃、12000r/min离心15min,重复2次,沉淀经真空干燥后,置于-20℃备用。
1.3.2 蛋白质含量测定
称取蛋白质干粉20mg,加0.5mL裂解液(含1mmol/L PMSF,7mol/L尿素,2mol/L硫脲,4% CHAPS(3-[(3-胆酰胺丙基)-二乙胺]-丙磺酸),0.02mol/L Tris-bases(三羟甲基氨基甲烷),超声裂解30min,将超声后的蛋白混合物于4℃、12000r/min离心20min,收集上清液,通过Braford法[11]测定蛋白质含量。
1.3.3 双向电泳
1.3.3.1 等电聚焦电泳
等电聚焦电泳参照IPGphor III等电聚焦系统使用指南进行。腾冲雪鸡肌肉蛋白与水化液(含7mol/L尿素、2mol/L硫脲、4% CHAPS、1% DTT、0.7% IPG缓冲液、0.002%溴酚蓝)充分混合后至上样总体积为460μL。非线性IPG干胶条胶面朝下放入水化液,覆盖一层矿物油防止等电聚焦时尿素析出、蛋白氧化及产生冷凝水,置于Ettan IPGphor等电聚焦仪中,重泡胀和等电聚焦均在20℃进行,每根胶条限流50μA。
1.3.3.2 胶条平衡
等电聚焦完毕后,胶条先在8mL平衡缓冲液Ⅰ(含0.05mol/L Tris-HCl pH8.8,6mol/L尿素,30%甘油,2% SDS,0.002%溴酚蓝,0.1mol/L DTT)中平衡15min,再在8mL平衡缓冲液Ⅱ(以0.25mol/L碘乙酰胺替换0.1mol/L DTT,其余组分同平衡缓冲液Ⅰ)中平衡15min。
1.3.3.3 SDS-聚丙烯酰胺凝胶电泳
将平衡后的IPG胶条转移至质量分数12.5%的凝胶上端,用0.8%低熔点琼脂糖封顶,待琼脂糖凝固后即可进行第二向SDS凝胶电泳。电泳参数设置:初始功率为2W/胶条,运行45min,然后加大功率至17W/胶条,直至溴酚蓝指示线跑至胶底缘时电泳结束,约4.5h。IPG胶条的最大电流为50μA/胶条,凝胶厚度为1mm。
1.3.4 染色与图像分析
电泳结束后剥离凝胶,置于考马斯亮蓝溶液中固定染色2~4h,换脱色液脱色,直到背景无色透明,蛋白点清晰为止。脱色后的双向电泳凝胶经扫描仪扫描保存图像,图像分析采用ImageMaster 2D Platinum 5.0软件进行。
1.3.5 质谱样品制备与质谱分析
切下目的蛋白点使用Autoflex speed? MALDI-TOF/TOF质谱仪进行分析,条件为激光波长355nm、重复速率200Hz、加速电压20kV、最优质量分辨率1500u。利用软件flexAnalysis过滤基线峰、识别信号峰,以BioTools软件搜索美国国家生物信息中心(National Center For Biotechnology Information,NCBI)数据库,寻找匹配的相关蛋白质,同时查询其功能,来明确鉴定的蛋白质为何种蛋白质。
2 结果与分析
2.1 腾冲雪鸡肌肉蛋白质组的双向电泳图谱
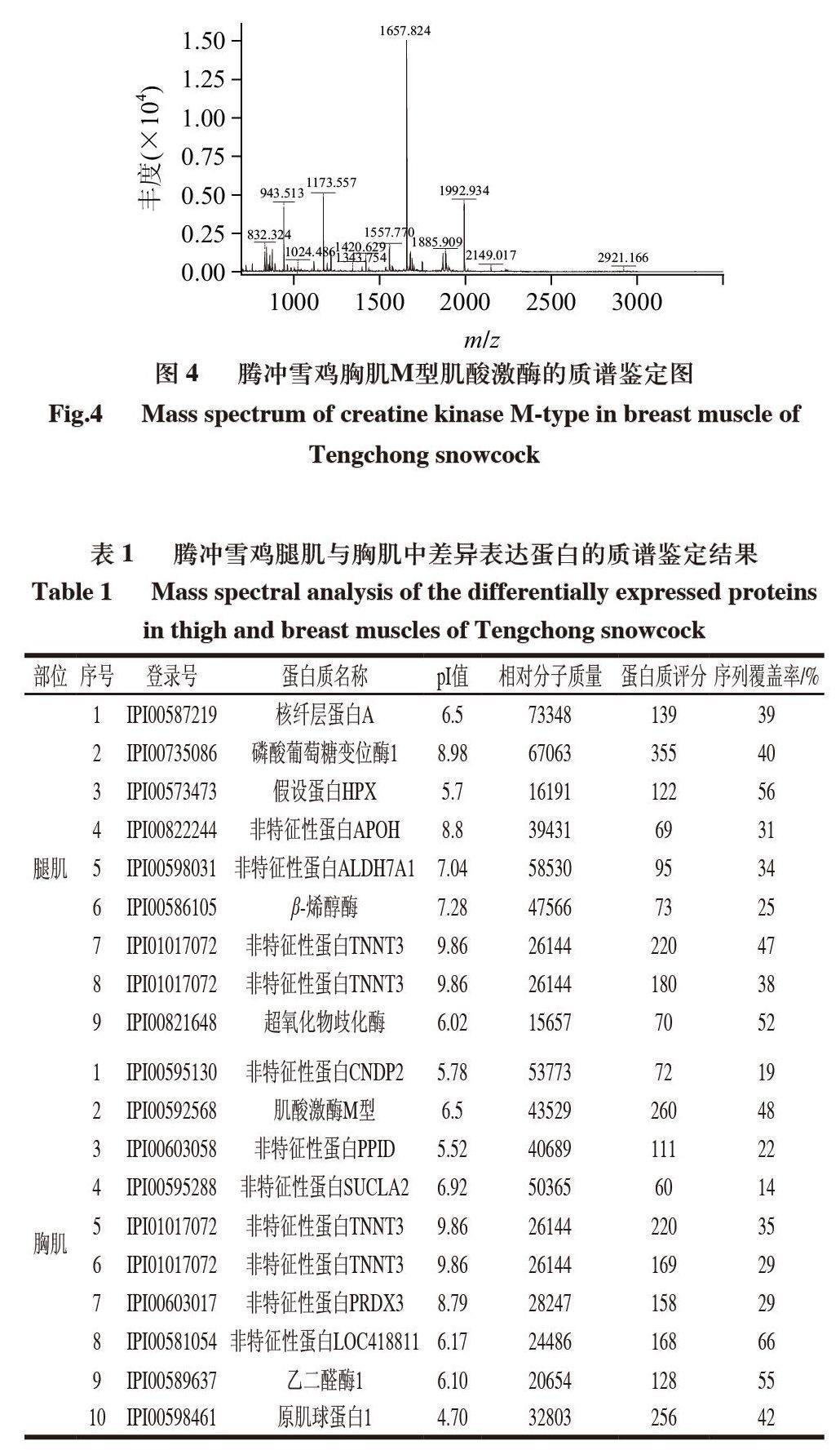
对腾冲雪鸡肌肉蛋白进行的双向电泳实验均重复3次。实验以pH4.0~7.0、24cm非线性IPG干胶条分别对腾冲雪鸡腿肌肉和胸肌肉蛋白进行分离,并利用考马斯亮蓝进行染色。由图1可见,电泳分离较充分,腿肌肉共发现1421±34个蛋白质点,胸肌肉共发现1329±25个蛋白质点,清晰可辨,图像拖带、条纹不明显,能满足进一步分析的需要。通过ImageMaster 2D Platinum软件分析凝胶上的蛋白质点发现,腾冲雪鸡腿肌与胸肌的双向电泳表达谱基本相似,但是有部分蛋白点的表达有差异,其中在腿肌的蛋白电泳图谱上有56个蛋白点明显高表达,而在胸肌的蛋白电泳图谱上则有54个蛋白点明显高表达。图2中分别列举了部分具有明显变化的蛋白质点的局部放大图。
2.2 差异表达蛋白质的鉴定和数据库检索
选取的差异蛋白斑点经过酶解之后,以MALDI-TOF/TOF质谱分析得到肽质量指纹图谱,由图3和图4可见,图谱信号都较强且基线平稳。获得的m/z数据送入NCBI非冗余数据库,通过Mascot搜索引擎检索,检索分值在67分以上视为可信结果(P<0.05)。根据检索结果,鉴定的腾冲雪鸡腿肌和胸肌中差异表达蛋白的相关数据见表1。由表1可见,腾冲雪鸡腿肌和胸肌中分别鉴定出9种和10种蛋白,主要为核纤层蛋白A、磷酸葡萄糖变位酶1、β-烯醇酶、超氧化物歧化酶、肌酸激酶M型、乙二醛酶1、原肌原蛋白1,以及一些假设蛋白和非特征性蛋白。
3 讨 论
畜禽肌肉中蛋白质含量超过20%,肉品质与肌肉蛋白质之间存在密切联系,因此肉品科学要与功能蛋白质研究相结合。蛋白质组是指一个细胞或一个组织基因组所表达的全部蛋白质。近年研究结果表明,蛋白质组与肉的嫩度相关[12]。蛋白质组学是研究蛋白质最直接、最有效的方法,其目的是从整体的角度分析细胞内动态变化的蛋白质组成成分、表达水平与修饰状态,了解蛋白质之间的相互作用与联系,揭示蛋白质功能与细胞生命活动规律,鉴定并分析感兴趣的个别蛋白[13]。目前与家禽肉质相关的蛋白质组学研究很少。Doherty等[14]对蛋鸡胸肌蛋白质组所做的研究表明,蛋鸡生长期内几种蛋白质的相对表达水平均有极大变化,表明蛋白质组分析的复杂性,然而它是人们更深入了解家禽生长期间肌肉变化情况的第一步,具有重要意义。
本实验通过双向电泳分离腾冲雪鸡腿肌和胸肌中的总蛋白,分析这两个部位蛋白质表达的差异,发现两个部位间有110个蛋白或肽段存在差异表达,随后以MALDI-TOF/TOF MS对分离的差异蛋白点进行鉴定,数据库检索后,腿肌中鉴定出9种蛋白,胸肌中鉴定出10种蛋白,分别为核纤层蛋白A、磷酸葡萄糖变位酶1、烯醇酶、超氧化物歧化酶、肌酸激酶M型、乙二醛酶1、原肌原蛋白1,以及一些假设蛋白和非特征性蛋白。得到的19个蛋白点。根据功能可分为4类,即结构蛋白、收缩蛋白、代谢蛋白及未分类蛋白。核纤层蛋白A是细胞核内骨架蛋白,是构成核纤层的主要成分,属于中间纤维的一种。近年来发现,核纤层蛋白A能够促进骨骼肌成肌细胞的分化,促进骨骼肌的生长[15]。磷酸葡萄糖变位酶1是生物体组织中广泛存在的一组重要的酶类。它可以催化葡萄糖-1-磷酸盐和葡萄糖-6-磷酸盐相互转化,在糖代谢中起着重要的作用。烯醇酶在糖酵解过程提供能量,其活性可作为肌形成的指标,肌肉组织中的烯醇酶主要包括α和β亚型,其中β型称为肌肉特异性烯醇酶[16],本实验中腾冲雪鸡腿肌的β-烯醇酶表达量较胸肌的高,表明腿肌生长速度较胸肌快。肌酸激酶-M型参与能量转化,可逆的催化磷酸盐在三磷酸腺苷(adenosine triphosphate,ATP)和肌酸的转化[17]。超氧化物歧化酶是清除自由基的主要酶之一,它可以催化清除体内的超氧阴离子自由基,从而阻断自由基的连锁反应,保护机体免受其害[18]。乙二醛酶1是一种以谷胱甘肽作为辅酶,将甲基乙二醛转化为乳酸的酶。原肌球蛋白1的主要作用是加强和稳定肌动蛋白丝,抑制肌动蛋白与肌球蛋白结合。另外,本实验中还鉴定出一些未分类的假设蛋白和非特征性蛋白,这些蛋白质的功能以及蛋白质之间的相互作用,还有待做更进一步的研究。
4 结 论
本研究利用双向电泳技术,建立了腾冲雪鸡肌肉蛋白质的双向电泳图谱,分析了腾冲雪鸡腿肌与胸肌中蛋白质表达差异,并利用MALDI- TOF/TOF MS对这些差异表达蛋白质进行鉴定,为进一步深入研究腾冲雪鸡不同部位肌肉品质差异的内在机制奠定基础。
参考文献:
[1] 沈雪鹰, 尹玉安. 腾冲雪鸡资源调查[J]. 中国家禽, 1999, 21(2): 8-9.
[2] 叶绍辉, 张华英, 段纲, 等. 60~90日龄不同性别腾冲雪鸡血液生化指标差异研究[J]. 云南农业大学学报, 1999, 14(4): 345-348.
[3] 欧茶海, 李润泉, 丁看柏, 等. 不同日龄和性别腾冲雪鸡肉的营养成分分析[J]. 西南民族学院学报, 1999, 25(2): 18-185.
[4] 叶绍辉, 欧茶海, 丁自柏, 等. 60和90日龄笼养腾冲雪鸡屠宰-性能分析[J]. 云南畜牧兽医, 2000(1): 14-15.
[5] 谭丽勤, 欧茶海, 李润泉, 等. 60~90日龄腾冲雪鸡肌纤维特性研究[J]. 云南农业大学学报, 2000, 15(4): 345-348.
[6] 苗永旺, 陈涛, 霍金龙, 等. 利用微卫星标记分析腾冲雪鸡的遗传多样性[J]. 西南农业学报, 2008, 21(5): 1431-1433.
[7] 余翔. 蛋白质组学在肉品科学中的应用[J]. 肉类工业, 2011(1): 39-42.
[8] BENDIXEN E. The use of proteomics in meat science[J]. Meat Science, 2005, 71(1): 138-149.
[9] REMIGNON H, MOLETTE C, BABILER R, et al. Current advances in proteomic analysis and its use for the resolution of poultry meat quality problems[J]. Worlds Poultry Science Journal, 2006, 62(1): 123-130.
[10] 廖国周, 王桂瑛, 程志斌, 等. 双向电泳分析宣威火腿蛋白质组方法的建立[J]. 食品科学, 2012, 33(22): 125-128.
[11] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram of protein utilizing the principle of protein dye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254.
[12] LAMETSCH R, KARLSSON A, ROSENVOLD K, et al. Postmortem proteome changes of porcine muscle related to tenderness[J]. Journal of Agricultural and Food Chemistry, 2003, 51(24): 6992-6997.
[13] GORG A, WEISS W, DUNN M J. Current two-dimensional electrophoresis technology for proteomics[J]. Proteomics, 2004, 12(4): 3665-3685.
[14] DOHERTY M K, MCLEAN L, HAYTER J R, et al. The proteome of chicken skeletal muscle: changes in soluble protein expression during growth in a layer strain[J]. Proteomics, 2004, 4(7): 2082-2093.
[15] 马延超, 许寿生, 周越, 等. 核纤层蛋白Lamin A的结构及功能和代谢特征[J]. 中国组织工程研究与临床康复, 2009, 46(13): 9167-9170.
[16] KELLER A, PELTZER J, CARPENTIER G, et al. Interactions of enolase isoforms with tubulin and microtubule during myogenesis[J]. Biochimica et Biophysica Acta-General Subject, 2007, 1770(6): 919-926.
[17] CROS N, MULLER J, BOUJU S, et al. Upregulation of M-creatine kinase and glyceraldehyde3-phosphate dehydrogenase: two markers of muscle disuse[J]. American Journal of Physiology, 1999, 276(2): R308-R316.
[18] 魏 宁, 张步彩, 蔡丙严, 等. 采血应激对白羽肉鸡血清超氧化物歧化酶活性的影响[J]. 江苏农业科学, 2012, 40(12): 222-224.
