不同激素配比对“ABBY”草地早熟禾愈伤组织诱导的影响
2013-04-25蒋新民杨春华
蒋新民,杨春华,刘 羽
(1.四川农业大学动物科技学院草业科学系,四川 雅安 625014)
草地早熟禾(Poapratensis)是典型的禾本科冷季型多年生草本植物,为重要的草坪草之一。随着人们对高品质草坪的需求增加,为保持草地早熟禾在现代草坪园艺市场中的重要地位,必须对其不良性状进行改良,如草地早熟禾的抗除草剂、抗虫能力弱,适应性、耐阴性和耐盐碱性等能力差。但由于草地早熟禾具有兼性无融合生殖的特性[1],采用常规育种技术改良这些不利性状难度大,而任何遗传转化能否成功必须依赖于能否通过组织培养获得改良性状的再生植株[2]。国外早在20世纪80年代就开始了对早熟禾的组织培养研究[3]。在过去30余年中,有大量关于草地早熟禾外植体取材的探索,主要为植株、成熟种子、未成熟的合子胚[4-5]、未成熟的花序[6]、茎尖[7]、成熟种子[6,8]、胚芽鞘、叶片以及苗茎段等[9]。国内学者也对草地早熟禾愈伤组织外植体的选择做了大量研究,信金娜等[10]对草地早熟禾成熟种子和胚轴进行诱导,发现成熟种子的出愈率和胚性愈伤诱导率均高于胚轴;皮伟等[11]试验表明,早熟禾幼胚轴诱导愈伤组织很容易,再生苗获取困难。未成熟花也是外植体的最佳选材,但取材受季节限制[12],在实际组织培养中操作难度大。成熟种子同其它外植体相比,其愈伤组织的芽分化频率较低,但易于获取,且不受季节和植株发育时期等因素的限制,具备取材方便、操作简单等优点[13]。因此,成熟种子作为外植体进行组织培养建立一个高频的植株再生体系成为大多研究者的首选。
为建立一个高效的草地早熟禾品种“ABBY”遗传转化受体体系,需要对组织培养条件进行筛选、优化,为该品种在国内引种、驯化和改良提供基础。因此,本研究选用草地早熟禾品种“ABBY”的成熟种子为外植体,对该品种愈伤组织诱导进行探索,以期为建立一个高频的该品种遗传转化再生体系打下坚实的基础。
1 材料与方法
1.1试验材料
1.1.1植物材料 试验材料以由美国密西根州立大学提供的草地早熟禾“ABBY”品种的成熟种子为外植体。
1.1.2植物激素 2,4-D(2,4-二氯苯氧乙酸),6-BA(6-芐基氨基嘌呤),NAA(萘乙酸)。2,4-D和NAA分别用少量无水乙醇溶解后,加蒸馏水配成1 mg·L-1的母液;6-BA用少量10% NaOH溶解后,加蒸馏水配成1 mg·L-1的母液。于4 ℃冰箱保存。
1.2方法
1.2.1培养基配置 培养基为MS培养基+7 g·L-1琼脂+30 g·L-1蔗糖,根据试验设计添加不同浓度激素。培养基pH调至5.8,在121~126 ℃下灭菌20 min备用。
1.2.2外植体的处理 将包被于“ABBY”颖果上的内外稃去除,自来水冲洗后置于4 ℃冰箱内浸泡12 h后备用。接种前,在超净工作台上用75%的酒精对预处理的种子表面消毒10 min,消毒后用灭菌去离子水清洗3次;然后加入适量0.1% HgCl并摇匀搅拌8 min,再用灭菌去离子水清洗5次。
1.2.3愈伤组织诱导 在超净工作台上,用枪状镊将已灭菌的种子接种于培养基上。每个培养皿接种50粒种子,每个处理重复5次(表1、表2)。愈伤组织诱导在(25±2)℃黑暗条件下培养,每10 d观察记录各处理愈伤组织的出愈率和生长情况。
1.2.4愈伤组织分化 在培养基中加入不同浓度的NAA和6-BA(表3)。选取愈伤组织淡黄色、表面干燥而紧实、体积较大的愈伤组织块,接种于培养基上,每种培养基分别接种15瓶,每瓶接种2~3块。置于27 ℃、光照16 h·d-1、光照强度10 000 lx,及温度25 ℃、黑暗8 h·d-1环境中变温培养。4周后统计“ABBY”分化率。
1.2.5数据分析 采用SPSS 20.0软件包和Excel软件进行数据处理和统计分析,采用LSD法对处理间平均数进行方差分析,P<0.05 为显著水平。
2 结果与分析
2.1不同激素浓度配比对草地早熟禾愈伤组织诱导的影响
2.1.1不同浓度2,4-D对愈伤组织诱导的影响 在培养基中加入不同浓度2,4-D,经30 d黑暗培养后表明,不同浓度的2,4-D对草地早熟禾“ABBY”诱导率及愈伤组织的质量都有显著影响(表1、图1)。
2,4-D对愈伤组织出愈率具有显著影响(表1,P<0.05)。当2,4-D浓度为3 mg·L-1时,愈伤组织诱导率最高。当添加2,4-D浓度在3 mg·L-1以下时,随着添加浓度增加,愈伤组织诱导率增加。当添加2,4-D浓度在3 mg·L-1以上时,随着添加浓度增加,愈伤组织诱导率降低。
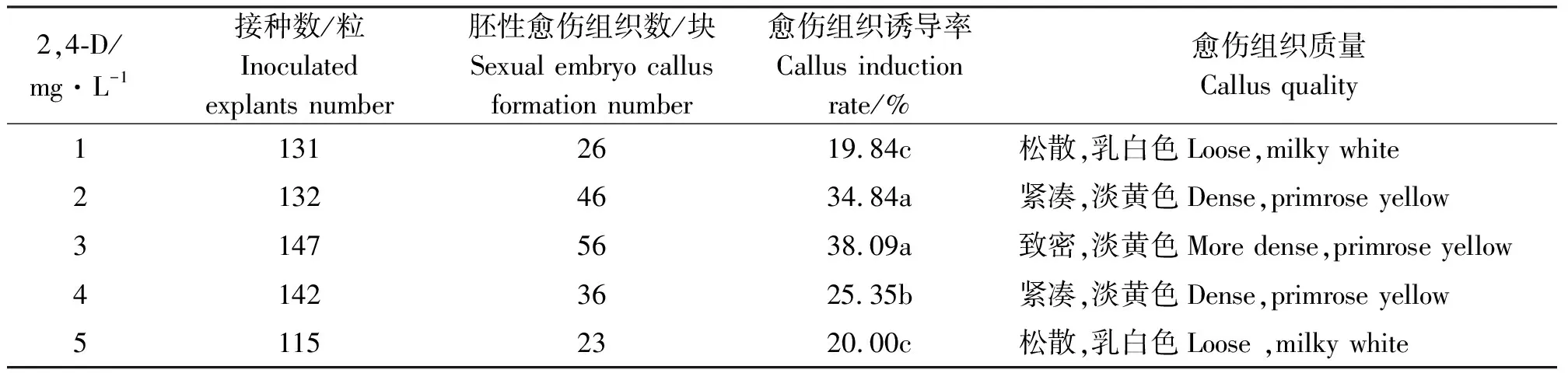
表1 2, 4-D对愈伤组织诱导的影响Table 1 Effects of 2, 4-D on callus induction
2.1.22,4-D和6-BA不同浓度配比对愈伤组织诱导的影响 在MS培养基中加入不同浓度的2,4-D和6-BA,经30 d黑暗培养后,“ABBY”的出愈率和愈伤组织品质不同,2,4-D和6-BA两个因素对“ABBY”愈伤组织诱导率均具有显著影响(表2)。MS+1 mg·L-12,4-D+0.2 mg·L-16-BA 的胚性愈伤组织诱导率最高(表2),为54.74%;其次为MS+1 mg·L-12,4-D+0.4 mg·L-16-BA ,其诱导率为45.81%。且在所有处理中,MS+mg·L-12,4-D 1+0.4 mg·L-16-BA的愈伤组织生长速度和愈伤组织品质最好。
试验还发现,当2,4-D浓度为1 mg·L-1时,不同浓度的6-BA的诱导率均值为44.84%,明显大于2,4-D其它浓度与不同浓度的6-BA共同作用的诱导率(表2)。
综上所述,与单独使用2,4-D(诱导率最高为38.09%)相比,2,4-D与6-BA配合使用,处理MS+1 mg·L-12,4-D+0.4 mg·L-16-BA的愈伤组织诱导率较高且质量较好。
2.2不同激素浓度处理对草地早熟禾愈伤组织分化的影响 不同浓度的NAA和6-BA对“ABBY”分化率有显著影响(表3)。当NAA浓度为0.2 mg·L-1时,不同浓度的6-BA对胚性愈伤组织分化率影响差异显著(P<0.05),分化率随6-BA浓度的增加而增大。当6-BA浓度在3 mg·L-1以下时,愈伤组织分化率随浓度的增加而增大。当6-BA浓度为3 mg·L-1时,分化率达到100%。可见,在MS培养基中添加0.2 mg·L-1NAA和3 mg·L-16-BA最适愈伤组织分化(表3)。
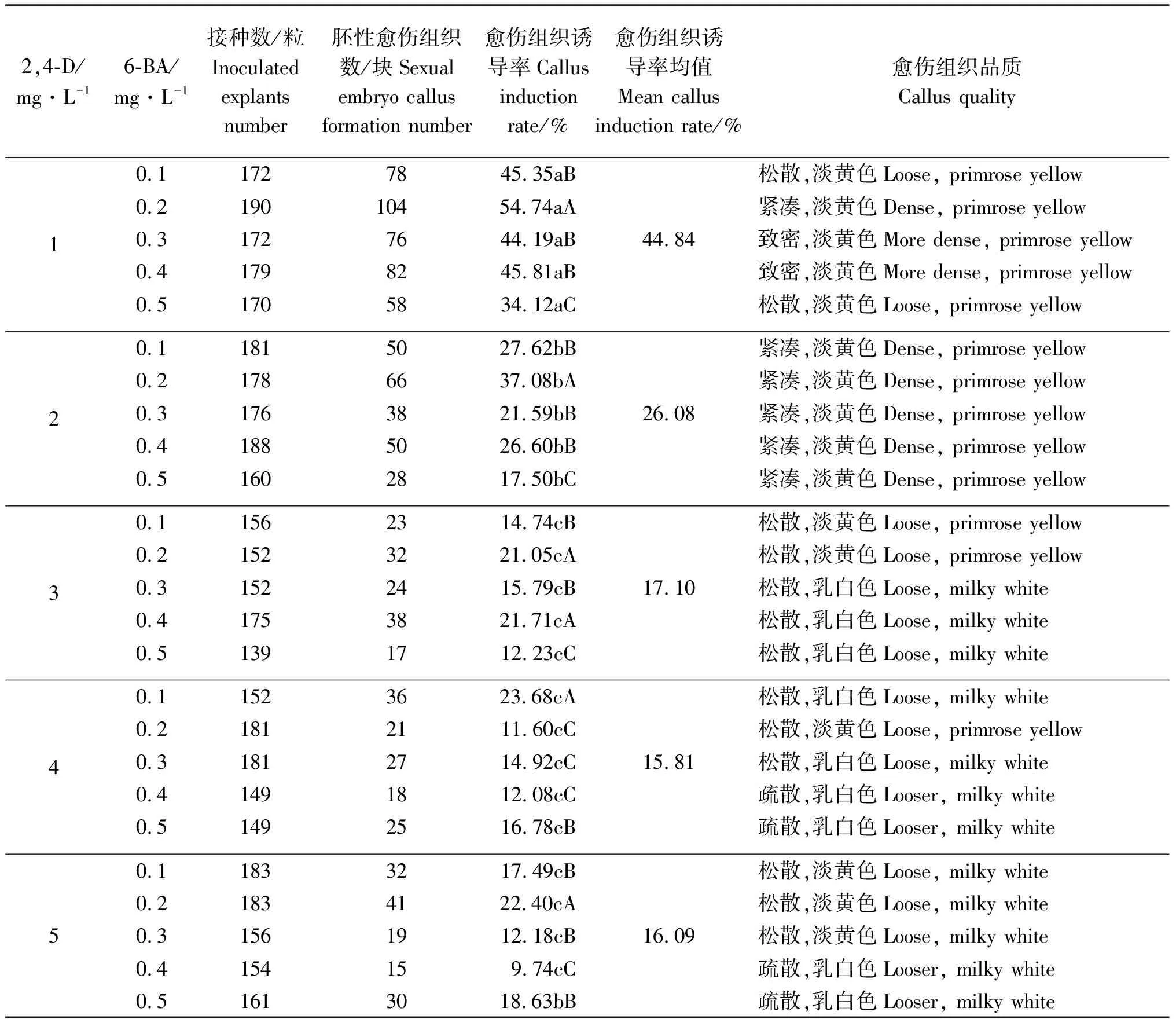
表2 2,4-D和6-BA不同质量浓度对愈伤组织诱导的影响Table 2 Effects of different concentrations of 2,4-D and 6-BA on callus induction

图1 草地早熟禾(ABBY)组织培养各个阶段Fig.1 Different tissue culture stages of Kentucky bluegrass (ABBY)

表3 不同浓度NAA和6-BA对胚性愈伤组织分化的影响Table 3 Effects of different concentrations of NAA and 6-BA on embryogenic callus differentiation
3 讨论
3.1不同外源激素对草地早熟禾胚性愈伤组织诱导的影响 愈伤组织的诱导和分化是草地早熟禾植株再生体系的两个关键环节。在禾本科植物愈伤组织的诱导中,2,4-D是一种植物生长调节物质,起着决定性作用,其通过对内源生长素水平的调整和平衡来启动细胞分裂和胚性潜力的诱导,并促进体细胞胚的早期发育[14]。
本研究表明,单独使用2,4-D时,当浓度在1~3 mg·L-1时,愈伤组织的诱导率随浓度的增加而增大;当浓度超过3 mg·L-1时,愈伤组织诱导率随浓度的增加而降低。因此,草地早熟禾“ABBY”组织培养中愈伤组织诱导的2,4-D最适浓度为3 mg·L-1。这个结论与马忠华等[3]的试验一致,即在一定浓度范围内,诱导率随2,4-D浓度的增加而增加,但过高或过低浓度的2,4-D都会使愈伤组织的诱导率降低[15]。除此之外,一定量的生长素和细胞分裂素能够提高愈伤组织的品质,但所需浓度尚需研究。
本试验发现,与单独使用2,4-D(诱导率最高为38.09%)相比,2,4-D与6-BA配合使用诱导率更高,且愈伤组织质量更好。由此说明,添加6-BA可以提高草地早熟禾的愈伤组织诱导率,与丁路明等[16]的研究结论一致,但2,4-D与6-BA的配合使用中获得最高出愈率的2,4-D浓度与单独使用2,4-D时的最适浓度不一致。当2,4-D浓度为3 mg·L-1时,不同浓度6-BA的诱导出愈率显著低于2,4-D浓度为1 mg·L-1时不同浓度6-BA的诱导出愈率。可能是6-BA与2,4-D共同调节着草地早熟禾“ABBY”某种植物内源激素或蛋白质,从而使得其效果相互叠加,引起在2,4-D与6-BA的配合使用中2,4-D浓度的下降,具体是哪种植物内源激素,还需进一步研究探索。
3.2不同外源激素对草地早熟禾愈伤组织分化的影响 在愈伤组织分化过程中,6-BA是重要的激素之一,对根和芽的分化具有明显的促进作用。2,4-D作为一种生长素,主要作用是促进去分化,而不利于细胞再分化,因而在分化培养基中不添加或添加较低浓度2,4-D。本试验中在分化培养基中加入NAA 与6-BA两种外源激素,NAA的最适浓度为0.2 mg·L-1,且愈伤组织分化率随6-BA浓度的增加而增大。当NAA 浓度为0.2 mg·L-1、6-BA的浓度为3 mg·L-1时,愈伤组织分化率达到最高。马忠华等[3]的试验发现,分化培养基中不同质量浓度的2,4-D对愈伤组织分化形成幼苗有显著影响,0.1 mg·L-1的2,4-D 诱导分化率最高。丁路明等[17]试验也表明,0.1 mg·L-1的2,4-D是诱导肯塔基草地早熟禾愈伤组织分化的最佳浓度;NAA和6-BA配合使用不如单独使用2,4-D诱导分化效果好。然而皮伟等[11]报道在添加0.1、0.3 mg·L-12,4-D的分化培养基上不能长成幼苗,2,4-D的存在抑制了幼芽的生长。综上所述,草地早熟禾品种不同,结论差异甚大。因此,草地早熟禾愈伤组织分化选用激素配比因品种而异。
4 结论
本研究结果表明,单独使用2,4-D时,“ABBY”组织培养的2,4-D最适浓度为3 mg·L-1。当2,4-D与6-BA的配合使用时,处理MS+1.0 mg·L-12,4-D+0.4 mg·L-16-BA的胚性愈伤组织出愈率为45.81%,且愈伤组织质量最好。因此,愈伤组织诱导培养中,处理MS+1 mg·L-12,4-D+0.4 mg·L-16-BA为草地早熟禾“ABBY”的最适试验配方。在分化培养中,处理MS+0.2 mg·L-1NAA +3 mg·L-16-BA为草地早熟禾“ABBY”最适的试验配方。
[1] 朱根发,余毓敏.草地早熟禾组织培养条件与分化能力研究[J].华中农业大学学报,1994,13(2):199.
[2] Li L,Qu R.Development of highly regenerable callus lines and biolistic transformation of turf-type common bermudagrass [Cynodondactylon(L.) Pers.][J].Plant Cell Reports,2004,22(6):403-407.
[3] 马忠华,张云芳,徐传祥,等.早熟禾的组织培养和基因枪介导的基因转化体系的初步建立[J].复旦大学学报,1999(10):540-544.
[4] McDonnell R E,Conger B V.Callus induction and plantlet formation from mature embryo explants of Kentucky bluegrass[J].Crop Science,1984,24(3):573-578.
[5] Boyd L A,Dale P J.Callus production and plant regeneration from mature embryos ofPoapratensisL[J].Plant Breeding,1986,97(3):246-254.
[6] Van der Valk P,Zaal M,Creemers-Molenaar J.Somatic embryogenesis and plant regeneration in inflorescence and seed derived callus cultures ofPoapratensisL(Kentucky bluegrass)[J].Plant Cell Reports,1989,7(8):644-647.
[7] Wu L,Jampates R.Chromosome number and isoenzyme variation in Kentucky bluegrass cultivars and plants regenerated from tissue culture[J].Cytologia,1986,51(1):125-132.
[8] Krans J V.Cell culture of turfgrasses[A].Proceedings of 4th International Turfgrass Research Conference[C].Ontario,Canada:University of Guelph,1981:27-33.
[9] Ke S,Lee C W,Cheng Z M.Genetic transformation of Kentucky bluegrass with therol-Cgene[J].Hort Science,1996,31(4):616.
[10] 信金娜,韩烈保,刘君,等.草地早熟禾愈伤组织诱导及植株再生[J].中国草地,2004,26(4):46-50.
[11] 皮伟,李名扬,郑丽.草地早熟禾组织培养研究[J].西南农业学报,2004,17(2):267.
[12] 赵小强,马晖玲,周万海.草地早熟禾再生体系建立的研究进展[J].草业与畜牧,2008(5):19-21.
[13] 高明,杨长海,谭旭华,等.冷地型草坪草组织培养现状及评述[J].吉林农业科学,2005,30(6):34-36.
[14] Bai Y,Qu R.Factors influencing tissue culture responses of mature seeds and immature embryos in turf type tall fescue[J].Plant Breeding,2000(2):239-242.
[15] 张文君,杨春华,刘帆,等.不同激素配比对草地早熟禾愈伤组织形成的影响[J].四川农业大学学报,2010,28(2):187-188.
[16] 丁路明,龙瑞军,朱铁霞.2,4-D和6-BA对早熟禾愈伤组织诱导的影响[J].草原与草坪,2003(5):34-37.
[17] 丁路明,龙瑞军,王长庭.肯塔基草地早熟禾愈伤组织的诱导及再生体系的建立[J].中国草地,2005,27(3):31-36.
