二次正交旋转组合设计优化青霉产α-葡萄糖苷酶培养基
2013-04-23陈桂光符佳精谷岭丽梁钰婷梁智群
陈桂光,符佳精,谷岭丽,梁钰婷,梁智群*
(广西大学 生命科学与技术学院,广西 南宁 530000)
α-葡萄糖苷酶(alpha-glucosidase,EC.3.2.l.20)系统命名为α-D-葡萄糖苷葡萄糖水解酶,又名α-转移葡萄糖苷酶,相对分子质量一般在40000u~145000u[1],其可以从低聚糖类底物的非还原末端切开α-1,4糖苷键,释放出葡萄糖或将游离出的葡萄糖残基转移到另一糖类底物形成α-1,6糖苷键,从而得到非发酵性的低聚异麦芽糖或糖酯、糖肽等[2-5]。
二次正交旋转组合设计[6-9]是旋转设计的一种,其不仅基本保留了回归正交设计的优点,还能根据测值,直接寻求最优区域[10],精确对试验数据进行准确有效的分析,从而得到最优工艺参数的一种试验设计方法化。这种实验设计方法已经被广泛应用于微生物培养基的优化[11-12]。
α-葡萄糖苷酶作为工业化生产低聚糖异麦芽(IMO)[13-15]最关键的酶而备受国内外食品界的重视。研究开发α-葡萄糖苷酶,提高低聚异麦芽糖产量,具有很广泛的应用价值。本研究以青霉作为发酵产酶菌种,采用二次正交旋转组合设计对产α-葡萄糖苷酶培养基进行了优化,提高α-葡萄糖苷酶活力,为低聚异麦芽糖的扩大发酵及工业化生产提供科学数据。
1 材料与方法
1.1 材料与仪器
青霉菌(Penicilliumsp.Mc221):由广西大学食品发酵所保存。
J2-21高速冷冻离心机;岛津高效液相色谱仪。
1.2 培养基
斜面保存培养基:PDA,自然pH值。
起始发酵培养基:10%麦芽糖、0.4%酵母膏、1%蛋白胨、0.05%MgSO4·7H2O、0.05%KH2PO4、自然pH值。
土豆汁:称取200g马铃薯,洗净去皮切成小块,加水煮沸30min用4层纱布过滤,稍冷却后再补足水分至1000mL。
麸皮汁:称取100g麸皮,加水煮沸40min用4层纱布过滤,稍冷却后再补足水分至1000mL。
以上培养基灭菌条件均为:121℃、20min。
1.3 主要试剂
麦芽糖、异麦芽糖、潘糖等标准品购自Sigma 公司,其他试剂均为国产分析纯。
1.4 酶活定义及测定方法
1.4.1 α-葡萄糖苷酶活力单位定义[16]
在40℃、pH5.0的条件下,每小时催化麦芽糖生成1μmol潘糖的酶量定义为1个酶活力单位(U/mL)。
1.4.2 酶活测定方法
离心收集1mL发酵液中的菌体,用无菌水漂洗3次后加入1mL 18 %(w/v)的麦芽糖标准溶液中(含0.2mol/L PBS,0.1%TtritonX-100,pH5.0),40℃反应2h;沸水中10min灭酶活后流水冷却至室温;12000r/min,离心10min后用0.45μm滤膜过滤得到样品溶液。空白:离心收集菌体后,沸水中10min灭酶活后流水冷却至室温,再加入麦芽糖标准液液中,其他操作与样品相同。用HPLCasil参照GB/T 20881-2007国家标准检测潘糖的生成量。
1.5 产酶培养基优化
1.5.1 单因素试验
以酶活力作为评价指标,对产酶影响较大的麦芽糖(1%~15%,w/v)、麸皮汁/土豆汁比(1/4~2/1,v/v)、蛋白胨(0.5%~3%,w/v)进行单因素优化,其实验结果见图1~图3。
由图1可知,在麦芽糖浓度为1%~10%时有利于产酶,麦芽糖浓度为5%时酶活力最大4.12U/mL。
由图2可知,菌株发酵产酶的活力随麸皮汁与土豆汁比值的增大先大后减小,麸皮汁与土豆汁比值在1/2~2/1之间时有利于产酶,当麸皮汁与土豆汁比值1/1时酶活力最大。
由图3可知,随蛋白浓度的逐渐增加,酶活力先增加后减小,蛋白胨浓度为0.5%~2%之间时有利于产酶,蛋白胨浓度为1%时有最大酶活力3.9U/mL。
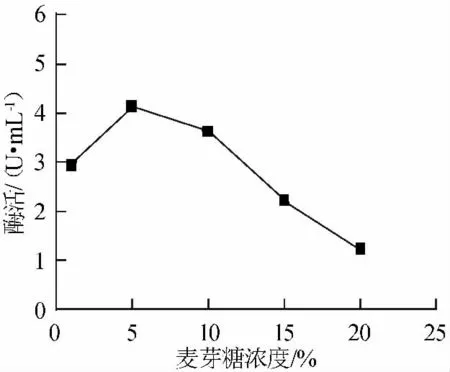
图1 麦芽糖浓度对产酶的影响Fig.1 Effect of maltose on enzyme production

图2 麸皮汁与土豆汁比值对产酶的影响Fig.2 Effect of bran juice/potato juice on enzyme production

图3 蛋白胨对产酶的影响Fig.3 Effect of peptone on enzyme production
1.5.2 二次正交旋转组合试验
根据单因素试验选择的3个对产酶的主要影响因子麦芽糖、麸皮汁/土豆汁、蛋白胨,采用3因素二次正交旋转组合的试验设计方法,首先,选择3因素的上下限值(Z1j,Z2j),根据公式:Z0j=(Z1j+Z2j)/2,△j=(Z2j-Z0j)/γ计算出零水平Z0j和变化间隔△j,编制因素水平编码表,见表1。根据软件中的3因素二次正交旋转设计试验方案进行试验。以α-葡萄糖苷酶活力作为响应值,并记录试验数据。麦芽糖、蛋白胨、麸皮汁/土豆汁与酶活力分别用X1、X2、X3、Y表示。
1.6 数据分析处理
采用DPS软件和Excel对数据分析处理及图形的制作,求得响应值最大时各培养基的最优配比。

表1 实验因素水平Table 1 Factors and levels of the experiment
2 结果与分析
2.1 产酶培养基数学模型的建立与检验
3因素二次正交旋转组合试验结果见表2。利用DPS软件数据处理系统对试验结果(表2)进行分析(表3),得到麦芽糖(X1)、蛋白胨(X2)、麸皮汁/土豆汁(X3)与酶活力(Y)的数学模型回归方程为:
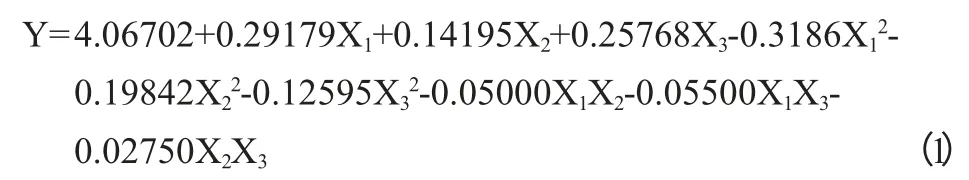
在显著水平为0.1的条件下,通过方差分析得出F失拟=0.74787<F0.01(5.8)=6.63,表明未知因素对试验结果影响很小,可以忽略,F回归=217.36494>F0.01(9.13)=4.19,达到极显著水平,说明模型成立。预测值和实际值吻合较好,此模型进行预报具有较高的可行性。

表2 3 因素二次正交旋转组合设计实验方案及结果Table 2 Design and result of quadratic orthogonal rotation

表3 实验结果方差分析表Table 3 Results and variance analysis
对回归系数进行显著性检验,在α=0.1显著水平剔除不显著项,得到优化后的方程为:

α-葡萄糖苷酶活力与麦芽糖、麸皮汁/土豆汁、蛋白胨的相关系数(R2)=回归平方和/总平方和=99.34%,表明该数学模型的3个因素对α-葡萄糖苷酶活力的影响占99.34%,其他因素的影响和误差占0.66%。
2.2 产酶培养基数学模型解析
2.2.1 单因子效应分析
由于设计中各因素处理进行正交编码,回归模型中的统计值已相对独立,反映各因素与试验结果的时候,只需要把其他2个因素固定在零水平上就可得到各因子与效价值的关系,得到的偏回归方程为:
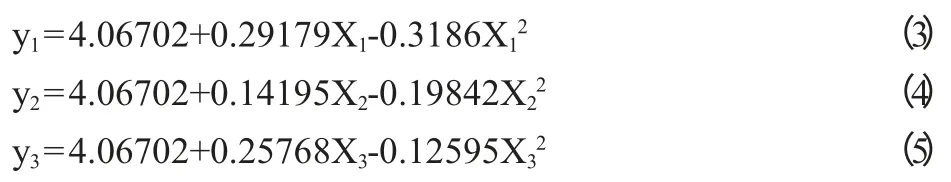
由以上3个方程得到单因子效应分析见图4。

图4 单因子效应Fig.4 Effect of single factor on enzyme activity
从图4可知,各因子相对重要性在不同的水平条件下表现是不同的。不同因子在不同的水平上能获得最高酶活力。在3个因素中麦芽糖含量的变化对酶活力影响较大,其他2个因素对酶活力的影响相对比较稳定。麦芽糖,麸皮汁/土豆汁,蛋白胨均成开口向下的抛物线,表明3因素均存在一个合理的范围,即对产酶的影响均是先上升后下降。
2.2.2 主效应分析
直接辨别法:根据偏回归系数b的绝对值可直接辨别各因子对产量的影响程度,由偏回归方程(3)、(4)、(5)可知:|b1|>|b3|>|b2|,即各因子对酶活力的影响程度大小依次为:麦芽糖,麸皮汁/土豆汁,蛋白胨。
2.2.3 两因子互作效应分析
根据表3二次多项模型极其各项的方差分析表可以看出,交互项X1X2、X1X3的p值均小于显著水平0.1,因此X1X2、X1X3交互作用显著,即麦芽糖与蛋白胨、麦芽糖与麸皮汁/土豆汁互作效应对产酶有明显影响。而X2X3的P值大于显著水平0.1,互作效应不明显。
对这两项对交互作用进行分析。把另外一个因素固定在零水平,得到交互作用方程:

由以上两个交互作用方程得到图5~图6。
5条曲线均成开口向下的抛物线,均有最大值,酶活力随交互作用变化先曾大后减小。由图2、图3可知,当蛋白胨比值一定时,随着麦芽糖的增加酶活力先增大后减小,这可能是因为麦芽糖作为底物随着麦芽糖浓度的增加对酶产生抑制作用,导致酶活力下降,当麦芽糖一定时,酶活力随蛋白胨的增加先增大后减小;当麸皮汁/土豆汁一定时,随着麦芽糖的增加酶活力先增大后减小,这可能是因为麦芽糖作为底物浓度增高对酶产生抑制作用;当麦芽糖一定时酶活力随麸皮汁/土豆汁比值的增加先增大后减小。

图6 X1(麦芽糖) 与X3(麦芽汁/土豆汁) 互作效应对产酶的影响Fig.6 Effect of interaction between X1(Maltose) and X3(Potato juice/Wort juice) on enzyme activity
2.3 产酶培养基模型的优化及验证
通过DPS软件对试验结果分析可知,酶活力大于3.69U/mL方案有24个(对于数学模型的分析见表6),通过软件寻优,在酶活力大于3.69U/mL的24个方案中,得到当响应值Y值(酶活力)为最大时,3个因素的水平取在代码值为(0、0、1),即当麦芽糖5.5%、蛋白胨1.25%、土豆汁/麦芽汁3/2。此时的酶活力达到最大Ymax为4.2U/mL。表4中的最佳方案就是产酶培养基的最优的优化区域范围。
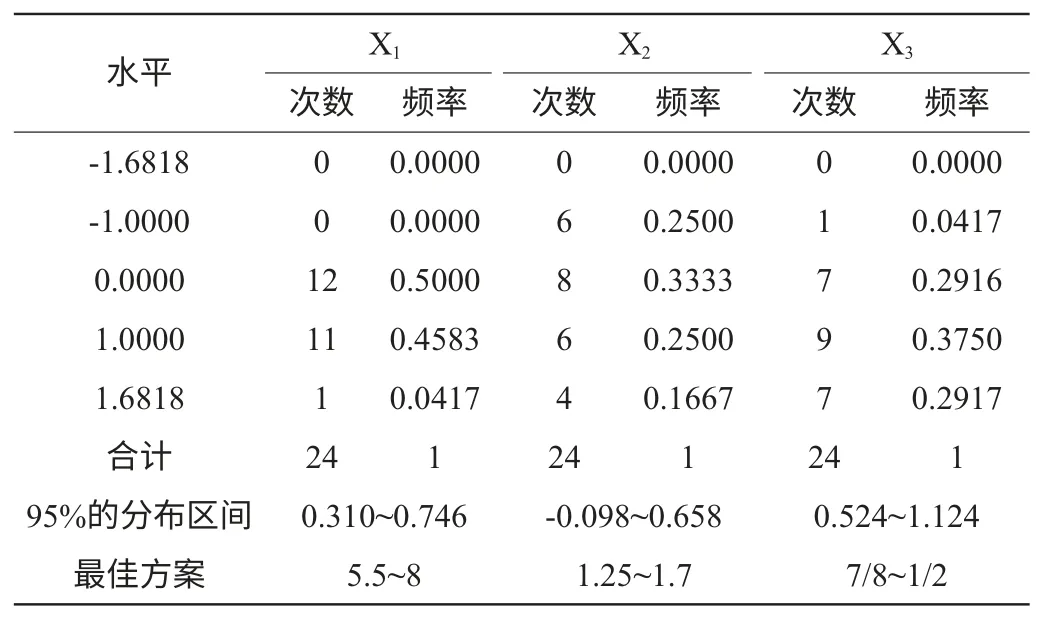
表4 酶活力大于3.69(u/ml)方案Xi 的频率分布表Table 4 Probability distribution of Xi in enzyme activity greater than 3.69(u/ml)
以优化得到的产酶培养基配比进行3 次重复发酵验证试验,分别测得酶活力Y值为4.19U/mL、4.24U/mL和4.26U/mL,平均值为4.23U/mL,试验值与模型的理论值相差0.03U/mL,与预测值4.2U/mL基本符合。
3 结论
(1)本研究采用3因素二次正交旋转组合试验法,建立了麦芽糖、麸皮汁/土豆汁、蛋白胨3个因素的回归模型:

(2)分析了3因素和因素之间作效应对产酶的影响,比较了3因素对产酶的影响大小为:麦芽糖>麸皮汁/土豆汁>蛋白胨。
(3)通过DPS软件分析并通过产酶试验验证得到青霉产α-葡萄糖苷酶培养基的最佳组合为麦芽糖5.5%、蛋白胨1.25%、土豆汁/麦芽汁3/2。此时酶活力达到4.23U/mL,比优化前酶活力2.49U/mL提高41.1%。
(4)本研究也证明了二次正交旋转组合设试验法能够快速、准确地对青霉产α-葡萄糖苷酶培养基中主要影响因子进行优化与评价,并能得到各因素最佳组合。
[1]CHEN DL,TONG X,CHEN SW,et al.Heterologous expression and biochemical characterization of a-glucosidase fromAspergillus nigerbyPichia pastroris[J].J Agric Food Chem,2010,58:4819-4824.
[2]胡学智,凌 晨,武 雯,等.葡萄糖苷转移酶生产菌种的筛选[J].工业微生物,1998,28(1):1-6.
[3]岳振峰,陈小霞,彭志英.α-葡萄糖转苷酶研究现状及进展[J].食品与发酵工业,2000(3):63-67.
[4]KITA A,MATSUI H,SOMOTO A,et al.Substrate specificity and subsite affinities of crystalline α-glucosidase fromAspergillus niger[J].Agric Biol Chem,1991,55(9):2327-2335.
[5]TAKEWAKI S,KIMURA A,KUBOTA M,et al.Substrate specificity and subsite affinities of honeybee α-glucosidase II[J].Biosci Biotech Biochem,1993,57(9):1508-1513.
[6]向东山.基于正交旋转组合设计的藤茶总黄酮提取工艺优化研究[J].中国酿造,2010,29(2):116-118.
[7]朱战波,刘 宇,贾永全,等.二次正交旋转组合设计优化罗伊乳杆菌发酵培养基[J].中国生物制品学杂志,2008,21(6):527-529.
[8]王晓玲,马美湖,蔡朝霞,等.二次正交旋转组合设计法优化咸蛋清酶解条件[J].食品工业科技,2010(1):227-229.
[9]方 芳,许凯扬,罗忠银,等.二次正交旋转组合设计优化水酶法提取猕猴桃籽油的工艺[J].中国粮油学报,2013,28(1):55-59.
[10]王 惠,吴兆亮,童应凯,等.应用二次回归正交旋转组合设计优化黄霉素发酵培养基[J].食品研究与开发,2006,27(6):19-22,64.
[11]NIKEL PI,PETTINARI MJ,MENDEZ BS,et al.Statistical optimization of a culture medium for biomass and poly(3-hydroxybutyrate)production by a recombinant Escherichia coli strain using agroindustrial byproducts[J].Int Microbiol,2005,8(4):243-250.
[12]LIEW SL,ARIFF AB,RAHA AR,et al.Optimization of medium composition for the production of a probiotic microorganism,Lactobacillus rhamnosus,using response surface methodology[J].Int J Food Microbiol,2005,102(2):137-142.
[13]辛修锋,黄 婧,杨海军.益生元低聚异麦芽糖保健泡腾片的研制[J].中国酿造,2008,27(7):62-64.
[14]LIN Q,XIAO H,ZHAO J,et al.Production of isomalto-oligosaccharide syrup from rice starch using an one-step conversion method [J].Int J Food Sci Technol,2011,46(6):1194-1200.
[15]LEE CC,WANG HF,LIN SD.Effect of isomaltooligosaccharide syrup on quality characteristics of sponge cake[J].Cereal Chem,2008,85(4):515-521.
[16]SHEU DC,DUAN KJ,LIN CT.Purification and characterization of α-glucosidase from Aspergillus carbonarious[J].Biotechnol Tech,1994,8(7):515-520.
