慢性炎症性脱髓鞘性多发性神经根神经病自主神经损害对交感神经皮肤反应和自主神经症状量表评分的影响研究
2013-04-21姜雅芬尹厚民余建军张宝荣
姜雅芬,尹厚民,余建军,张宝荣
慢性炎症性脱髓鞘性多发性神经根神经病(chronic inflammatory demyelinating polyradiculoneuropathy,CIDP)是一组免疫介导的获得性周围神经系统脱髓鞘性疾病,临床表现复杂,以基本对称性的肢体瘫痪、腱反射减弱或消失为主要特征,常有感觉障碍,但较少有自主神经系统的症状[1]。目前多通过临床表现来诊断自主神经的受损情况。本研究通过对29例CIDP患者进行交感神经皮肤反应(sympathetic skin response,SSR)检查及自主神经症状量表(autonomic symptom profile,ASP)评分,探讨CIDP患者发生自主神经损害时两者的变化,以资临床参考借鉴。
1 资料与方法
1.1 一般资料 收集2011年1月—2012年7月在浙江大学医学院附属第二医院(包括宁波市第二医院转诊病例)的CIDP患者29例作为病例组,其中男15例,女14例;年龄21~78岁,平均(48.7±18.2)岁。均符合2010年中国CIDP诊疗指南中的诊断标准[2]:(1)症状进展超过8周,慢性进展或缓解复发;(2)临床表现为不同程度的肢体麻木无力、四肢腱反射减低或消失,可伴有深、浅感觉异常;(3)脑脊液蛋白-细胞分离;(4)电生理检查示周围神经传导速度减慢、传导阻滞或异常波形离散;(5)糖皮质激素治疗有效;(6)除外其他原因引起的周围神经病及任何影响自主神经系统的疾病,如糖尿病、脑卒中、多发性硬化、帕金森病、副瘤综合征、吉兰-巴雷综合征(GBS)等;无心律失常及异常心电图表现,检测前未经特殊治疗,未服用影响自主神经活性的药物,检测时无呼吸困难和电解质紊乱。29例患者的病程均超过2个月,以肢体的麻木乏力为主诉,其中1例为复发缓解型,复发前1个月内有感冒史,其余28例均为缓慢进展型,均无明显的前驱感染症状。选择同期健康体检者30例作为对照组,其中男15例,女15例;年龄20~80岁,平均(48.8±17.0)岁。无外周、中枢神经系统疾病及内科系统疾病,神经系统查体无异常。两组受试者均给予医院焦虑抑郁量表(hospital anxiety and depression scale,HADS)评分,分值均小于7分。两组在性别(χ2=0.018)、年龄(t=0.0218)方面差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 SSR检测方法 采用俄罗斯产的NUROSOFT肌电诱发电位仪刺激和记录。在室温22~25 ℃、安静明亮的室内,受试者放轻松、仰卧,皮肤温度保持在32~35 ℃。清洁受试者皮肤,记录电极采用表面电极,分别置于两侧手掌(或足心),参考电极置于两侧掌背(或足背)。刺激电极分别置于腕部横纹带处正中神经或距小腿关节胫神经处,分别检查双侧的上、下肢。刺激电流波宽0.2 ms,电流强度20~30 mA,予以无规律刺激,刺激间隔>60 s。上、下肢分别刺激2次。分别记录上、下肢SSR的起始潜伏期和峰波值。SSR异常判断标准:(1)波形消失;(2)潜伏期>对照组均值+3 s;(3)波幅<正常均值的70%。
1.2.2 自主神经症状评估 (1)根据临床表现及临床常用自主神经功能检查(眼心反射、卧立位试验、皮肤划痕试验、Valsalva动作),并由两位主任医师确定是否存在自主神经症状。(2)ASP评定[3-4],由受试者填写量表,无法完成时由试验实施者提问并填写,试验实施者统计其得分,男性总分200分,女性170分,≤22分为正常,>22分为异常,分值越高自主神经系统受损越严重。

2 结果
2.1 SSR结果分析
2.1.1 病例组单肢或单肢以上SSR异常率为75.9%(22/29),其中波形消失4例、波幅降低18例、潜伏期延长6例;对照组中30例上、下肢SSR均正常,异常率为0(0/30)。病例组异常率高于对照组,差异有统计学意义(χ2=36.291,P=0.000)。
2.1.2 病例组较对照组上、下肢SSR波幅均降低,且差异有统计学意义(P<0.01);而两组上、下肢SSR潜伏期比较,差异均无统计学意义(P>0.05,见表1)。
2.1.3 病例组上肢SSR异常率为86.2%(50/58),其中5肢潜伏期延长、43肢波幅降低、2肢未引出波形。下肢SSR异常率为81.0%(47/58),其中4肢潜伏期延长、39肢波幅降低、5肢未引出波形。病例组上、下肢SSR异常率比较,差异无统计学意义(χ2=0.566,P=0.452)。
2.2 ASP结果分析
2.2.1 病例组ASP评分异常率为65.5%(19/29),对照组ASP评分异常率为0(0/30),病例组高于对照组,差异有统计学意义(χ2=28.991,P=0.000)。
2.2.2 病例组ASP评分中位数为25.35分,对照组为12.58分,病例组高于对照组,差异有统计学意义(u=17.000,P=0.000)。
2.3 CIDP患者的检查结果
2.3.1 病例组SSR异常率与ASP评分异常率比较,差异无统计学意义(χ2=0.749,P=0.387)。
2.3.2 自主神经症状的临床表现 所有CIDP患者中临床表现有自主神经症状者9例,1例皮肤变薄无汗,1例双下肢色素沉着,2例便秘,4例出汗增多,1例窦性心动过速,1例直立性低血压,1例性功能异常,其异常率为31.0%,与SSR异常率(75.9%)比较,差异有统计学意义(χ2=11.711,P=0.001),与ASP评分异常率(65.5%)比较,差异有统计学意义(χ2=6.905,P=0.009)。
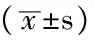
Table1 Comparison of SSR amplitude and latency period in upper and lower limbs between the two groups

组别例数上肢SSR波幅(mV) 潜伏期(s)下肢SSR波幅(mV) 潜伏期(s)对照组3034±15148±02315±09206±042病例组2912±10150±04906±07204±090t值-92020299-7870-0111P值0000076500000912
3 讨论
临床上明显的自主神经功能异常经常出现在急性神经病变中,如GBS[5-6]。有报道示约有90%的GBS患者有自主神经病变[5],亚临床的自主神经功能异常也经常在GBS患者中出现[7],但CIDP患者很少出现自主神经功能失常[8],而比较常见的自主神经症状有:肢体水肿,肢体色素沉着,出汗异常,心律失常,尿、便障碍等[9-11]。ASP是一个评价自主神经症状的具体量表,主要表现在直立耐受、血管舒缩、分泌、胃轻瘫、腹泻、便秘、男性性功能、膀胱功能、瞳孔运动、睡眠、反射性晕厥等11个方面,内容实用有效[3],常被临床用来评价自主神经功能的变化。本研究结果显示,病例组ASP评分异常率为65.5%,明显高于对照组,说明CIDP患者中自主功能损害症状也较常见,但其中位数仅为25.35分,表明自主神经系统功能损害总体程度较轻。
SSR是一种与汗腺活动有关,能反映交感神经节后纤维功能状态的表皮电位。因其检测方法简便、敏感、可靠、定量且无创,近年来被广泛应用于多种疾病的自主神经功能方面的研究,如GBS[12]、糖尿病周围神经病[13]、帕金森病[14]等。目前关于SSR检测CIDP患者自主神经功能的研究在国外仅有两项研究报道,一项是Lyu等[15]报道在12例CIDP患者中,应用SSR检测,发现6例患者有自主神经功能障碍,异常率50.0%;另一项是Stamboulis等[16]报道在17例CIDP患者中进行自主神经功能测试,其中一项是SSR检测,结果提示11例出现自主神经功能障碍,异常率为64.7%,而国内尚无相关报道。本研究通过分析29例我国成人CIDP患者SSR的变化特点,探讨其在CIDP自主神经损害中的诊断价值。本研究显示,29例CIDP患者中22例SSR异常,异常率为75.9%,与国外的研究报道基本相符。
CIDP患者常有感觉神经的损害,但以粗大的有髓神经纤维为主。SSR波幅反映的是有分泌活性的汗腺的密度,因而是反映外周交感神经活性的可靠指标[17-18];波形则反映了与汗腺活动有关的表皮电压变化,该变化是由交感神经节后无髓鞘C型胆碱能纤维支配,能被交感神经切除术及阿托品的离子电渗透所阻滞[18]。因此SSR反映的是节后交感纤维的功能状况。本研究中病例组的SSR异常率较对照组明显增高,波幅明显降低,提示CIDP患者的外周交感神经活性降低,交感神经节后纤维功能受损。SSR潜伏期反映的是引起催汗神经冲动在整个反射弧中的传导时程,是相对较为稳定的一个观测指标,本研究的结果提示两组SSR的潜伏期无明显差异,也证实了这点。本研究也显示病例组上、下肢的SSR异常率无统计学差别,提示CIDP患者上、下肢自主神经损害程度相仿,其原因可能与CIDP的发病机制有关,周围神经均可受累,也与临床表现上的对称性病变相符。
此外,本研究结果还显示,病例组的SSR及ASP评分异常率均显著高于对照组,同时也明显高于出现临床自主神经症状的比例(9例,31.0%),但两者间并无明显差异,提示SSR及ASP均可以发现CIDP的自主神经损害,有助于发现亚临床病变,对自主神经损害的诊断价值更大。但是,本研究29例CIDP患者中出现临床自主神经功能症状的有9例(31.0%),多于以往的报道(17.3%)[19],这可能与该研究的样本量较少有关,期待大样本的研究。
综上所述,CIDP患者除了出现明显的临床或亚临床自主神经病变表现外,SSR检测或ASP评分也会发生改变,若有异常,则需引起重视,积极寻找病因,及时干预及治疗,提高患者的生活质量。SSR及ASP两种方法各有所长,ASP内容丰富,包括了副交感神经症状,如排便困难、阳痿等,而SSR操作简单、无创、可靠且定量,作为一种评价CIDP自主神经功能变化的客观、量化电生理指标,为临床进一步研究提供参考依据。
1 Patel K,Bhanushal M,Muley SA.Management strategies in chronic inflammatory demyelinating polyradiculoneuropathy[J].Neurol India,2010,58(3):351.
2 中华医学会神经病学分会神经肌肉病学组,中华医学会神经病学分会肌电图及临床神经电生理学组,中华医学会神经病学分会神经免疫学组.中国慢性炎性脱髓鞘性多发性神经根神经病诊疗指南[J].中华神经科杂志,2010,43(8):586.
3 Suarez GA,Opfer-Gehrking TL,Offord KP,et al.The Autonomic Symptom Profile:a new instrument to assess autonomic symptoms[J].Neurology,1999,52(3):523-528.
4 Low PA,Benrud-Larson LM,Sletten DM,et al.Autonomic symptoms and diabetic neuropathy:a population-based study[J].Diabetes Care,2004,27(12):2942-2947.
5 Flachenecker P,Wermuth P,Hartung HP,et al.Quanitative assessment of cardiovascular autonomic function in Guillain-Barreé syndrome[J].Ann Neurol,1997,42(2):171-179.
6 Zochodne DW.Autonomic involvement in Guillain-Barré syndrome:a review[J].Muscle Nerve,1994,17(10):1145-1155.
7 Lyu RK,Tang LM,Hsu WC,et al.A longitudinal cardiovascular autonomic function study in mild Guillain-Barré syndrome[J].Eur Neurol,2002,47(2):79-84.
8 Gorson KC,Allam G,Ropper AH.Chronic inflammatory demyelinating polyneuropathy:clinical features and response to treatment in 67 consecutive patients with and without a monoclonal gammopathy[J].Neurology,1997,48(2):321-328.
9 Boukhris S,Magy L,Li Y,et al.Autonomic nervous system involvement in chronic inflammatory demyelinating polyneuropathy[J].Rev Neurol,2005,161(12):1228-1231.
10 张宁,李刚,肖波,等.老年人慢性炎症性脱髓鞘性多发性神经病临床病理分析[J].中华老年医学杂志,2008,27(8):579-581.
11 卢希,沈雪莉.慢性吉兰-巴雷综合征应用激素的治疗分析[J].中国医学工程,2012,1(1):62-63.
12 孙瑶,谢炳玓,姚源蓉.交感神经皮肤反应和R-R间期变化率对诊断格林巴利综合征自主神经损害的意义[J].山东医药,2011,51(9):4-6.
13 Sun PC,Chen CS,Kuo CD,et al.Impaired microvascular flow motion in subclinical diabetic feet with sudomotor dysfunction[J].Microvasc Res,2012,83(2):243-248.
14 Giza E,Katsarou Z,Georgiadis G,et al.Sympathetic skin response in Parkinson′s disease before and after mental stress[J].Neurophysiol Clin,2012,42(3):125-131.
15 Lyu RK,Tang LM,Wu YR,et al.Cardiovascular autonomic function and sympathetic skin response in chronic inflammatory demyelinating polyradiculoneuropathy[J].Muscle Nerve,2002,26(5):669-672.
16 Stamboulis E,Katsaros N,Koutsis G,et al.Clinical and subclinical autonomic dysfunction in chronic inflammatory demyelinating polyradiculoneuropathy[J].Muscle Nerve,2006,33(1):78-84.
17 Arunodaya GR,Taly AB.Sympathetic skin response adecade later[J].J Neurol Sci,1995,129(2):812-891.
18 Knezevic W,Bajada S.Pripheral autonomic surface potential:a quantitative technique for recording sympatric conduction in man[J].J Neural Sci,1985,67(2):239-251.
19 尹燕红,李国忠.380例慢性炎性脱髓鞘性多发性神经病临床特征分析[J].中国神经免疫学和神经病学杂志,2009,16(3):243.
