瘦素和瘦素受体及其下游信号通路在非酒精性脂肪性肝病中的表达及临床意义研究
2013-04-21黄晓东
徐 丹,黄晓东,张 姮,吴 杰
非酒精性脂肪性肝病(NAFLD)是慢性肝病最常见的病因之一,其发病机制目前尚未明确[1]。NAFLD与胰岛素抵抗有关,而胰岛素抵抗患者常伴有高瘦素血症。瘦素是近年来发现的调节机体内分泌和能量代谢的重要肽类激素,具有细胞因子的特性,通过与相应的瘦素受体结合发挥作用,瘦素对能量摄入和消耗起关键调节作用[2-3]。瘦素与瘦素受体结合调节多种细胞内信号通路,既往研究较多的是Janus激酶和信号传导及转录激活因子(JAK-STAT)信号通路、丝裂原活化蛋白激酶(MAPK)通路[4],而对于磷脂酰肌醇3-激酶(PI3-K)通路的报道较少。然而,瘦素、瘦素受体、PI3-K及蛋白激酶B(PKB)在NAFLD的发病机制中所起的作用仍不清楚,本研究旨在通过检测瘦素、瘦素受体及其下游信号通路在NAFLD患者中的表达,探讨其在NAFLD发生及发展中的意义。
1 资料与方法
1.1 临床资料 选取2007年5—9月武汉市中心医院肝胆外科收治的术前B超诊断为脂肪肝,术中肝穿刺活组织检查证实为NAFLD 的患者30例为NAFLD组,其中男15 例,女15 例;年龄38~56岁,平均(42.0±8.4)岁。NAFLD诊断标准参见NAFLD诊疗指南(中华医学会肝脏病学分会脂肪肝和酒精性肝病学组2010年1月修订)。另选择同时期因胆囊结石(静止期)及胆囊息肉住院的肝功能正常者30例为对照组,其中男14 例,女16例;年龄39~55岁,平均(43.9±8.4)岁。两组患者性别构成和年龄分布具有均衡性。术中经皮肝穿刺活组织等检查均征得患者知情同意。
1.2 血清瘦素水平测定 过夜禁食14 h,于清晨空腹卧位取肘静脉血8 ml,5 ml送检生化检查,3 ml离心取上清,-70 ℃冰箱保存。采用放射免疫法(RIA),应用竞争机制原理,标准或样品中的瘦素和加入的125I-瘦素共同与一定量的特异性抗体产生竞争性免疫反应。125I-瘦素与抗体的结合量与标准或样品中瘦素的水平呈一定的函数关系。用免疫分离试剂将结合部分(B)与游离部分(F)分离后,测定结合部分的放射性强度,并计算相应结合率(B/B0)。用已知标准瘦素水平与对应结合率作图,即得标准抑制曲线。从标准抑制曲线上查出对应结合率在待测样品中的水平。
1.3 免疫组织化学法 将肝脏组织取出后在4%多聚甲醛固定液中4 ℃固定16~18 h,脱水、透明、包埋、切片、常规脱水,3%过氧化氢孵育10 min后用蒸馏水冲洗,磷酸盐缓冲液(PBS)浸泡,再滴加封闭用正常血清工作液室温孵育10 min,倾去,然后分别滴加抗瘦素多克隆抗体(美国富吉瑞必欧诊断公司,1∶100)、抗瘦素受体多克隆抗体(北京博奥森生物技术有限公司,1∶100)、抗PI3-K(p85α)多克隆抗体(美国BD Biosciences Pharmingen公司,1∶100)及抗PKB多克隆抗体(美国Cell Signaling公司,1∶100),置湿盒密闭,4 ℃过夜。加入生物素化的抗鼠免疫球蛋白及辣根过氧化物酶标记的链霉亲和素(美国Vector Laboratories,Burlingame公司)(1∶50),常温下作用1 h,避光,PBS冲洗,最后以50%甘油封片在ZEISS显微镜下观察并照相。应用计算机病理图像分析系统,测定瘦素、瘦素受体、PI3-K(p85α)及PKB阳性表达的平均光密度值,随机测定5个高倍视野后计算平均值作为该切片的代表值。

2 结果
2.1 对照组与NAFLD组血清瘦素水平比较 对照组血清瘦素水平为(5.55±1.96)μg/L,NAFLD组为(10.90±3.39)μg/L,差异有统计学意义(t=-7.481,P<0.004)。
2.2 免疫组织化学结果 瘦素、瘦素受体、PI3-K(p85α)、PKB主要表达于肝细胞胞质中,为褐色颗粒状;NAFLD组患者肝细胞核中瘦素和PI3-K(p85α)强表达(见图1)。NAFLD组较对照组肝细胞瘦素、瘦素受体及PI3-K(p85α)光密度值增高,PKB光密度值降低,差异均有统计学意义(P<0.05,见表1)。
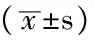
Table1 Comparison of the optical density of leptin,OB-R,PI3-K(p85α) and PKB between the two groups

组别例数瘦素瘦素受体PI3-K(p85α)PKB对照组30029±003031±033025±005048±004NAFLD组30047±009048±008045±008025±005t值-9767-11004-1182919862P值0000000000120027
注:PI3-K=磷脂酰肌醇3-激酶,PKB=蛋白激酶B
2.3 血清瘦素水平及肝细胞中瘦素、瘦素受体、PI3-K(p85α)、PKB光密度值相关性分析 NAFLD组患者血清瘦素水平与肝细胞中瘦素光密度值呈正相关(r=0.413,P<0.05,见图2);肝细胞中瘦素光密度值与PI3-K(p85α) 光密度值呈正相关 (r=0.365,P<0.05,见图3);肝细胞中PI3-K(p85α) 光密度值与PKB光密度值呈负相关(r=-0.854,P<0.01,见图4);血清瘦素水平与肝细胞中PKB光密度值呈负相关(r=-0.923,P<0.01,见图5)。对照组患者血清瘦素水平与肝细胞中瘦素光密度值呈正相关(r=0.593,P<0.05,见图6);肝细胞中瘦素光密度值与PI3-K(p85α) 光密度值呈正相关(r=0.795,P<0.01,见图7);肝细胞中PI3-K(p85α) 光密度值与PKB光密度值呈正相关 (r=0.840,P<0.01,见图8);血清瘦素水平与PKB光密度值呈正相关(r=0.686,P<0.01,见图9)。
3 讨论
NAFLD患者存在瘦素抵抗[5]。Huang等[6]报道瘦素/PI3-K激活Akt的缺陷可能是糖尿病患者存在瘦素抵抗的一种新的机制。瘦素参与了肝脏脂肪浸润、炎症发生以及最终纤维变性过程,导致肝脏损伤[7]。有学者证明瘦素通过促进胰岛素抵抗和改变肝实质细胞中的胰岛素信号,促进肝细胞中脂肪酸含量增加,在肝脂肪变性发展中起着关键作用[8]。
瘦素可以模拟胰岛素通过PI3-K途径发挥对葡萄糖转运和糖原合成的作用,瘦素激活的JAK2引致胰岛素受体底物(IRS)-2酪氨酸磷酸化从而进一步激活PI3-K,提示JAK2和IRS-2将瘦素的信号转导通路与胰岛素的信号转导通路耦合起来[9],PI3-K上的p85亚基与IRS,主要与IRS-1上特异的酪氨酸残基结合,接近胰岛素受体并被锚定在细胞膜。瘦素活化的磷酸化PI3-K激活催化第二信使PI-3,4,5磷酸盐(PIP3)的形成,从而进一步激活下游的目标,即PKB[10-11]。PI3-K是由一个的调解亚基(p85,分子量85 kDa)和一个催化亚基(p110,分子量110 kDa)组成的异二聚体复合物。p85表达最丰富的亚基是p85α。过度表达的PI3-K p85亚基可以竞争性抑制p85-p110二聚体和IRS-1相结合,从而抑制了PI3-K的活性[12-16]。与之相反,抑制p85亚基的表达,可以提高p85-p110二聚体与 p85单体之间的比例,从而改善瘦素活化的PI3-K介导的胰岛素信号转导,最终产生多种生物学效应,如调节葡萄糖转运、糖原合成、蛋白合成、抗脂肪分解和抑制细胞凋亡等。

注:A瘦素在对照组的表达,B瘦素在NAFLD组的表达;C瘦素受体在对照组的表达;D瘦素受体在NAFLD组的表达;E PI3-K(p85α)在对照组的表达;F PI3-K(p85α)在NAFLD组的表达;G PKB在对照组的表达;H PKB在NAFLD组的表达
图1 免疫组织化学法显示瘦素、瘦素受体、PI3-K、PKB在对照组和NAFLD组患者肝细胞中的表达
Figure1 The expression of leptin,OB-R,PI3-K and PKB in the two groups

图2 NAFLD组患者血清瘦素水平与肝细胞中瘦素光密度值相关性分析
Figure2 Correlation between serum leptin level and the optical density of leptin in NAFLD group

图3 NAFLD组患者肝细胞中瘦素光密度值与PI3-K(p85α) 光密度值相关性分析
Figure3 Correlation between the optical density of leptin and PI3-K(p85α) in NAFLD group
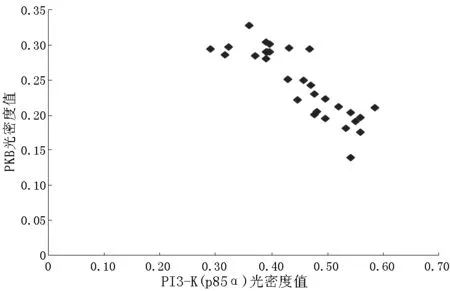
图4 NAFLD组患者肝细胞中PI3-K(p85α) 光密度值与PKB光密度值相关性分析
Figure4 Correlation between the optical density of PI3-K(p85α) and PKB in NAFLD group

图5 NAFLD组患者血清瘦素水平与PKB光密度值相关性分析
Figure5 Correlation between serum leptin level and the optical density of PKB in NAFLD group

图6 对照组患者血清瘦素水平与肝细胞中瘦素光密度值相关性分析
Figure6 Correlation between serum leptin level and the optical density of leptin in control group

图7 对照组患者肝细胞中瘦素光密度值和PI3-K(p85α) 光密度值相关性分析
Figure7 Correlation between the optical density of leptin and PI3-K(p85α) in control group

图8 对照组患者肝细胞中PI3-K(p85α) 光密度值与PKB光密度值相关性分析
Figure8 Correlation between the optical density of PI3-K(p85α) and PKB in control group
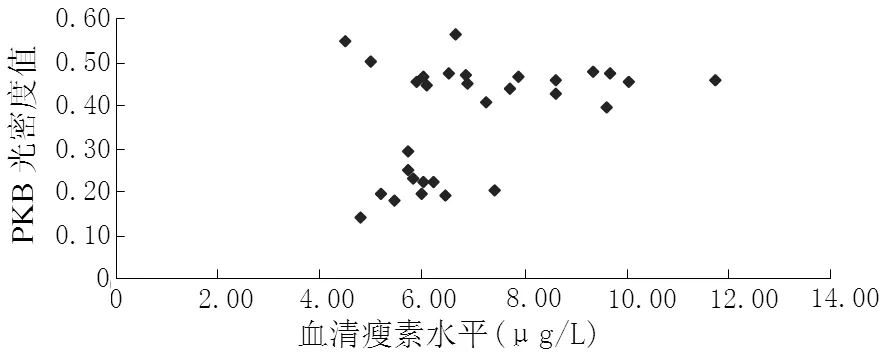
图9 对照组患者血清瘦素水平和肝细胞中PKB光密度值相关性分析
Figure9 Correlation between serum leptin level and the optical density of PKB in control group
瘦素抵抗与瘦素信号的缺陷在饮食诱导的肥胖发生中起重要作用[17-19]。本研究中对照组血清瘦素水平与肝细胞中瘦素及PKB的光密度值均呈正相关,表明正常生理状态下,瘦素可以有效地激活PI3-K,瘦素活化的磷酸化PI3-K进一步激活下游目标即PKB,从而发挥多种生物学效应。与之相反,在NAFLD组中,随着NAFLD患者中血清瘦素水平升高,肝细胞中的瘦素表达增加,PKB表达下降。分析其原因可能是由于升高的瘦素过度激活了PI3-K(p85α),导致自由p85和p85-p110复合物之间的失衡,过度表达的PI3-K(p85α)竞争性抑制p85-p110二聚体和IRS-1相结合,从而抑制了PI3-K的活性,不能有效激活PKB,导致PKB的表达下降,从而产生瘦素抵抗。
NAFLD患者中血清瘦素水平增高,肝细胞中瘦素及瘦素受体表达增多,增多的瘦素与瘦素受体结合,过度激活了PI3-K,反而导致PKB的减少,下调的PKB与NAFLD的进展有关,从而说明NAFLD中存在瘦素抵抗,而瘦素/PI3-K/PKB信号通路激活的缺陷可能是NAFLD的一种新的瘦素抵抗机制。总而言之,瘦素在NAFLD的发生、发展中起着重要的作用,如何将瘦素用于NAFLD的临床治疗及预防,将是下一步研究的重点。
1 王亚东,张英泽,赵彩彦,等.性激素在非酒精性脂肪性肝病发病机制中的作用[J].中华肝脏病杂志,2012,20(5):398-400.
2 Procaccini C,Galgani M,De Rosa V,et al.Leptin:the prototypic adipocytokine and its role in NAFLD[J].Curr Pharm Des, 2010,16 (17):1902-1912.
3 Medici V,Ali MR,Seo S,et al.Increased soluble leptin receptor levels in morbidly obese patients with insulin resistance and nonalcoholic fatty liver disease[J].Obesity(Silver Spring),2010,18(12):2268-2273.
4 Tsuchiya H,Ikeda Y,Ebata Y,et al.Retinoids ameliorate insulin resistance in a leptin-dependent manner in mice[J].Hepatology,2012,56(4):1319-1330.
5 马向华,王维敏.非酒精性脂肪肝患者瘦素抵抗和胰岛素抵抗研究[J].中华肝脏病杂志,2004,12(11):651-655.
6 Huang W,Dedousis N,Bhatt BA,et al.Impaired activation of phosphatidylinositol 3-kinase by leptin is a novel mechanism of hepatic leptin resistance in diet-induced obesity[J].J Biol Chem,2004,279(21):21695-21700.
7 Valentini L,Gläser S,Schuetz T,et al.Serum bile acids and leptin interact with glucose metabolism in patients with liver cirrhosis[J].Clin Nutr,2013,32(1):122-129.
8 Safar Zadeh E,Lungu AO,Cochran EK,et al.The liver diseases of lipodystrophy:the long-term effect of leptin treatment[J].J Hepatol,2013,59(1):131-137.
9 谢平,宁惠萍.胰岛素信号蛋白与胰岛素抵抗[J].国外医学病理、生理科学与临床分册,2001,21(1):48-50.
10 Alvarez G,Visitación Bartolomé M,Miana M,et al.The effects of adiponectinand leptin on human endothelial cell proliferation:a live-cell study[J].J Vasc Res,2012,49(2):111-122.
11 Osaki M,Oshimura M,Ito H.PI3K-Akt pathway:its functions and alterations in human cancer[J].Apoptosis,2004,9(6):667-676.
12 Ueki K,Fruman DA,Brachmann SM,et al.Molecular balance between the regulatory and catalytic subunits of phosphoinositide 3-kinase regulates cell signaling and survival[J].Mol Cell Biol,2002,22(3):965-977.
13 Jamieson S,Flanagan JU,Kolekar S,et al.A drug targeting only p110α can block phosphoinositide 3-kinase signalling and tumour growth in certain cell types[J].Biochem J,2011,438(1):53-62.
14 Mauvais-Jarvis F,Ueki K,Fruman DA,et al.Reduced expression of the murine p85alpha subunit of phosphoinositide 3-kinase improves insulin signaling and ameliorates diabetes[J].J Clin Invest,2002,109(1):141-149.
15 Ueki K,Fruman DA,Uballe CM,et al.Positive and negative roles of p85 alpha and p85 beta regulatory subunits of phosphoinositide 3-kinase in insulin signaling[J].J Biol Chem,2003,278(48):48453-48466.
16 Chan CB,Liu X,He K,et al.The association of phosphoinositide 3-kinase enhancer A with hepatic insulin receptor enhances its kinase activity[J].EMBO Rep,2011,12(8):847-854.
17 Berbari NF,Pasek RC,Malarkey EB,et al.Leptin resistance is a secondary consequence of the obesity in ciliopathy mutant mice[J].Proc Natl Acad Sci USA,2013,110(19):7796-7801.
18 李异玲,杨淼,傅宝玉.非酒精性脂肪性肝病患者血清瘦素水平变化及其相关因素分析[J].中国全科医学,2010,13(3):895.
19 陈劲松,陈瑞香,周燕飞,等.不同他汀类药物对代谢综合征患者血清脂联素和瘦素的影响研究[J].实用心脑肺血管病杂志,2011,19(10):1659.
