微小RNA-26b在乳腺癌中的作用及其分子机制研究
2013-04-20徐丽平
徐丽平,李 佳,房 林
乳腺癌是女性最常见的恶性肿瘤之一,根据美国2010年发布的数据,2009年全美女性新发乳腺癌207 090例,高居榜首,远超过第2位消化系统肿瘤125 790例,乳腺癌死亡共39 840例[1]。2003—2007年我国乳腺癌发病率41.64/10万,居女性癌症发病的第1位,死亡率 9.63/10万,居女性肿瘤死亡率的第6位[2]。因此乳腺癌已成为严重威胁全世界女性生命的疾病之一。研究表明微小RNA(microRNAs)是一组非编码RNA,通过作用于mRNA使其降解或抑制翻译,调控基因的表达,从而参与细胞的增殖、凋亡、细胞分化、肿瘤的侵袭转移以及肿瘤干细胞调控等[3-6]。微小RNA-26b(miR-26b)在肝细胞癌、肺癌、乳腺癌和膀胱癌等多种肿瘤中表达异常,其在不同肿瘤中扮演着癌基因或者抑癌基因的角色[7-11]。本研究采用荧光定量反转录聚合酶链式反应(RT-PCR)检测miR-26b在乳腺癌及正常乳腺组织中表达水平,MTT法分析其对于乳腺癌MBA-MD-231细胞增殖的影响,并寻找其可能靶基因。
1 资料与方法
1.1 一般资料 选取上海市同济大学附属第十人民医院甲乳外科2010年1月—2012年5月术后病理确诊为乳腺癌的女性患者38例,年龄35~82岁,中位年龄52岁;术前均未行化疗、放疗及内分泌治疗。取乳腺癌组织,并取距离肿瘤组织>5 cm正常乳腺组织作为对照。随访时间为行手术治疗后至2013年4月,患者术后均接受化疗,目前均无复发转移。人乳腺癌MBA-MD-231细胞株购于中国科学院。
1.2 microRNAs提取和反转录 按照Tiangen公司miRcute microRNA提取分离试剂盒说明书进行操作。microRNAs反转录参照Chen等[12]的方法,通过特异茎环引物,按照下列顺序在PCR试管中加入反应物(体积为8.6 μl):超纯水 2 μl,5×buffer 1.7 μl,microRNAs茎环引物(各个microRNAs及内参U6)1.9 μl,反转录酶(Primescript RT Enzyme MixI) 1 μl,microRNAs sample 2 μl。反应条件为:16 ℃ 30 min,42 ℃ 30 min,85 ℃ 8 min,4 ℃ 10 min,反应结束后置于4 ℃冰箱保存。
1.3 实时定量RT-PCR 按照Takara公司SYBR Premix Ex Taq(Perfect Real Time) DRR041A说明书完成加样,反应条件为95 ℃预变性2 min;变性95 ℃ 30 s,退火、延伸60 ℃ 45 s,重复35个循环,70~95 ℃绘制熔解曲线。反应结束后,RQ Manager分析软件统计处理,获取Ct值,并根据熔解曲线判断产物的纯度,结果分析根据Livak等[13]的描述,采用半定量分析。
1.4 细胞增殖检测 按照每孔5 000个细胞的密度将乳腺癌MBA-MD-231细胞种入96孔板。将接种好的96孔板细胞放入培养箱中培养,至细胞单层密度达到50%~60%。分组:采用50、100 nmol/L miR-26b mimics转染为50 nmol/L组和100 nmol/L组,参照Invitrogen公司lipofectamine说明书完成96孔板细胞转染;脂质体处理为空对照组,小分子RNA片段转染组为负对照组。按转染后24、48、72、96 h 4个时间段分别进行如下操作:每孔加入20 μl MTT溶液(5 mg/L),继续培养4 h。吸取上清弃掉,每孔加入150 μl二甲基亚砜(DMSO),置摇床上低速震荡10 min,使结晶物充分溶解。在酶联免疫检测仪490 nm处测量各孔的吸光值(OD)。
1.5 荧光素酶报告实验 通过TargetScan软件寻找miR-26b可能靶基因,前列腺素内过氧化物酶2(PTGS-2)3′UTR存在一个潜在miR-26b靶位结合点(257-264)。以人乳腺癌MBA-MD-231细胞cDNA为模板,按照Primer star kit(Takara)说明书PCR扩增包括miR-26b结合靶点在内的PTGS-2基因部分3′UTR区。PCR引物:正义引物5′-TAGGCGATCGCTCGAGCTGTTGCGGAGAAAGGAGTC-3′,反义引物 5′-AATTCCCGGGCTCGAGTAGTTACTTCTAATGCATCATGG-3′。将目的片段亚克隆到psiCHECK-2质粒上,酶切鉴定和测序分析其正确性。在96孔板中培养人乳腺癌MBA-MD-231细胞,当细胞密度为60%左右时进行转染,分别转染psiCHECK-2 PTGS-2 3′-UTR 和100 nmol/L miR-26b mimics(PTGS-2组),psiCHECK-2/PTGS-2 3′-UTR 突变体 (200 ng) 和 miR-26b (100 nmol/L)(突变体对照组),200 ng psiCHECK-2空载体和100 nmol/L miR-NC (空载体对照组),每组设5个复孔。转染后继续培养48 h。根据Dual-luciferase report assay system (Promega,USA)说明书完成荧光素酶报告实验。
1.6 Western blotting 实验组为100 nmol/L miR-26b mimics转染组,空对照组为脂质体处理组,负对照组为小分子RNA片段转染组。转染后48 h分别收集实验组和对照组细胞,用预冷的RIPA裂解液裂解后取上清,以Bradford法蛋白定量,10%十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳,然后电转移至硝酸纤维素(NC)膜上,分别加入1∶1 000稀释的PTGS-2一抗(BioVision,USA),4 ℃孵育过夜,1∶1 000稀释的二抗稀释液中孵育,磷酸盐吐温缓冲液(PBST)洗膜后进行奥德赛系统扫描。
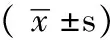
2 结果
2.1 实时定量RT-PCR结果 乳腺癌组织中miR-26b ΔCt为(15.25±0.98),正常乳腺组织中为(12.37±1.23),正常乳腺组织中miR-26b表达水平为乳腺癌组织的7.33倍,乳腺癌组织中miR-26b表达低于正常乳腺组织,差异有统计学意义(t=12.21,P=0.007)。
2.2 MTT实验结果 MTT实验结果显示,50 nmol/L组、100 nmol/L组、空对照组和负对照组转染后24、48 h相对细胞增殖比较,差异均无统计学意义(F值分别为1.314和1.830,P值分别为0.336和0.220);4组转染后72、96 h相对细胞增殖比较,差异均有统计学意义(F值分别为11.037和5.470,P值分别为0.003和0.024);其中转染后96 h 50 nmol/L组与空对照组比较,差异有统计学意义 (q=-3.048,P=0.038);转染后72 h和96 h 100 nmol/L组与空对照组比较,差异均有统计学意义 (q值分别为-3.248和-4.254,P值分别为0.031和0.013,见图1)。

图1 不同组乳腺癌MBA-MD-231细胞相对细胞增殖比较
Figure1 Comparison of the proliferation of MBA-MD-231 cancer cells in different groups
2.3 荧光素酶报告实验 PTGS-2 mRNA在PTGS-2组中ΔCt为(3.91±0.21),突变体对照组及空载体对照组中分别为(2.25±0.31)、(2.53±0.48)。荧光素酶报告实验结果显示,PTGS-2组、突变体对照组及空载体对照组荧光素酶活性比较,差异有统计学意义(F=99.88,P=0.000);其中PTGS-2组较突变体对照组和空载体对照组均降低,差异有统计学意义(q值分别为-10.314和-12.108,P值分别为0.000和0.000,见图2)。
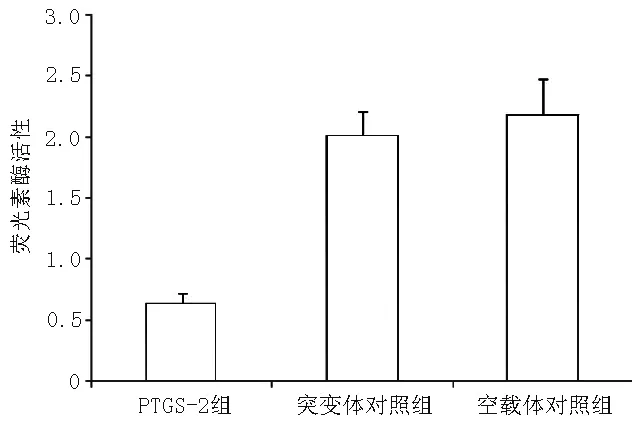
图2 不同组荧光素酶活性比较
Figure2 Comparison of luciferase activities of MBA-MD-231 cancer cells in different groups
2.4 Western blotting结果分析 与空对照组及负对照组相比,实验组作用乳腺癌MBA-MD-231细胞株48 h后,PTGS-2蛋白的表达量明显减少(见图3)。

图3 不同组PTGS-2蛋白表达情况
Figure3 PTGS-2 protein expression of MBA-MD-231 cancer cells in different groups
3 讨论
microRNAs是一类进化上高度保守的单链RNA,通常长度在22 nt左右,结合于靶基因mRNA的3′-UTR区域,阻遏翻译或者直接降解mRNA,抑制基因表达。在肿瘤发生和发展中,miRNA表达谱发生改变,抑制肿瘤的microRNAs表达下调,而促进肿瘤的microRNAs过表达。本实验发现miR-26b在乳腺癌组织和正常乳腺组织中差异表达,在乳腺癌组织中表达明显下调,这与在肝癌[7]、鼻咽癌[8]、原发性肺鳞状细胞癌[9]中的报道相一致。目前的研究表明miR-26b在多种肿瘤中具有多元的作用,如高表达的miR-26b可通过作用于COX-2(cyclooxygenase-2)明显抑制鼻咽上皮细胞癌细胞的增殖[8],相反下调垂体肿瘤细胞中miR-26b的表达水平可抑制克隆形成、肿瘤侵袭和小鼠体内成瘤能力[10]。miR-26b通过抑制SLC7A11表达,促进乳腺癌细胞的凋亡,从而参与凋亡的调控过程[11]。本实验发现miR-26b能够抑制MBA-MD-231细胞的增殖,这些研究结果表明miR-26b在多种肿瘤的发生和演进中发挥着重要的作用。
PTGS-2催化花生四烯酸向前列腺素(PGs)和其他类花生酸类物质转化,其在正常组织中含量极少,缺氧、炎性细胞因子、促癌物、生长因子等可诱发其表达[14-15]。PTGS-2参与致癌、免疫反应抑制、细胞凋亡抑制、血管生成、肿瘤细胞的侵袭和转移等一系列生理病理过程。最近的研究表明,PTGS-2基因变异的女性好发乳腺癌[16-17],此外,PTGS-2过度表达的乳腺癌患者预后较差[18]。这些研究表明PTGS-2参与肿瘤的形成和发展,其在乳腺癌中扮演着原癌基因的角色。本实验通过TargetScan预测miR-26b的下游靶基因,发现PTGS-2 3′UTR与miR-26b有着一处潜在的互补结合序列(257-264),这为PTGS-2是miR-26b可能的靶基因提供了理论依据。荧光定量RT-PCR和Western blotting实验结果显示100 nmol/L miR-26b mimics抑制PTGS-2 mRNA和蛋白表达水平,且荧光素酶报告实验证明miR-26b能够下调PTGS-2组荧光素酶活性,这从实验基础上证明PTGS-2即是miR-26b的靶基因,miR-26b通过作用于PTGS-2基因参与乳腺癌细胞的增殖过程,这与Ji等[8]的报道相一致。
传统的乳腺癌治疗策略,主要包括外科手术、放疗、化疗和内分泌治疗等。microRNAs介导的肿瘤分子治疗将是根治肿瘤的重要发展方向。miR-26b在乳腺癌中的表达水平降低,能够抑制细胞增殖,提示其在乳腺癌中扮演着抑癌基因的角色,因此未来可通过上调miR-26b的表达,实现治疗乳腺癌的目的。梅玫等[19]研究发现聚酰胺-胺型树枝状高分子(PAMAM)微粒可以实现5氟尿嘧啶(5-Fu)和miR-21的同载,联合应用5-Fu与miR-21抑制剂可有效抑制乳腺癌细胞的体外生长。因此未来可将5-Fu/PAMAM/miR-26b复合物应用于乳腺癌的临床治疗,这为克服肿瘤提供了新的方向。
1 王深明,林颖.关注乳腺癌早期诊断和治疗的进展[J].中华实验外科杂志,2011,28(5):647-649.
2 黄哲宙,陈万青,吴春晓,等.中国女性乳腺癌的发病和死亡现况——全国32个肿瘤登记点2003—2007年资料分析报告[J].肿瘤,2012,32(6):435-439.
3 Zhang J,Lu Y,Yue X,et al.MiR-124 suppresses growth of human colorectal cancer by inhibiting STAT3[J].PLoS One,2013,8(8):e70300.
4 冯燕,杨畅,刘琼,等.微小RNA-148b在乳腺癌中的表达及意义[J].中国全科医学,2012,15(11):3848.
5 Pizzini S,Bisognin A,Mandruzzato S,et al.Impact of microRNAs on regulatory networks and pathways in human colorectal carcinogenesis and development of metastasis[J].BMC Genomics,2013,14(1):589.
6 Yu F,Deng H,Yao H,et al.MiR-30 reduction maintains self-renewal and inhibits apoptosis in breast tumor-initiating cells[J].Oncogene,2010,29(29):4194-4204.
7 Ji J,Shi J,Budhu A,et al.MicroRNA expression,survival,and response to interferon in liver cancer[J].N Engl J Med,2009,361(15):1437-1447.
8 Ji Y,He Y,Liu L,et al.MiRNA-26b regulates the expression of cyclooxygenase-2 in desferrioxamine-treated CNE cells[J].FEBS Lett,2010,584(5):961-967.
9 Gao W,Shen H,Liu L,et al.MiR-21 overexpression in human primary squamous cell lung carcinoma is associated with poor patient prognosis[J].J Cancer Res Clin Oncol,2011,137(4):557-566.
10 Palumbo T,Faucz FR,Azevedo M,et al.Functional screen analysis reveals miR-26b and miR-128 as central regulators of pituitary somatomammotrophic tumor growth through activation of the PTEN-AKT pathway[J].Oncogene,2013,32(13):1651-1659.
11 Liu XX,Li XJ,Zhang B,et al.MicroRNA-26b is underexpressed in human breast cancer and induces cell apoptosis by targeting SLC7A11[J].FEBS Lett,2011,585(9):1363-1367.
12 Chen C,Ridzon DA,Broomer AJ,et al.Real-time quantification of microRNAs by stem-loop RT-PCR[J].Nucleic Acids Res,2005,33(20):e179.
13 Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J].Methods,2001,25(4):402-408.
14 Schmedtje JF Jr,Ji YS,Liu WL,et al.Hypoxia induces cyclooxygenase-2 via the NF-kappa B p65 transcription factor in human vascular endothelial cells[J].J Biol Chem,1997,272(1):601-608.
15 Liu XH,Kirschenbaum A,Yao S,et al.Upregulation of vascular endothelial growth factor by cobalt chloride-simulated hypoxia is mediated by persistent induction of cyclooxygenase-2 in a metastatic human prostate cancer cell line[J].Clin Exp Metastasis,1999,17(8):687-694.
16 Dossus L,Kaaks R,Canzian F,et al.PTGS2 and IL6 genetic variation and risk of breast and prostate cancer:results from the Breast and Prostate Cancer Cohort Consortium (BPC3)[J].Carcinogenesis,2010,31(3):455-461.
17 Langsenlehner U,Yazdani-Biuki B,Eder T,et al.The cyclooxygenase-2 (PTGS2) 8473T>C polymorphism is associated with breast cancer risk[J].Clin Cancer Res,2006,12(4):1392-1394.
18 Festa-Vasconcellos JS,Piranda DN,Amaral LM,et al.Polymorphisms in cycloxygenase-2 gene and breast cancer prognosis:association between PTGS2 haplotypes and histopathological features[J].Breast Cancer Res Treat,2012,132(1):251-258.
19 梅玫,任玉,周旋,等.聚酰胺-氨纳米微粒介导5-氟尿嘧啶联合小RNA-21抑制乳腺癌细胞生长的研究[J].中华实验外科杂志,2010,27(6):691-693.
