KLF6基因在原发性肝癌中遗传不稳定性的研究
2013-04-20王文香田菊霞关媛媛于宁徐锦屏
王文香 田菊霞 关媛媛 于宁 徐锦屏
KLF6基因在原发性肝癌中遗传不稳定性的研究
王文香 田菊霞 关媛媛 于宁 徐锦屏
目的研究KLF6基因M1、M2、M4、D10S1716位点的微卫星不稳定性(MSI)和杂合性缺失(LOH)与原发性肝癌进展的关系,为揭示抑癌基因作用机制和肿瘤发生、发展机制提供实验依据。方法从肝癌组织标本中抽提DNA,应用PCR-单链构象多态性(PCR-SSCP)法进行KLF6基因遗传不稳定性的研究。结果肝癌KLF6基因微卫星位点LOH的检出率为35.71%(10/28),与肝癌分化程度、有无包膜无相关性(均P>0.05),但与临床TNM分期密切相关(P<0.01),LOH在肝癌Ⅲ~Ⅳ期检出率为(75.00%,6/8)明显高于Ⅰ~Ⅱ期(20.00%,4/20)。MSI检出率为17.86%(5/28),MSI与肝癌分化程度、淋巴转移、临床TNM分期和有无包膜均无相关性(均P>0.05)。 结论 KLF6基因的遗传不稳定性可能是原发性肝癌发生、发展的一个重要机制,KLF6基因LOH的发生率与临床TNM分期正相关。LOH在KLF6杂合性缺失的过程中起了重要作用,可作为肝癌恶化及进展的一个指标,MSI则可能影响肿瘤的预后。
肝细胞癌 KLF6基因 PCR-单链构象多态性(PCR-SSCP)法

【 Abstract】 ObjectiveTo investigate genetic instability of KLF6 gene in hepatocellular carcinoma(HCC).MethodsDNA was extracted from fresh tissue samples of 28 patients with hepatocellular carcinoma.Microsatellite instability (MSI)and loss of hererozygosity(LOH)of locus KLF6M1,KLF6 M2,KLF6 M4 and D10S1716 in KLF6 gene were examined by PCR-SSCP method.ResultsThe detection rate of LOH in KLF6 gene of HCC was 35.71%(10/28),which was correlated with TNM stages(P<0.01), but not correlated with the differential degrees and tumor with or without capsule(P>0.05).The detection rate of LOH in stageⅢ+Ⅳtumors was 75.00% (6/8),which was significantly higher than that in tumors of stageⅠ+Ⅱ (20.00%,4/20).The detection rate of MSI of KLF6 gene was 17.86%(5/28),which was not correlated with differential degrees,lymph node metastasis,TNM stages and with or without capsule(P>0.05).ConclusionThe genetic instability of KLF6 gene may be associated with carcinogenesis and development of HCC.
原发性肝癌是病死率仅次于胃癌和食管癌的第三大常见恶性肿瘤,其中肝细胞癌(hepatocellular carcinoma,HCC)占原发性肝癌的90%。我国是肝癌的高发地区之一,其发病率约为30.3/10万,每年约有14万人死于肝癌,占全世界肝癌死亡人数的50%以上[1-2]。Kruppel样因子6(Kruppel-like factor 6,KLF6)是近年来发现的锌指转录因子,又称ZF9/CPBP[3],是新发现的抑癌基因。研究显示抑癌基因的遗传不稳定性是导致癌症发生的一个重要因素,而国内关于肝癌的遗传不稳定性鲜有报道。为了进一步研究KLF6基因在肝癌中的表达情况,本研究采用PCR-单链构象多态性(PCR-SSCP)法对28例肝癌病例进行 KLF6 M1、KLF6 M2、KLF6 M4和10p15区域D10S1716位点微卫星不稳定性(microsatellite instability,MSI)和杂合性缺失(loss of heterozygosity,LOH)的检测,以探讨KLF6基因在肝癌中失表达的机制[4-5],分析KLF6遗传不稳定性与临床病理特征的关系。
1 材料和方法
1.1 材料
1.1.1 标本收集 收集2004-01—2007-10肝癌手术标本28例(由浙江大学医学院附属第一医院病理科提供),每例标本中均包含肿瘤组织和癌旁组织,患者术前均未接受过放、化疗。每例标本均分为两份,一份直接于液氮中保存,另一份石蜡包埋备用。
1.1.2 引物序列 所有引物合成及试剂均购于上海生工生物工程公司。引物序列如下,D10S1716上游5′-AGC TGG ATT TGC TAC AGA CTT-3′,下游5′-GCC TTG AAG ACA TTT TGT GA-3′;KLF6 M1上游5′-GAG GGA GTG AGG CTT TCT GTT-3′,下游5′-TTT CCA GCC CAC TGT CTT CTT GAC-3′;KLF6 M2上游5′-ATG GCC CTG GTG ACT TCT TA-3′,下游5′-TAC TTG CGG AGC GTG AGC C-3′;KLF6 M4上游F:5'-GCA TTA AGA ATA GTG AAG GC-3′,下游5′-GAT GTG TTT GGC TCA GGG A-3′。
1.2 方法
1.2.1DNA提取 将石蜡包埋组织行10μm切片,加入1 000μl二甲苯,38℃恒温水浴,离心去上清液,循环2次;加入无水乙醇1 000μl,恒温水浴,离心去上清液,循环2次,空气中干燥;加入400μl消化缓冲液,6μl蛋白酶K溶液,恒温水浴至组织完全呈絮状;加入400μl苯酚-氯仿,震荡混匀,离心,吸取上层水相至新管,重复抽提1次;加入800μl-20℃预冷无水乙醇,1/10体积3M醋酸钠溶液,翻转混匀,置于-20℃过夜。4℃离心,析出DNA沉淀;加入100μl 1×TE溶解DNA沉淀,-20℃冷藏备用。
1.2.2 PCR扩增 反应总体积为25μl,包括 1.5μl 25mmol/L MgCl2、2.5μl 10×缓冲液、0.5μl 10mM dNTP、1 U Taq DNA聚合酶、引物各25 pmol/L;94℃变性10min,进入循环94℃30s、退火55~60℃30s、72℃45s,循环35次,最后72℃延伸10min。扩增产物经2%琼脂糖电泳、溴乙锭染色,经紫外灯下观察,证实PCR扩增成功。
1.2.3 变性聚丙烯酰胺凝胶电泳及银染观察 4μl PCR扩增产物与等体积变性上样缓冲液(含98%去离子甲酰胺)混合,98℃变性10min,冰骤冷15s后,加样于含8mol/L尿素的8%变性聚丙烯酰胺凝胶,140V电泳2h。凝胶经10%乙醇恒温摇床5min,1%HNO3摇床5min,0.1%硝酸银溶液15min,每步结束后均以双蒸水漂洗5min,最后0.28mol/L碳酸钠显色至条带清晰,10%冰乙酸终止,玻璃纸封胶,风干保存。
1.2.4 遗传不稳定性判断标准 PCR-SSCP电泳凝胶图中,相应等位基因位点只出现一条主带,代表一个等位基因片段,为纯合子;如出现两条主带则为杂合子,可用于LOH分析。肿瘤组织较正常组织相应等位基因条带减少或密度降低50%以上,为LOH;肿瘤组织较正常组织等位基因条带增多或移位,为MSI。4个位点中只要1个位点发生MSI,则判断为KLF6基因MSI阳性,LOH同上。
1.3 统计学处理 采用SPSS 13.0统计软件,计数资料组间比较采用χ2检验。
2 结果
2.1 组织电泳图 肿瘤组织和癌旁组织KLF6 M1、KLF6 M2、KLF6 M4和D10S1716位点微卫星片段均扩增成功,见图1(图中1、2、3、4为患者编号)。经变性聚丙烯酰胺凝胶电泳检测,其等位基因均为杂合子。与正常组织相比较,MSI表现为肿瘤组织等位基因条带增加;LOH则是肿瘤组织等位基因条带减少,见图2(图中26、27、43、48为患者编号)。

图1 D10S1716位点PCR产物电泳图(C:肿瘤组织;N:癌旁组织)
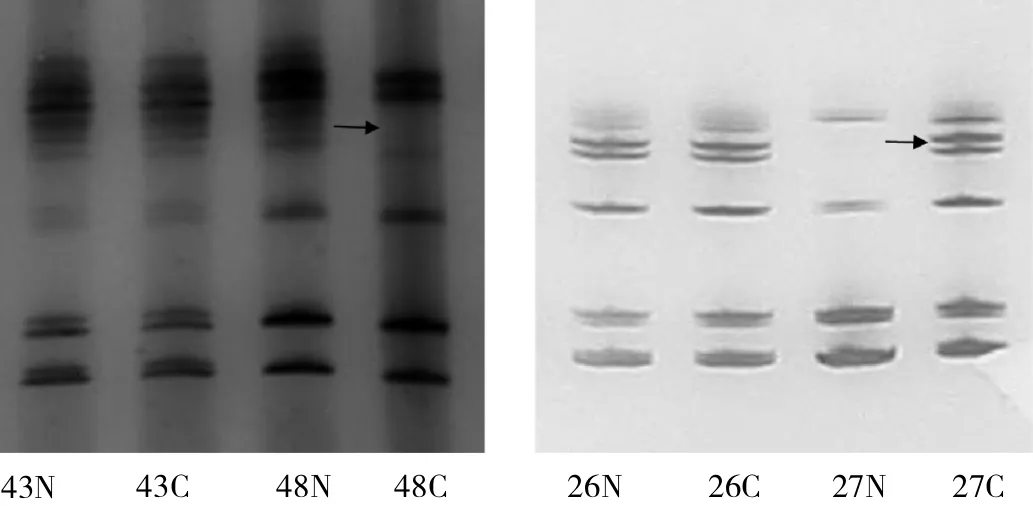
图2 LOH和MSI的聚丙烯酰胺凝胶电泳图[肿瘤组织43C与癌旁组织43N条带无异常;肿瘤组织48C较癌旁组织48N少2条基因条带,为LOH阳性(箭头所示);肿瘤组织26C与癌旁组织26N条带无异常;肿瘤组织27C较癌旁组织27N多1条等位基因条带,为MSI阳性(箭头所示)]
2.2 肝癌KLF6基因遗传不稳定性与临床病理特征的关系 结果表明,肝癌KLF6基因MSI检出率为17.86%,与肝癌的分化程度、淋巴转移、有无包膜和临床TNM分期均无相关性(均P>0.05)。LOH检出率为35.71%,与临床TNM分期密切相关(P<0.01),在TNMⅢ~Ⅳ期中LOH的检出率明显高于Ⅰ~Ⅱ期(75.00%vs 20.00%),有统计学差异(P<0.01);LOH在低分化组检出率高于高分化组(38.46%vs 0%),在淋巴结转移组的检出率高于无淋巴结转移组(66.67%vs 27.27%),但LOH与分化程度、淋巴转移和有无包膜均无相关性(均P>0.05),见表1。

表1 肝癌KLF6基因遗传不稳定性与临床病理特征之间的关系[例(%)]
3 讨论
DNA复制过程中,微卫星的“链滑”导致序列长度的改变,与正常细胞不同,在肿瘤细胞中这种“链滑”不能被错配系统所修复,从而导致MSI的发生[6]。LOH指肿瘤染色体上的一对等位基因的DNA多态性基因座中的一个发生缺失,失去原本的杂合性。抑癌基因变异最常见的分子机制是其2个位点相继因点突变和LOH而导致功能完全丧失,即广为接受的Knudsen“两次打击理论”[7]。KLF6是一种在哺乳动物组织中普遍表达的核转录调控因子,其编码的蛋白含283个氨基酸,包括N-端转录活性功能域(201个氨基酸)和C-端锌指结构域(82个氨基酸)。锌指结构域能特异性结合靶基因启动子区域的GC盒、CACCC盒等核心元件,直接作用于DNA,调节靶基因的转录。对于检测基因MSI和LOH的方法,目前普遍运用的方法是选用较多的位点和选用多态性较小的单一位点进行研究。本研究选取肝癌KLF6特异性位点KLF6 M1、KLF6 M2、KLF6 M4和D10S1716多个位点法,分析肝癌中KLF6的遗传不稳定性及蛋白表达。
Naoki等[8]在研究脑肿瘤、肺肿瘤和一些癌细胞株的多态性错义突变时发现,这些突变有导致KLF6中p21基因启动子活性的降低和促进肿瘤细胞生长的作用,KLF6基因的突变可能导致KLF6蛋白合成障碍从而引发肿瘤。本研究中肝癌KLF6基因微卫星位点LOH的检出率为35.71%,与肝癌分化程度、有无包膜无相关性,但与临床TNM分期密切相关,在肝癌Ⅲ~Ⅳ期检出率明显高于Ⅰ~Ⅱ期。而在癌旁组织未发现KLF6基因变异,可以说明该论点。Teixeira等[9]在头颈鳞癌的研究中发现,KLF6基因LOH发生率与肿瘤进展、复发和低生存率成正相关。Boyault等[10]检测了肝癌患者KLF6的第二外显子区域,没有发现点突变,仅有6.8%的病例出现等位基因缺失。本研究说明肝癌KLF6基因LOH与临床TNM分期密切相关,提示KLF6基因位点的LOH多发生于肝癌晚期;在淋巴结转移组的发生率高于无淋巴结转移组,提示KLF6基因位点的LOH可能有促进淋巴转移的作用。
Berney等[11]在遗传性非息肉病性结肠癌中首先报道过MSI,随后在各种散发性肿瘤如胃癌、子宫内膜癌、乳腺癌、前列腺癌和胰腺癌中均发现MSI现象。也有研究曾报道胃癌、结肠癌中nm23H1基因D17S396位点的MSI发生率在预后良好的临床TNMⅠ+Ⅱ期明显高于预后差的Ⅲ+Ⅳ期[12],并推断MSI是胃癌和结肠癌的早期分子标志,可作为早期诊断的指标。在本研究中,MSI检出率为17.86%,但MSI与肝癌分化程度、淋巴转移、临床TNM分期和有无包膜统计学上无相关性。虽然临床TNMⅠ~Ⅱ期的MSI发生率高于TNMⅢ~Ⅳ期,但无统计学差异,与上述研究报道有差异,可能与基因功能及调控的不同有关,需进一步深入研究。
本研究显示KLF6微卫星位点遗传不稳定性与肝癌的发生、发展密切相关,随着肿瘤的进展,LOH发生率提高,MSI发生率则随着淋巴结的转移及浸润深度有下降的趋势。KLF6基因的遗传不稳定性可能是导致抑癌基因突变,原发性肝癌发生、发展的一个重要机制。LOH在KLF6杂合性缺失的过程中起了重要作用,可作为肝癌恶化及进展的一个指标,MSI则可能影响肿瘤的预后,但因本研究所选样本量偏小,有待以后的研究中进一步证实。
[1] 叶家才,崔书中,巴明臣.原发性肝癌的流行病学特征及其危险因素[J].实用医学杂志,2008,24(10):1839-1841.
[2] Santaguida M,Schepers K,Passegué E,et al.JunB protects against myeloid malignancies by limiting hematopoietic stem cell proliferation and differentiation without affecting self-renewal[J]. Cancer Cell,2009,15(4):341-352.
[3] Narla G,Heath K E,Reeves H L,et al.A candidate tumor suppressor genemutated in prostate cancer[J].Science,2001,294(5551):2563-2566.
[4] Szremska A P,Kenner L,Wagner E F,et al.JunB inhibits proliferation and transformation in B-lymphoid cells[J].Blood,2003, 102(12):4159-4165.
[5]王高雄,李新丰,孙旭日,等.耐药相关蛋白P-gp、GST-π、TopoⅡ在原发性肝癌中的表达及其临床意义[J].中华消化外科杂志,2007, 6(1):44-47.
[6] Loeb L A.Microsatellite instability induced by hydrogen peroxide in Escherichia coli[J].Mutat Res,2000,447(2):187-198.
[7] Knudson A J.Mutation and cancer:statisticalstudy of retinoblastoma[J].Proc Natl Acad Sci USA,1971,68(4):820-823.
[8] Naoki K,Dong Y,Alexy C,et al.Mutational analysis of KLF6 gene in cancer,and mutated KLF6 gene affects on the cell proliferation in brain tumor[J].Proc Amer Assoc Cancer Res,2006,47 (5):357-362.
[9] Teixeira M S,O Camacho-Vanegas.KLF6 allelic loss is associated with tumor recurrence and markedly decreased survival in head and neck squamous cell carcinoma[J].Int J Cancer,2007, 121(9):1976-1983.
[10] Boyault S,Hérault A,Balabaud C,et al.Absence of KLF6 gene mutation in 71 hepatocellular carcinomas[J].Hepatology,2005, 41(3):681-692.
[11] Berney,Fisher.Genomic alterations(LOH,MI)on chromosome 17q21-23 and prognosis of sporadic colorectal cancer[J].Int J Cancer,2000,89(1):1-7.
[12] Frydenberg J,Pertoldi C,Dahlgaard J,et al.Genetic variation in original and colonizing Drosophila buzzatii populationsanalysed by microsatellite loci isolated with a new PCR screening method [J].Mol Ecol,2002,11(2):181-190.
Microsatellite instability and loss of heterozygosity in KLF6 gene of hepatocellular carcinoma
Hepatocellular carcinoma(HCC)KLF6 gene PCR-single strand conformation polymorphism(PCR-SSCP)
2013-01-21)
(本文编辑:胥昀)
杭州市科技发展计划项目(20091233Q30)
311201 杭州市萧山区第一人民医院感染科(王文香),病理科(徐锦屏);杭州师范大学基础医学部解剖学教研室(田菊霞、关媛媛、于宁)
田菊霞,E-mail:hztctjx@163.com
