抗高血压类药物治疗IgA肾病的Meta分析
2013-04-19欧阳小林黄献文黄贤贵朱玉宸
沈 琪,欧阳小林,黄献文,杨 彤,黄贤贵,朱玉宸
IgA肾病(IgAN)是一组以IgA或以IgA为主的免疫复合物在肾小球系膜区沉积及毛细血管袢沉积引起的一系列临床和病理改变,是全球范围内最常见的原发性肾小球肾炎[1],15%~20%的患者在10年内将发展至终末期肾病(ESRD),而20年内进展到ESRD的患者将增加到30%~40%[2-3],是导致慢性肾功不全的主要原因。早在1968年,Berger 和Hinglais报道了IgAN,故又称Berger病[4],其后众多学者对其发病机制、临床和病理、治疗和预后做了大量研究。目前治疗IgAN的药物主要为:糖皮质激素、免疫抑制剂及抗高血压类药物〔血管紧张素转换酶抑制剂(ACEI)、血管紧张素Ⅱ受体拮抗剂(ARB)、β-受体阻滞剂和钙离子拮抗剂(CCB)等〕。但是IgAN目前尚无统一的治疗方案,长期应用皮质激素和新型免疫抑制剂治疗有生长迟缓、远期毒性反应等药物不良反应,近年来抗高血压类药物治疗IgAN随机对照试验(RCT)研究报道增多,故有必要按照循证医学的方法,对抗高血压类药物的疗效和安全性进行系统评价,从而为临床合理用药及制定更佳治疗方案提供参考依据。
1 资料与方法
1.1 文献纳入和排除标准
1.1.1 纳入标准 同时符合以下条件的研究被纳入:(1)所有(成年或儿童)经过肾活检术确诊为IgAN的患者。(2)所有RCT和半随机对照试验(quasi-RCT)。(3)干预措施:①抗高血压类药物与安慰剂或空白对照;②抗高血压类药物与其他免疫抑制剂对照;③抗高血压类药物联合应用其他药物与其他药物对照;④抗高血压类药物联合用药与单药对照。
1.1.2 排除标准 (1)继发于过敏性紫癜、肾淀粉样变性及病毒感染等继发性肾病;(2)原发性肾病综合征及儿童先天性肾病综合征。
1.2 疗效判定指标 主要测量指标:ESRD发生率、病死率、完全缓解率、总缓解率(完全缓解率+部分缓解率)。次要测量指标:部分缓解率、内生肌酐清除率、血肌酐及24 h尿蛋白定量。
1.3 文献检索策略 参考Cochrane协作网制定的RCT检索策略。计算机检索Cochrane图书馆的临床对照试验中心资料库(CENIRAL)、PubMed、EMBase、CBMdisc、中国知网(CNKI)、中文科技期刊全文数据库(VIP)等。检索文献起止时间均从建库至2012-05-31。此外,还手工检索了《中华医学杂志》、《中华肾脏病杂志》、《中国循证医学杂志》、《中华内科杂志》、《中国实用儿科杂志》、《中华儿科杂志》、《肾脏病透析与移植杂志》及肾脏病会议论文和内部资料等灰色文献。英文检索词:Human、Randomized-controlled-trial、 blind、controlled-clinical-trial、IgA nephropathy、berger disease、glomerulonephritis、ACEI、ARB 、Benazepril 、Enalapril 、Valsartan及Irbesartan;中文检索词:人类、随机对照试验、盲法、对照临床试验、IgA肾病、贝格尔病、肾小球肾炎、血管紧张素转化酶抑制剂、血管紧张素受体拮抗剂、贝那普利、依那普利、缬沙坦及厄贝沙坦。原文获取途径:(1)检索电子期刊全文数据库;(2)直接与作者联系索取全文;(3)从图书馆购买全文。
1.4 文献质量评价方法
1.4.1 纳入和排除文献方法 由3位评价者共同完成,2位评价者独立按照检索策略完成检索,按照Cochrane推荐的专用质量评价表和资料提取表,进行质量评价和数据提取,交叉核对结果。对文献中未表述清楚的内容直接与通讯作者联系。如遇分歧通过讨论解决或由第3位评价员协商解决。
1.4.2 资料提取方法 2名评价员独立提取资料,提取资料内容包括:文献的一般信息,患者的一般情况,干预措施及临床结局指标。
1.4.3 文献质量评价 依据Cochrane 5.0.2手册推荐的RCT质量评价标准进行。评价内容包括:(1)随机分配方法;(2)分配隐藏;(3)盲法;(4)数据的完整性;(5)选择性报告研究结果;(6)其他偏倚来源。完全满足上述6条质量标准,即为“正确或充分”者,其发生各种偏倚的可能性最小,质量为A级;≥上述1条描述不清楚者为部分满足,质量为B级;≥上述1条未描述者有发生相应偏倚的可能性,质量为C级。
1.5 统计学方法 采用Cochrane系统评价软件RevMan 5.0进行Meta分析。计数资料采用比值比(OR)及其95%CI表示,计量资料采用加权均数差(WMD)或标准化均数差(SMD)及其95%CI表示。对纳入研究的临床异质性和方法学异质性进行分析,按照临床异质性和方法学异质性进行亚组分析,并采用χ2检验分析各研究结果间的统计学异质性,当亚组内各研究间无统计学异质性(P≥0.1;I2≤50%)时,采用固定效应模型分析;如研究间存在统计学异质性(P<0.1;I2>50%)时,采用随机效应模型分析;必要时进行敏感性分析。
2 结果
2.1 纳入研究的一般情况 通过检索共查找到符合条件的文献1 368篇,其中英文文献987篇,中文文献381篇。通过阅读文献题目和摘要,初筛出96篇提到随机的文献,再通过阅读全文,排除69篇,纳入27篇RCT文献[5-31];其中4篇文献[28-31]为交叉随机对照试验,无法进行数据提取,故未进入数据提取,最终纳入23篇RCT文献[5-27]进入Meta分析。其中英文文献17篇[5-10,12-19,23,26-27],中文文献6篇[11,20-22,24-25],共纳入1 504例IgAN患者。文献筛选流程见图1。各纳入研究的基本特征见表1。

表1 纳入研究的23篇RCT文献的基本情况Table 1 Baseline data of included 23 RCTs
注:T=试验组, C=对照组,ARB=血管紧张素Ⅱ受体拮抗剂,ACEI=血管紧张素转换酶抑制剂,CCB=钙离子拮抗剂,BB=β-受体阻滞剂,VitD=维生素D

图1 文献筛选流程图Figure 1 Flow chart of articile screening and selection process
2.2 文献质量评价 23篇文献均提及随机[5-27],其中10篇文献[5-7,9,13-14,17,22,24,27]采用了正确的随机化方法,4篇文献[5,7,17,27]采用了分配隐藏;纳入文献均未采用盲法或未提及;均报道了失访和退出情况。15篇文献[5-10,14,16-19,23,24,26,27]评为B级,8篇文献[11,12,13,15,20-22,25]评为C级。
2.3 ACEI或ARB与安慰剂或无治疗对比治疗IgAN疗效的Meta分析结果
2.3.1 ESRD或肌酐倍增发生率 2篇文献[5-6]报道了两组的ESRD或肌酐倍增发生率,异质性检验P=0.85,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,OR=0.20,95%CI(0.08,0.51),两组ESRD或肌酐倍增发生率间差异有统计学意义(P=0.0008,见图2)。
2.3.2 完全缓解率 1篇文献[7]报道了两组的完全缓解率,Meta分析结果显示,OR=10.89,95%CI(0.56,211.00),两组间差异无统计学意义(P=0.11,见图2)。
2.3.3 部分缓解率 1篇文献[7]报道了两组的部分缓解率,Meta分析结果显示,OR=7.07,95%CI(1.78,28.08),两组间差异有统计学意义(P=0.005,见图2)。
2.3.4 不良反应发生率 1篇文献[5]报道了两组的不良反应发生率,Meta分析结果显示,OR=0.48,95%CI(0.18,1.32),两组间差异无统计学意义(P=0.16,见图2)。
2.3.5 血清肌酐水平 2篇文献[8-9]报道了两组的血清肌酐水平,异质性检验P=1.00,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,MD=0.00,95%CI(-23.74,23.74),两组间差异无统计学意义(P=1.00,见图3)。
2.3.6 血清内生肌酐清除率 3篇文献[5,7-8]报道了两组血清内生肌酐清除率,异质性检验P=0.48,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,MD=2.43,95%CI(-4.91,9.77),两组间差异无统计学意义(P=0.52,见图3)。
2.3.7 24 h尿蛋白定量 4篇文献[5-8]报道了两组24 h尿蛋白定量,异质性检验P=0.92,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,MD=-0.77,95%CI(-1.04,-0.49),两组间差异有统计学意义(P<0.00001,见图3)。

图2 ACEI或ARB与安慰剂或无治疗对比治疗IgAN疗效的Meta分析结果(一)
Figure2 Meta analysis of the effective for ACEI or ARB versus placebo/no treatment in IgAN (One)
2.4 CCB与安慰剂或无治疗对比治疗IgAN疗效的Meta分析结果 1篇文献[8]报告了CCB与安慰剂或无治疗对比的血清肌酐水平、血清内生肌酐清除率及24 h尿蛋白定量的变化情况。Meta分析结果显示:血清肌酐水平〔MD=0.00,95%CI(-38.74,38.74)〕,血清内生肌酐清除率〔MD=-4.00,95%CI(-23.35,15.25)〕及24 h尿蛋白定量〔MD=-0.30,95%CI(-1.33,0.73)〕比较,两组间差异均无统计学意义(P>0.05)。
2.5 ACEI和ARB对照治疗IgAN疗效的Meta分析结果 对报道疗效和安全性的文献行漏斗图检验,结果提示存在一定的发表偏倚,可能存在着灰色文献尚未发表的情况(见图4)。
2.5.1 ESRD发生率 1篇文献[10]报道了ACEI组和ARB组的ESRD发生率,Meta分析结果显示,OR=2.01,95%CI(1.02,3.95),两组间差异有统计学意义(P<0.05)。
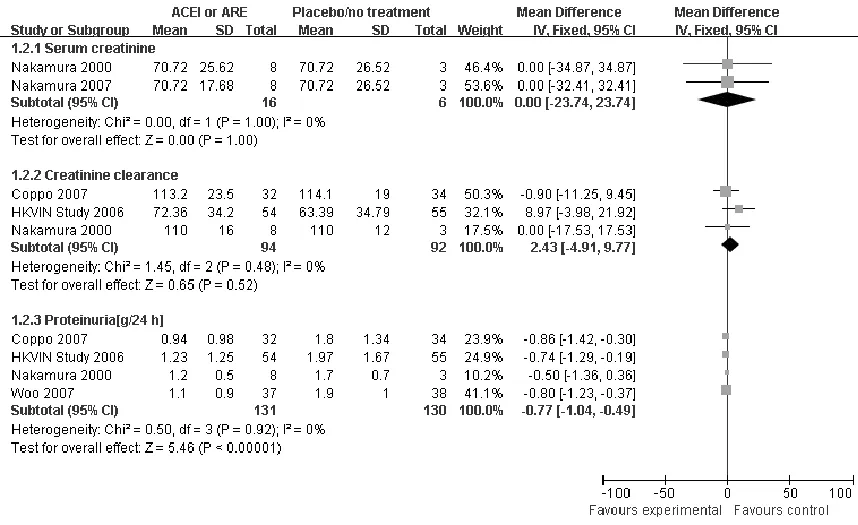
图3 ACEI或ARB与安慰剂或无治疗对比治疗IgA肾病疗效的Meta分析结果(二)
Figure3 Meta analysis of the effective for ACEI or ARB versus placebo/no treatment in IgAN (Two)
2.5.2 完全缓解率 1篇文献[11]报道了ACEI组和ARB组的完全缓解率, Meta分析结果显示,OR=0.63,95%CI(0.09,4.24),两组间差异无统计学意义(P>0.05)。
2.5.3 总缓解率 1篇文献[11]报道了ACEI组和ARB组的总缓解率,Meta分析结果显示,OR=1.00,95%CI(0.26,3.87),两组间差异无统计学意义(P>0.05)。
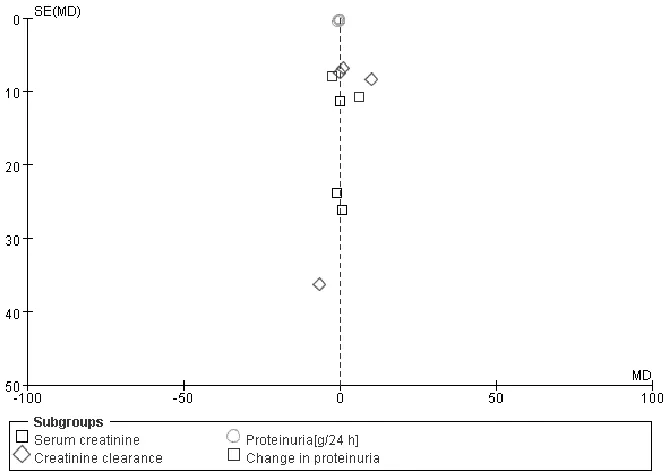
图4 ACEI与ARB对照治疗IgAN的漏斗图Figure 4 Funnel plot of ACEI vs.ARB in IgAN
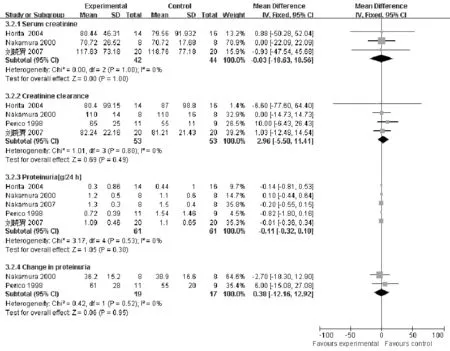
图5 ACEI与ARB对照治疗IgAN疗效的Meta分析结果Figure 5 Meta analysis of the effective forACEI vs ARB in IgAN
2.5.4 血清肌酐水平 3篇文献[8,11-12]报道了两组的血清肌酐水平,异质性检验P=1.00,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,MD=-0.03,95%CI(-18.63,18.56),两组间差异无统计学意义(P=1.00,见图5)。
2.5.5 血清内生肌酐清除率 4篇文献[8,11-13]报道了两组的血清内生肌酐清除率,异质性检验P=0.80,无统计学异质性,采用固定效应模型分析。 Meta分析结果显示,MD=2.96,95%CI(-5.50,11.41),两组间差异无统计学意义(P=0.49,见图5)。
2.5.6 24 h尿蛋白定量 5篇文献[8-9,11-13]报道了两组的24 h尿蛋白定量,异质性检验P=0.53,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,MD=-0.11,95%CI(-0.32,0.10),两组间差异无统计学意义(P=0.30,见图5)。
2.5.7 尿蛋白变化情况 2篇文献[8,13]报道了两组的尿蛋白变化情况,异质性检验P=0.52,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,MD=0.38,95%CI(-12.16,12.92),两组间差异无统计学意义(P=0.95,见图5)。
2.6 ACEI或ARB与CCB对照治疗IgAN疗效的Meta分析结果
2.6.1 1篇文献[14]报道了ACEI或ARB与CCB对照的ESRD发生率〔OR=5.69,95%CI(0.25,128.50)〕、肌酐倍增发生率〔OR=0.29,95%CI(0.03,3.13)〕,差异均无统计学意义(P>0.05)。
2.6.2 血清肌酐水平 2篇文献[8,15]报道了两组的血清肌酐水平,异质性检验P=1.00,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,MD=0.00,95%CI(-24.18,24.18),两组间差异无统计学意义(P>0.05)。
2.6.3 血清内生肌酐清除率 2篇文献[8,15]报道了两组的血清内生肌酐清除率,异质性检验P=0.58,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,MD=1.17,95%CI(-9.54,11.88),两组间差异无统计学意义(P>0.05)。
2.6.4 24 h尿蛋白定量 2篇文献[8,16]报道了两组24 h尿蛋白定量,异质性检验P=0.57,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,MD=-0.43,95%CI(-1.06, 0.21),两组间差异无统计学意义(P>0.05)。
2.7 ACEI+ARB与ACEI 或ARB对照治疗IgAN疗效的Meta分析结果
2.7.1 缓解率 1篇文献[11]报道了ACEI+ARB与ACEI或ARB对照的完全缓解率〔OR=2.83,95%CI(0.62,13.04)〕、总缓解率〔OR=2.57,95%CI(0.71,9.27)〕,差异均无统计学意义(P>0.05)。
2.7.2 血清肌酐水平 2篇文献[11-12]报道了两组的血清肌酐水平,异质性检验P=0.95,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,MD=-1.79,95%CI(-41.12,37.54),差异无统计学意义(P>0.05)。
2.7.3 血清内生肌酐清除率 2篇文献[11-12]报道了两组的血清内生肌酐清除率,异质性检验P=0.98,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,MD=0.98,95%CI(-12.51,14.46),差异无统计学意义(P>0.05)。
2.7.4 24 h尿蛋白定量 3篇文献[9,11-12]报道了两组24 h尿蛋白定量,异质性检验P=0.66,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,MD=-0.50,95%CI(-0.70,-0.31),差异有统计学意义(P<0.05)。
2.8 ARB联合糖皮质激素与糖皮质激素对照治疗IgAN疗效的Meta分析结果 1篇文献[17]报道了ARB联合糖皮质激素与糖皮质激素对照的血清肌酐水平〔MD=-8.84,95%CI(-20.10,2.42)〕及血清内生肌酐清除率〔MD=16.00,95%CI(-6.89,38.89)〕,差异均无统计学意义(P>0.05),但24 h尿蛋白定量〔MD=-0.20,95%CI(-0.26,-0.14)〕间差异有统计学意义(P<0.05)。
2.9 ACEI或ARB或ACEI+ARB 与对症治疗对照治疗IgAN疗效的Meta分析结果
2.9.1 血清肌酐水平 3篇文献[18-20]报道了两组的血清肌酐水平,异质性检验P=0.77,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,MD=-39.37,95%CI(-71.95,-6.80),两组间差异有统计学意义(P<0.05)。
2.9.2 血清内生肌酐清除率 3篇文献[18,20-21]报道了两组的血清内生肌酐清除率,异质性检验P=0.31,无统计学异质性,采用固定效应模型分析。 Meta分析结果显示,MD=19.10,95%CI(10.44,27.77),两组间差异有统计学意义(P<0.05)。
2.9.3 24 h尿蛋白定量 4篇文献[18-21]报道了两组24 h尿蛋白定量,异质性检验P=0.98,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,MD=-1.16,95%CI(-1.52,-0.81),两组间差异有统计学意义(P<0.05)。
2.10 ACEI与中药治疗对照治疗IgAN疗效的Meta分析结果 1篇文献[22]报道了ACEI与中药治疗对照的血清肌酐水平〔MD=3.65,95%CI(-6.19,13.49)〕、血清内生肌酐清除率〔MD=-4.05,95%CI(-25.78,17.68)〕及24 h尿蛋白定量〔MD=0.09,95%CI(-0.26,-0.44)〕,差异均无统计学意义(P>0.05)。
2.11 ACEI或ARB联合中药与中药对照治疗IgAN疗效的Meta分析结果
2.11.1 血清肌酐水平 2篇文献[24-25]报道了两组的血清肌酐水平,异质性检验P<0.00001,有统计学异质性,采用随机效应模型分析。Meta分析结果显示,MD=-21.69,95%CI(-83.94,40.57),两组间差异无统计学意义(P>0.05)。
2.11.2 血清内生肌酐清除率 1篇文献[25]报道了两组的血清内生肌酐清除率, Meta分析结果显示,MD=2.26,95%CI(-13.00,17.52),两组间差异无统计学意义(P>0.05)。
2.11.3 24 h尿蛋白定量 2篇文献[24-25]报道了两组的24 h尿蛋白定量,异质性检验P=0.003,有统计学异质性,采用随机效应模型分析。Meta分析结果显示,MD=-0.25,95%CI(-0.84,0.33),两组间差异无统计学意义(P>0.05)。
2.12 ACEI联合β-受体阻滞剂与CCB联合β-受体阻滞剂对照治疗IgAN的Meta分析 1篇文献[23]报道了ACEI联合β-受体阻滞剂与CCB联合β-受体阻滞剂的血清肌酐水平〔MD=-4.42,95%CI(-21.98,13.14)〕及血清内生肌酐清除率〔MD=0.00,95%CI(-25.78,17.68)〕,差异无统计学意义(P>0.05)。但24 h尿蛋白定量〔MD=-0.54,95%CI(-0.83,-0.25)〕间差异有统计学意义(P<0.05)。
2.13 ACEI与β-受体阻滞剂对照治疗IgAN疗效的Meta分析结果 1篇文献[26]报道了ACEI与β-受体阻滞剂对照的ESRD发生率〔OR=1.40,95%CI(0.17,11.68)〕,差异无统计学意义(P>0.05)。
2.14 ACEI或ARB与抗凝剂对照治疗IgAN疗效的Meta分析结果 1篇文献[27]报道了ACEI或ARB与抗凝剂对照的血清肌酐水平〔MD=0.00,95%CI(-20.42,20.42)〕、血尿发生率〔OR=-19.80,95%CI(-40.59,0.99)〕、血清内生肌酐清除率〔MD=-4.30,95%CI(-15.54,6.94)〕,差异均无统计学意义(P>0.05)。
3 讨论
自1999年始,循证医学被引入到IgAN的治疗中[32],早期主要是免疫抑制及糖皮质激素疗法,到目前为止,糖皮质激素仍然被认为是降低ESRD发生率及尿蛋白的有效手段[33]。近年来,以ACEI/ARB、鱼油、中药及抗凝剂为代表的非免疫抑制疗法已广泛应用于IgAN的临床治疗中,已有的Meta分析显示,ACEI/ARB、鱼油及抗凝剂均能有效降低尿蛋白,不能改善肾功能、ESRD发生率及病死率[34-37]。
本Meta分析共纳入23篇RCT文献的临床研究资料,结果显示:抗高血压药物中,在与安慰剂或无治疗比较中,ACEI/ARB可以有效降低尿蛋白及ESRD或肌酐倍增发生率,CCB却不能得到相同的效果,虽然结果示ACEI/ARB可以有效降低ESRD或肌酐倍增发生率,但考虑其结论来自于2个研究,且随访时间分别为2年及5年,总体随访时间较短,该结论尚不能完全明确;ARB与ACEI组对比,改善蛋白尿作用相同,但能使ESRD发生率降低,由于仅有1个研究,且随访时间为6年,明确结论尚需进一步研究;ACEI与ARB联合用药与单药比较,可有效降低 IgAN患者的蛋白尿,说明联合用药较单药更能有效降低尿蛋白;ARB或ACEI联合用药与对症治疗比较,血清肌酐水平及尿蛋白显著降低,血清内生肌酐清除率显著升高,说明ARB或ACEI或联合用药可能会有效改善临床症状;ARB联合糖皮质激素与糖皮质激素对比,可有效降低尿蛋白;ARB或ACEI与CCB及ARB比较,疗效相似;ACEI联合β-受体阻滞剂与CCB联合β-受体阻滞剂比较,可有效降低尿蛋白; ACEI与β-受体阻滞剂或抗凝剂比较,疗效相似;ACEI或ARB联合中药与中药比较,疗效相似。
本Meta分析的局限性:(1)总体研究质量不高,存在着选择性、实施和测量偏倚的可能性;(2)纳入研究的测量指标不统一,观测时间点也不统一,给评价带来不利,无法对一些信息进行评价;(3)总体随访时间较短,可能不能真实反映终点指标水平;(4)纳入的文献仅为中英文文献,纳入的样本量较小,可能存在发表偏倚及偶然事件的可能性。
4 结论
本Meta分析根据现有的证据得出下列结论:ACEI和 ARB 均能降低IgAN患者的尿蛋白,但联合用药效果更佳,ARB的治疗效果至少不差于ACEI;ACEI和ARB能否改善IgAN患者的肾功能及预后尚不能得出明确的结论。鉴于本Meta分析存在上述局限性,上述结论需谨慎看待。
1 Donadio JV,Grande JP.IgA nephropathy[J].N Engl J Med,2002,347(10):738-748.
2 Schena FP.Immunoglobulin A nephropathy with mild renallesions:a call in the forest for the physicians and nephrologists[J].Am J Med,2001,110(6):499-500.
3 Rostoker G,Desvaux-Belghiti D,Pilatte Y,et al.Immunomodulation with low-dose immunoglobulins for moderate IgAN and Henoch-Schonlein purpura.Preliminary results of a prospective uncontrolled trial[J].Nephron,1995,69(3):327-334.
4 Berger J,Hinglais N.Intercapillary deposits of IgA-IgG[J].J Urol Nephrol,1968,74(9):694-695.
5 Li PK,Leung CB,Chow KM,et al.Hong Kong study using valsartan in IgA nephropathy (HKVIN):a double-blind,randomized,placebo-controlled study[J].American Journal of Kidney Diseases,2006,47(5):751-760.
6 Woo KT,Lau YK,Zhao Y et al.Disease progression,response to ACEI/ATRA therapy and influence of ACE gene in IgA nephritis[J].Cell Mol Immunol,2007,4(3):227-232.
7 Coppo R,Peruzzi L,Amore A,et al.IgACE:a placebo-controlled,randomized trial of angiotensin-converting enzyme inhibitors in children and young people with IgAN and moderate proteinuria[J].J Am Soc Nephrol,2007,18(6):1880-1888.
8 Nakamura T,Ushiyama C,Suzuki S,et al.Effects of angiotensin-converting enzyme inhibitor,angiotensin Ⅱ receptor antagonist and calcium antagonist on urinary podocytes in patients with IgA nephropathy[J].Am J Nephrol,2000,20 (5):373-379.
9 Nakamura T,Inoue T,Sugaya T,et al.Beneficial effects of olmesartan and temocapril on urinary liver-type fatty acid-binding protein levels in normotensive patients with immunoglobulin A nephropathy[J].American Journal of Hypertension,2007,20(11):1195-1201.
10 Woo KT,Chan CM,Choong HL,et al.High dose Losartan and ACE gene polymorphism in IgA nephritis[J].Genomic Med,2008,2(3/4):83-91.
11 刘晓渭,王汉民, 陈威,等.较高剂量的缬沙坦与贝那普利对IgA肾病的疗效对比[J].西安交通大学学报:医学版,2007,28(4):437-454.
12 Horita Y,Tadokoro M,Taura K,et al.Low-dose combination therapy with temocapril and losartan reduces proteinuria in normotensivepatients with immunoglobulin A nephropathy[J].Hypertens Res,2004,27(12):963-970.
13 Perico N,Remuzzi A,Sangalli F,et al.The antiproteinuric effect of angiotensin antagonism in human IgA nephropathy is potentiated byindomethacin[J].J Am Soc Nephrol,1998,9(12):2308-2317.
14 Bannister KM,Weaver A,Clarkson AR,et al.Effect of angiotensin-converting enzyme and calcium channel inhibition on progression of IgA nephropathy[J].Contrib Nephrol,1995,111:184-192.
15 Park HC,Xu ZG,Choi S,et al.Effect of losartan and amlodipine on proteinuria and transforming growth factor-beta1 in patients with IgA nephropathy[J].Nephrol Dial Transplant,2003,18(6):1115-1121.
16 Iino Y,Hayashi M,Kawamura T,et al.Interim evidence of the renoprotective effect of the angiotensin Ⅱ receptor antagonist losartan versus the calcium channel blocker amlodipine in patients with chronic kidney disease and hypertension:a report of the Japanese Losartan Therapy Intended for Global Renal Protection in Hypertensive Patients (JLIGHT) Study[J].Clinical & Experimental Nephrology,2003,7(3):221-230.
17 Horita Y,Tadokoro M,Taura K,et al.Prednisolone co-administered with losartan confers renoprotection in patients with IgA nephropathy[J].Renal Failure,2007,29(4):441-446.
18 Praga M,Gutiérrez E,González E,et al.Treatment of IgA nephropathy with ACE inhibitors:a randomized and controlled trial[J].J Am Soc Nephrol,2003,14(6):1578-1583.
19 Woo KT,Lau YK,Wong KS,et al.ACEI/ATRA therapy decreases proteinuria by improving glomerular permselectivity in IgA nephritis[J].Kidney International,2000,58(6):2485-2491.
20 石晓云,陈香美,刘述文,等.血管紧张素转换酶抑制剂对IgA肾病的疗效及影响因素分析[J].中华内科杂志,2002,41 (6):399-403.
21 曾春,叶琨,龚智峰,等.骨化三醇联合厄贝沙坦治疗Ig A肾病的临床观察[J].实用医学杂志,2011,27(23):4279-4281.
22 陈香美,陈以平,周柱亮,等.肾乐胶囊治疗IgA肾病肺脾气虚证患者的前瞻性多中心随机对照临床研究[J].中国中西医结合杂志,2006,26(12):1061-1065.
23 Kanno Y,Okada H,Yamaji Y,et al.Angiotensin-converting-enzyme inhibitors slow renal decline in IgA nephropathy,independent of tubulointerstitial flbrosis at presentation[J].QJM,2005,98(3):199-203.
24 关晓东,吴宇芳,赵文.火把花根片联合厄贝沙坦治疗IgA肾病的临床观察[J].中国中西医结合杂志,2005,3(5):366-369.
25 陈香美,陈建,陈以平.肾华片治疗IgA肾病(气阴两虚证)多中心随机对照临床观察[J].中国中西医结合杂志,2007,27(2):101-105.
26 Cheng IKP,Fang GX,Wong MC,et al.A randomized prospective comparison of nadolol,captopril with or without ticlopidine on disease progression in IgA nephropathy[J].Nephrology,1998,4(1/2):19-26.
27 Shimizu A,Takei T,Uchida K,et al.Low dose losartan therapy reduces proteinuria in normotensive patients with immunoglobulin A nephropathy[J].Hypertens Res,2008,31(9):1711-1717.
28 Maschio G,Cagnoli L,Claroni F,et al.ACE inhibition reduces proteinuria in normotensive patients with IgA nephropathy:amulticentre,randomized,placebo-controlled study[J].Nephrol Dial Transplant,1994,9(3):265-269.
29 Roccatello D,Mengozzi G,Gigliola G,et al.Effects of angiotensin Ⅱ blockade on nitric oxide blood levels in IgA nephropathy[J].Nephrol Dial Transplant,2000,15(7):988-993.
30 Russo D,Minutolo R,Pisani A,et al.Coadministration of losartan and enalapril exerts additive antiproteinuric effect in IgA nephropathy[J].Am J Kidney Dis,2001,38(1):18-25.
31 Song JH,Lee SW,Suh JH,et al.The effects of dual blockade of the renin-angiotensin system on urinary protein and transforming growth factorbetaexcretion in 2 groups of patients with IgA and diabetic nephropathy[J].Clin Nephrol,2003,60(5):318-326.
32 Nolin L,Courteau M.Management of IgA nephropathy:evidence-based recommendations[J].Kidney Int,1999,70(Suppl):S56-S62.
33 Amoroso L,De Sanctis L,Cappelli P,et al.Management of IgA nephropathy[J].G Ital Nefrol, 2011,28(6):622-632.
34 Liu XJ,Geng YQ,Xin SN,et al.Antithrombotic drug therapy for IgA nephropathy:a meta analysis of randomized controlled trials[J].Intern Med,2011,50(21):2503-2510.
35 宋锴,姜山,石永兵,等.鱼油治疗IgA肾病的Meta分析[J].中华肾脏病学杂志,2010,26(6):438-441.
36 Reid S,Cawthon PM,Craig JC,et al.Non-immunosuppressive treatment for IgA nephropathy[J].Cochrane Database Syst Rev, 2011,16(3):CD003962.
37 胡泉,叶学锋,涂翔,等.IgA肾病血尿的中医药治疗Meta分析[J].时珍国医国药,2010,21(8):2126-2127.
