冠状动脉易损斑块的药物治疗研究进展
2013-04-19陈毓青梁丽萍
陈 虹,陈毓青,梁丽萍
冠状动脉粥样硬化性心脏病(coronary heart disease,CHD)的发病率和病死率逐步上升,严重威胁着人类健康。急性冠脉综合征(acute coronary syndromes,ACS)是冠心病急症,包括ST段抬高ACS和非ST段抬高ACS两大类,后者包括非ST段抬高心肌梗死和不稳定型心绞痛。从病理学看,ACS是以冠状动脉粥样硬化斑块进展为易损斑块(vulnerable plaque)突发破溃,继发完全或不完全闭塞性血栓形成。因此,如何稳定和(或)逆转易损斑块至关重要。本文就易损斑块的概念、诊断标准及药物治疗最新研究进展做一综述。
1 易损斑块的概念及诊断标准
1.1 易损斑块的概念 1966年Constantinides[1]首次证实斑块破裂(plaque rupture)是大多数急性心血管疾病发作的原因。后来,Muller等[2]用“易损斑块”来描述引起ACS及猝死的冠状动脉斑块。Libby[3]提出易损斑块是指病变纤维帽较薄、易撕裂、具有大的脂质核心和巨噬细胞来源的泡沫细胞,病变多为偏心分布,易形成血栓。当前认为易损斑块是指不稳定、易形成血栓、易于破裂而导致不良心脏事件的斑块。
1.2 易损斑块的诊断标准[4]主要标准:(1)活动性炎症(单核巨噬细胞或T淋巴细胞浸润);(2)薄纤维帽、大脂核;(3)内皮脱失,表面血小板聚集;(4)斑块裂隙;(5)狭窄≥90%。次要标准:(1)表面钙化结节;(2)斑块呈亮黄色;(3)斑块内出血;(4)内皮功能异常;(5)血管扩张性(正性)重构。
2 易损斑块的药物治疗进展
2.1 羟甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂 HMG-CoA还原酶抑制剂他汀类药物是临床降血脂最有效最常用的药物,是动脉粥样硬化的一线用药,可以稳定冠状动脉斑块[5-6],能降低再发心血管事件30%的危险[7]。国外研究报道,在ST段抬高ACS患者入院后,前24 h内使用他汀类药物可明显降低病死率[8]。他汀类药物通过抑制胆固醇的合成而发挥调血脂作用。此外,除了调血脂作用,他汀类药物还具有多效性效应来稳定斑块:(1)改变斑块组成,主要是减少斑块的脂质成分,尤其是胆固醇酯;(2)降低炎性递质和炎性细胞的活性,包括富含巨噬细胞的泡沫细胞数量,减轻炎症反应;(3)降低血小板膜胆固醇的含量,改善血小板流动性,使血小板不易形成血栓,降低血栓风险;(4)改善内皮功能,主要是高胆固醇血症可引起冠状动脉内皮功能紊乱和异常血管收缩反应;(5)抑制斑块内的新生血管,Koutouzis等[9]研究认为他汀类药物能减少斑块内的新生血管,起到稳定斑块的作用。
血管内超声(intravascular unltrasound,IVUS)常用粥样斑块体积百分比(percent atheroma volume,PAV)和斑块总体积(total atheroma volume,TAV)来评价冠状动脉病变,这两项指标均可用于评价斑块的变化或消退。荟萃SATURN[10]、REVERSAL[11]、ASTEROID[12]、COSMOS[13]4项他汀类药物治疗CHD并以IVUS评价冠状动脉斑块变化的大型临床试验结果一致显示,他汀类药物治疗能显著降低低密度脂蛋白胆固醇(LDL-C)水平,同时升高载脂蛋白A1(ApoA1)、高密度脂蛋白胆固醇(HDL-C)水平,使得冠状动脉斑块消退。其中,2011年美国心脏学年会上公布的临床SATURN研究进一步证实他汀类药物能够促进冠状动脉斑块消退,而SATURN研究是对ASTEROID和COSMOS研究的进一步验证。适度调脂有助于冠状动脉粥样斑块的消退(见表1)。
适度调脂是指他汀类药物治疗达到减少胆固醇流入斑块的目标值:降低LDL-C>45%(1.81~2.46 mmol/L),同时达到增加胆固醇流出斑块的目标值:升高ApoA1>9%(3.50~3.89 mmol/L)和HDL-C>8%(1.17~1.42 mmol/L),可以实现冠状动脉斑块的消退。他汀类药物使冠状动脉斑块消退的调脂目标值并不一定是指使用大剂量他汀类药物。
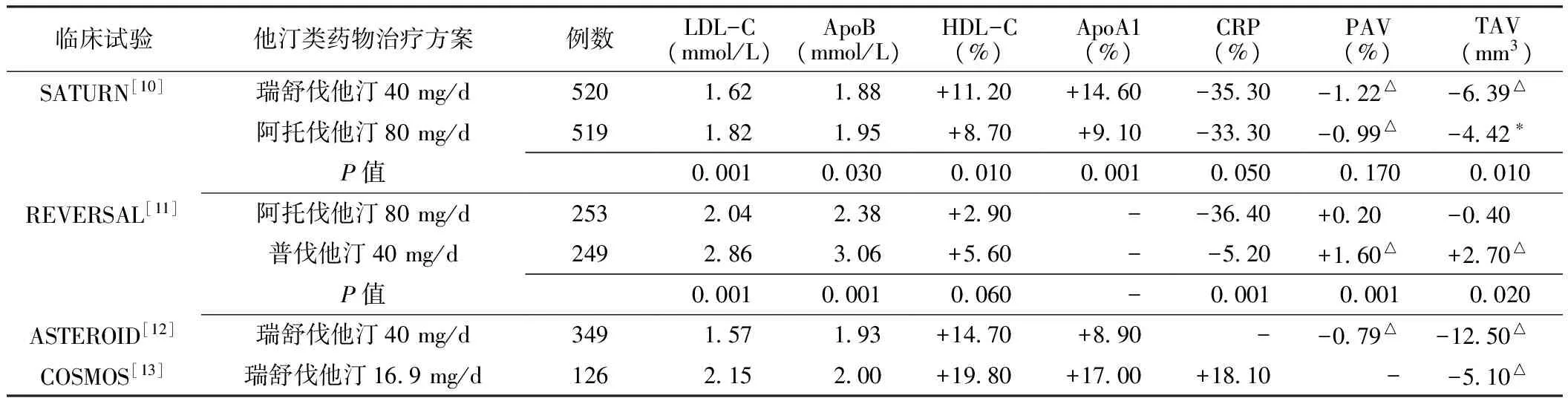
表1 4项有关调脂治疗与冠状动脉粥样斑块消退的研究结果Table 1 Results of researches in regression of coronary atherosclerotic plaque treated with lipid-regulating therapy
注:LDL-C=低密度脂蛋白胆固醇,ApoB=载脂蛋白B,HDL-C=高密度脂蛋白胆固醇,ApoA1=载脂蛋白A1,CRP=C反应蛋白,PAV=斑块体积百分比,TAV=斑块总体积;+表示上升,-表示下降;与试验前比较,*P<0.01,△P<0.001
2.2 抗血小板药物 作为冠心病二级预防的重要措施,抗血小板药物包括以下3类:环氧化酶抑制剂(如阿司匹林)、血小板二磷腺苷(ADP)受体拮抗剂(如噻氯吡啶类、氯吡格雷)和血小板膜糖蛋白Ⅱb/Ⅲa(GPⅡb/Ⅲa)受体拮抗剂。阿司匹林抗血小板的主要机制是抑制环氧化酶,阻碍花生四烯酸衍变为血栓素A2,降低血小板的聚集率,还能够改善内皮依赖的血管扩张;降低各种炎性递质水平。阿司匹林能够通过抑制LDL的氧化和改善内皮功能,减缓粥样硬化的进展。阿司匹林的抗氧化作用已在正常血压和高血压动物实验中得到证实[14]。目前临床常用的血小板ADP受体拮抗剂有噻氯吡啶和氯吡格雷,均属噻吩并吡啶类化合物。氯吡格雷抑制血小板膜ADP受体的作用比噻氯吡啶约强30倍,可降低血液纤维蛋白原水平和黏稠度,且具有抗凝作用。研究表明,ADP受体拮抗剂在降低心血管事件中的作用与稳定原有或潜在的易损斑块相关[15]。血小板ADP受体拮抗剂的新剂型(普拉格雷、替卡格雷、坎格雷洛)已经被评估。TRITONTIMI-38[16]研究显示,普拉格雷与氯吡格雷相比,可以显著地降低心血管死亡、心肌梗死或非致死性脑卒中等终点事件,这种降低不但发生在治疗的早期阶段,而且持续整个治疗期间。而且普拉格雷还能显著降低支架内血栓形成的发生率,降低幅度达50%。GPⅡb/Ⅲa受体拮抗剂可抑制纤维蛋白原与血小板膜表面GPⅡb/Ⅲa受体结合,使血小板GPⅡb/Ⅲa受体被阻断,不能与纤维蛋白结合,阻碍血小板相互结合并聚集,阻断血小板最后共同通路,抑制多种途径所诱导的血小板聚集[17]。目前研究开发的GPⅡb/Ⅲa受体抑制剂按化学性质可分为单克隆抗体阿昔单抗、合成肽类抑制剂如埃替非巴肽等和低分子量非肽仿生物替罗非班3类。
2.3 血管紧张素转换酶抑制剂(ACEI) ACEI仅能中等程度降低血压,却能显著降低心血管事件。ACEI对血管生理的有益作用不仅归因于血压的降低,还要归因于对血管紧张素Ⅱ的抑制,以及由此对炎症反应的抑制。ACEI作用机制:(1)抑制血管紧张素转换酶、血管紧张素Ⅱ的形成;(2)减少缓激肽降解,促使内皮细胞一氧化氮(NO)和依前列醇合成和释放;(3)抑制交感神经递质释放;(4)抗心血管病理性重构。有研究发现,ACEI治疗能显著降低患者颈动脉内膜平均厚度,具有明显抗动脉粥样硬化作用[18]。因此,抑制斑块内血管紧张素转换酶的活性,能够减少斑块的尺寸,减轻血管壁的炎症反应,降低斑块破裂和血栓形成的风险,最终促进易损斑块的稳定。
2.4 抗高血压药物 任何能够降低血压的药物均能够降低环形压力,从而促进斑块稳定。研究显示,氨氯地平能显著降低患者颈动脉内膜平均厚度,降低具有高心血管危险因素人群的ACS发病率[19]。抗高血压药物还可降低静息和运动时血压、心率,从而降低了脂质斑块纤维帽上的环形压力,从而减少斑块的破裂倾向。
2.5 β-受体阻滞剂 β-受体阻滞剂无抗动脉粥样硬化、抗栓、促纤溶或抗痉挛作用,却能够降低再梗死率25%[20]。这可能与其减慢心率并降低血压,减轻血流对斑块的应力损伤,减轻炎症反应和血管重塑等作用有关。
2.6 ω-3脂肪酸 研究显示,进食或补充ω-3脂肪酸的患者其冠状动脉粥样斑块比较稳定,且致死性和非致死性心肌梗死的危险降低,冠状动脉源性猝死的发生率降低[21]。这可能与其抗心律失常、抗炎、改善内皮功能以及降低血小板聚集和延长出血时间等作用有关。
3 小结
冠状动脉粥样硬化是CHD最主要病因,CHD患者发生急性冠状动脉事件的后果十分严重,常危及生命,而易损斑块是导致ACS的主要“罪犯”病变。因此,对易损斑块的早期识别,局部治疗如介入治疗,能迅速开通阻塞的冠状动脉,可短期迅速获益,挽救濒死心肌,但全身综合治疗如强化的药物治疗,可延缓疾病进展及新发易损斑块形成,甚至他汀类药物能够促进冠状动脉斑块消退,药物干预治疗价格便宜,更易推广实施,对于急性心血管事件的防治具有非常重要的临床指导意义。
1 Constantinides P.Plaque fissures in human coronary thrombosis[J].J Atheroscler Res,1966,6(3):1-17.
2 Muller JE,Abela GS,Nesro RW,et al.Triggers,acute risk factors and vulnerable plaques:the lexicon of a new frontier[J].J Am Coll Cardiol,1994,23(5):809-813.
3 Libby P.Coronary artery injury and the biology of atherosclerosis:inflammation,thrombosis,and stabilization[J].Am J Cardiol,2000,86(8):3-8.
4 Naghvi M,Libby P,Falk E,et al.From vulnerable plaque to vulnerable patient:a call for new definition and risk assessment strategies:part I[J].Circulation,2003,108(14):1664-1672.
5 Stanley C,Owen CR,Masamichi T,et al.Association of statin therapy with reduced coronary plaque rupture:an optical coherence tomography study[J].Coron Artery Dis,2008,19(4):237-242.
6 Stephanie DR,Silvio HL,Michael PS,et al.Statins improve human coronary atherosclerotic plaque morphology[J].Tex Heart Inst J,2008,35(2):99-103.
7 Akdim F,van Leuven SI,Kastelein JJ,et al.Pleiotropic effects of statins:stabilization of the vulnerable atherosclerotic plaque?[J].Curr Pharm Des,2007,13(10):1003-1012.
8 Lenderink T,Boersma E,Gitt AK,et al.Patients using statin treatment within 24 h after admission for ST-elevation acute coronary syndromes had lower mortality than non-users:a report from the first Euro Heart Survey on acute coronary syndromes[J].Eur Heart J,2006,27(15):1799-1804.
9 Koutouzis M,Nomikos A,Nikolidakis S,et al.Statin treated patients have reduced intraplaque angiogenesis in carotid endarterectomy specimens[J].Atherosclerosis,2007,192(2):457-463.
10 Nicholls SJ,Ballantyne CM,Barter PJ,et al.Effect of two intensive statin regimens on progression of coronary disease[J].N Engl J Med,2011,365(22):2078-2087.
11 Nissen SE,Tuzcu EM,Schoenhagen P,et al.Effect of intensive compared with moderate lipid-lowering therapy on progression of coronary atherosclerosis:a randomized controlled trial[J].JAMA,2004,291(9):1071-1080.
12 Nissen SE,Nicholls SJ,Sipahi I,et al.Effect of very high-intensity statin therapy on regression of coronary atherosclerosis:the ASTEROID trial[J].JAMA,2006,295(13):1556-1565.
13 Takayama T,Hiro T,Yamagishi M,et al.Effect of rosuvastatin on coronary atheroma in stable coronary artery disease:multicenter coronary atherosclerosis study measuring effects of rosuvastatin using intravascular ultrasound in Japanese subjects(COSMOS)[J].Circ J,2009,73(11):2110-2117.
14 Wu R,Lamontagne D,de Champlain J.Antioxodative properties of acetylsalicylic acid on vascular tissues from normotensive and spintaneously hypertensive rats[J].Circulation,2002,105(3):387-392.
15 Yusuf S,Mehta SR,Zhao F,et al.Early and late effects of clopidogrel in patients with acute coronary syndromes[J].Circulation,2003,107(7):966-972.
16 Wiviott SD,Antman EM,Gibson CM,et al.Evaluation of prasugrel compared with clopidogrel in patients with acute coronary syndromes:design and rationale for the trial to assess improvement in therapeutic outcomes by optimizing platelet Inhibition with prasugrel thrombolysis in myocardial infarction 38(TRITON-TIMI 38)[J].Am Heart J,2006,152(4):627-635.
17 Frojmovic M,Labarthe B,Legrand C.Inhibition and reversal of platelet aggregation by alphallbbeta3 antagonists depends on the anticoagulant and flow condition:differential effects of abciximab and lamifiban[J].Br J Haematol,2005,131(3):348.
18 Yusef S,Sleight P,Pogue J,et al.Effects of an angiotensin-converting-enzyme inhibitor,ramipril,on cardiovascular events in high-risk patients[J].N Engl J Med,2000,342(3):145-153.
19 Pitt B,Byington RP,Furberg CD,et al.Effect of amlodipine on the progression of atherosclerosis and the occurrence of clinical events[J].Circulation,2000,102(13):1503-1510.
20 Held PH,Yusuf S.Effects of beta-blockers and calcium channel blockers in acute myocardial infarction[J].Eur Heart J,1993,14(1):18-25.
21 Bucher HC,Hengstler P,Schindler C,et al.N-3 polyunsaturated fatty acids in coronary heart disease:a meta-analysis of randomized controlled trials[J].Am J Med,2002,112(4):298-304.
