叶酸、维生素B6和维生素B12对高同型半胱氨酸血症大鼠心室重构的影响
2013-04-19王会芹
王会芹,郭 宏,赵 慧
心室重构是引起心功能不全乃至心力衰竭的内在原因[1],以心肌肥厚、心肌细胞凋亡及某些细胞、非细胞成分(胶原纤维)的异常增加和心肌代谢及电生理的改变为特征。心室重构影响患者的长期预后,而给予血管紧张素转换酶抑制剂(ACEI)等药物尚不能充分抑制心室重构。近期研究表明,高同型半胱氨酸血症(hyperhomocysteinemia,HHcy)可独立于动脉粥样硬化,直接损伤心肌细胞,引起心室重构[2-4]。基质金属蛋白酶9(MMP-9)在多种心脏疾病的心室重构中发挥重要作用[5-7]。Chen等[8]临床观察发现老年人中HHcy患者与叶酸、维生素B6和维生素B12摄入量不足有关;Heinz等[9]、Glynn等[10]临床研究表明补充充足的叶酸、维生素B6和维生素B12可有效降低HHcy患者血浆同型半胱氨酸(homocysteine,Hcy)水平。然而鲜见有文献研究补充该组维生素是否可以抑制HHcy所致的心室重构。
本研究通过高蛋氨酸饮食喂养大鼠制造HHcy模型,同时给予叶酸、维生素B6和维生素B12降低血浆Hcy水平,观察大鼠血浆Hcy水平降低的同时,心室的超声学、病理组织学等是否改善,心肌细胞MMP-9的表达是否下降,以评价心室重构是否改善,为补充叶酸、维生素B6和维生素B12抑制心室重构提供实验依据。
1 材料与方法
1.1实验动物健康雄性Wistar大鼠60只,购自北京维通利华实验动物技术有限公司〔许可证号SCXK(京)2002-003〕,由哈尔滨医科大学第一临床医学院实验动物中心饲养,饲养环境温度为21~24 ℃,相对湿度(50±5)%,自然照明。体质量(BW)为(200±50)g,采用随机数字表,将大鼠随机分为正常组(A组)、HHcy模型组(B组)、药物干预组(C组)3组,各20只。A、B、C组大鼠BW分别为 (198±52)g、(202±53)g、(200±49)g。
1.2试剂Hcy试剂盒(美国雅培公司);MMP-9放免分析试剂盒(武汉博士德生物工程有限公司);Masson 3色染色试剂盒(福州迈新生物技术开发有限公司);二氨基联苯胺(DAB,北京中杉金桥生物技术有限公司)。
1.3方法
1.3.1动物模型制备A组大鼠喂食基础饲料(全价颗粒饲料),B组大鼠喂食蛋氨酸饲料(基础饲料加1.7%蛋氨酸),C组大鼠喂食蛋氨酸饲料加B族维生素(维生素B612 mg·kg-1·d-1、维生素B120.09 mg·kg-1·d-1、叶酸4 mg·kg-1·d-1)。各组大鼠自由进食饮水,连续喂食8周造模。喂食8周后,大鼠空腹6 h以上,用10%水合氯醛(3 ml/kg)腹腔注射麻醉,开腹,暴露下腔静脉。用5 ml注射器采静脉血2 ml,置入EDTA抗凝管中,半小时内3 000 r/min,离心10 min,取上层血浆-80 ℃保存,采用全自动化学发光法检测Hcy水平,判断大鼠造模是否成功。
1.3.2心脏彩超检查大概喂食8周后,分别称取BW及称量包括室间隔在内的左心室质量(LVW)。将麻醉后的大鼠取仰卧位固定,胸前备皮,应用探头频率为14 MHz的彩色多普勒超声诊断仪进行心脏彩超检查。取胸骨旁左心长轴切面和左心室乳头肌短轴切面,图像分析左心室舒张末期内径(left ventricular end-diastolic diameter,LVEDd)、左心室舒张末期后壁厚度(left ventricular end-diastolic posterior wall thickness,LVPWd),计算左心室射血分数(left ventricular ejection diameter,LVEF)、左心室短轴缩短率(fractional shortening,FS),FS按如下公式计算:FS(%)=(LVEDd-LVESd)/LVEDd×100%。
1.3.3病理组织学和免疫组织化学检查用锋利双面刀片沿左心室正中横切,取约0.5 cm×0.5 cm的左室游离壁中段组织,放入4%预冷的多聚甲醛中前固定,再以15%乙醇甲醛液后固定,经无水乙醇脱水、入蜡、包埋、机器切片5 μm、烘片后备用。冷冻切片苏木素-伊红(HE)染色检查组织形态,显微镜下观察心肌的变化、纤维组织增生情况。
心肌组织MMP-9免疫组化染色:取各组动物心肌石蜡切片,脱蜡、水化组织切片。以磷酸盐缓冲液(PBS)替代一抗作为阴性对照;3%过氧化氢孵育5 min,阻断内源性过氧化氢物酶;复合消化酶消化(胰酶消化),室温10 min;分别滴加一抗抗体,4 ℃过夜,PBS冲洗5 min×3;滴加通用型IgG抗体(Fab段)-HRP多聚体,室温或37 ℃孵育10 min,PBS冲洗5 min×3;DAB溶液显色;蒸馏水冲洗、复染、脱水、封片。用计算机病理图像分析系统的组化分析系统模块进行图像分析,计算MMP-9表达的阳性目标面密度(scale value,Sv)。
1.3.4心肌组织Masson 3色染色切片脱蜡处理至水;滴加1滴(100 μl)Masson复合染色液染色5 min。蒸馏水冲掉染液;滴加1滴(100 μl)磷钼酸染色5 min,甩干;直接滴加1滴(100 μl)苯胺蓝染色5 min蒸馏水稍冲;滴加1滴(100 μl)分化液分化30~60 s(2次);95%乙醇、无水乙醇脱水,透明,封固。Masson 3色染色中胶原纤维呈蓝绿色,变性纤维泛白色,肌细胞呈红色。用计算机病理图像分析系统的组化分析系统模块进行图像分析,计算心肌胶原纤维的阳性目标Sv。
2 结果
2.1血浆Hcy水平比较大鼠喂食8周后,A组大鼠血浆Hcy水平为(9.2±0.9)μmol/L,B组为(39.2±2.1)μmol/L,C组为(11.2±1.3)μmol/L。3组大鼠血浆Hcy水平比较,差异有统计学意义(F=11.52,P=0.003);其中A组、C组大鼠血浆Hcy水平与B组比较,差异均有统计学意义(P<0.01)。
2.2大鼠LVW及LVW/BW于实验前及实验8周后,测定每组7只大鼠的LVW及BW。实验前,3组大鼠BW、LVW、LVW/BW比较,差异均无统计学意义(P>0.05);实验8周后,3组大鼠BW、LVW、LVW/BW比较,差异均有统计学意义(P<0.05);其中B组、C组大鼠LVW/BW与A组比较,C组大鼠LVW/BW与B组比较,差异均有统计学意义(P<0.01,见表1)。
2.3大鼠心功能测定实验8周后,分别检测3组大鼠的心功能。结果显示,3组大鼠EF、LVEDd、LVPWd、FS比较,差异均有统计学意义(P<0.01);其中B、C组大鼠上述4项指标与A组比较,C组大鼠上述4项指标与B组比较,差异亦有统计学意义(P<0.01,见表2)。
2.4心肌病理组织学和免疫组织化学检查结果
2.4.1心肌病理组织学改变光镜下:A组肌细胞排列有序、肌纤维结构正常,为正常心肌组织;B组心肌组织发生纤维化,肌纤维排列紊乱;C组大部分心肌纤维结构正常,但部分心肌仍可见轻度纤维化(见图1)。与A组比较,B组心肌病理组织学改变明显减轻。
表1 实验前及实验8周后3组大鼠BW、LVW及LVW/BW的比较
注:BW=体质量,LVW=左心室质量;与A组比较,*P<0.01;与B组比较,△P<0.01

图1 3组大鼠心肌HE染色光镜下病理组织学改变(×200)
Table2Comparison of echocardiography data in the three groups 8 weeks after experiment

组别只数EF(%)LVEDd(mm)LVPWd(mm)FS(%)A组782±4 4.90±0.24 2.37±0.05 44.47±2.06 B组767±4* 6.86±0.44* 2.18±0.04* 30.66±2.52* C组774±6*△5.68±0.49*△2.29±0.05*△37.50±2.90*△F值12.5610.9311.3213.72P值0.0050.0090.0080.003
注:EF=射血分数,LVEDd=左室舒张末期内径,LVPWd=左室舒张末期后壁厚度,FS=左室短轴缩短率;与A组比较,*P<0.01;与B组比较,△P<0.01
2.4.2免疫组化法测定心肌组织MMP-9的表达MMP-9阳性细胞在心肌细胞中呈深棕色。实验8周后,A、B、C组大鼠心肌MMP-9的表达分别为(0.0508±0.0067)、(0.1373±0.0204)和(0.0970±0.0218),3组间比较差异有统计学意义(F=12.23,P=0.006);B、C组大鼠心肌MMP-9的表达与A组比较,C组大鼠心肌MMP-9的表达与B组比较,差异均有统计学意义(P<0.01,见图2)。
2.5大鼠心肌组织Masson 3色染色结果Masson 3色染色中胶原纤维呈蓝绿色,变性纤维泛白色,肌细胞呈红色。于实验8周后,经心肌胶原纤维Masson 3色染色半定量分析,A、B、C组大鼠心肌胶原纤维阳性目标Sv分别为(0.5107±0.0764)、(6.9070±0.9103)和(2.8026±0.7052),3组比较差异有统计学意义(F=12.23,P=0.006);其中B组、C组大鼠心肌胶原纤维阳性目标Sv与A组比较,C组与B组比较,差异均有统计学意义(P<0.01,见图3)。
3 讨论
确认动物模型的建立是动物实验的首要条件之一。以往研究表明高蛋氨酸饮食负荷方法可以制造HHcy的模型[11-12]。本研究显示,用1.7%蛋氨酸饮食喂养大鼠,发现8周后大鼠血浆Hcy水平较正常大鼠显著增高,证实造模方法可靠。
Nasir等[13]通过对6 814例无症状HHcy患者的研究发现,Hcy水平升高与利用磁共振加权成像检测到的左心室局部功能收缩功能减低相关。Guéant-Rodriguez等[14]通过对冠状动脉造影未发现冠状动脉明显病变的709例患者观察,发现Hcy水平升高与左心室功能障碍、EF降低有关。本研究结果显示,HHcy大鼠LVW/BW较正常大鼠显著升高,而进行叶酸、维生素B6和维生B12治疗的大鼠LVW/BW则较HHcy大鼠显著降低。同时,心脏彩超检查显示HHcy大鼠LVEDd增大,左心室后壁变薄,EF降低;而叶酸、维生素B6和维生B12治疗的大鼠LVEDd则较HHcy大鼠显著降低,EF、LVPWd、FS较HHcy大鼠显著升高。可见,叶酸、维生素B6和维生B12能改善HHcy大鼠心室功能障碍,为心功能不全提供新的治疗途径。
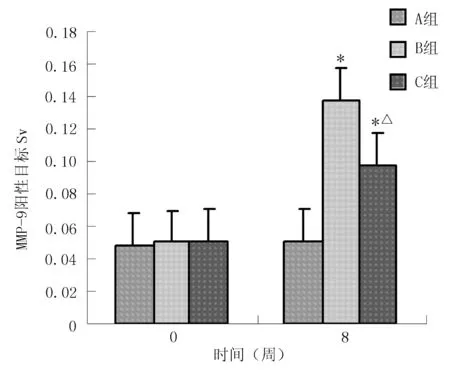
注:与A组比较,*P<0.01;与B组比较,△P<0.01
图23组大鼠心肌组织MMP-9的表达结果
Figure2MMP-9 expressions in myocardial tissues of three different groups

注:与A组比较,*P<0.01;与B组比较,△P<0.01
图3各组心肌Masson 3色染色胶原纤维定量
Figure3Collagen fiber quantification in myocardium staining with Masson 3-color
MMP-9是降解细胞外基质的锌依赖蛋白酶,有研究发现MMP-9在心室重构中发挥重要作用[5-7]。本研究应用免疫组织化学检测观察心肌MMP-9的表达,结果显示HHcy大鼠心肌MMP-9的表达较正常大鼠显著增高,同时Masson 3色染色半定量显示心肌胶原纤维化较正常大鼠增加;而叶酸、维生素B6和维生B12治疗的大鼠心肌MMP-9的表达较HHcy大鼠显著降低,心肌胶原纤维化较HHcy大鼠降低。说明高Hcy增加心肌细胞MMP-9的表达,引起心肌纤维化,从而导致心室重构。Ducharme等[15]发现MMP-9基因缺失可减小实验性大鼠心肌梗死后至少15 d内的左心室腔扩张程度,同时也证实了MMP-9基因缺陷大鼠心肌梗死后左心室扩张的受限现象,伴随有炎症反应的减弱,胶原沉积的减少,梗死愈合的延迟。Moshal等[16]通过实验发现MMP-9基因的缺失能降低心力衰竭时心肌组织的收缩功能不全。其具体机制尚不清楚,需要进一步研究。
叶酸作为体内甲基的间接供体,维生素B6作为胱硫醚-β-合成酶及胱硫醚的辅酶,维生素B12作为蛋氨酸合成酶的辅酶,均影响体内Hcy的代谢。叶酸、维生素B6、维生素B12作为Hcy代谢过程中的重要调节因子,影响着体内Hcy的水平。Waskiewicz等[17]通过对20~74岁的人群随机抽样调查发现,叶酸、维生素B6、维生素B12与血浆Hcy水平呈反向趋势变化,叶酸、维生素B6、维生素B12摄入不足可以导致血浆Hcy升高,而补充适量叶酸、维生素B6、维生素B12可以降低血浆Hcy水平。本研究也发现叶酸、维生素B6和维生素B12可有效降低Hcy水平,同时还可以减少心脏LVEDd,改善心室EF,降低心肌MMP-9的表达,减轻心肌纤维化程度,改善心室重构。
目前,国内外已有研究表明高Hcy能够影响心室重构和心脏功能,但其机制目前尚不清楚。体外研究证明Hcy可使心肌细胞凋亡坏死,其主要机制是活性氧自由基(Ros)的产生及核氮氧化物表达增加[18]。也有研究表明Hcy可以通过在H9C2心肌细胞内产生过氧亚硝基阴离子,并活化心肌细胞内两种主要激酶〔细胞外调节蛋白激酶(ERK)和氨基端激酶(JNK)〕,促进细胞凋亡[19]。Dong等[20]研究显示Hcy可通过NADPH氧化酶和(或)SAPK/JNK途径诱导细胞氧化应激,促进细胞凋亡。此外,升高的Hcy引起细胞核p47phox表达,使核活性氧自由基的产生增多,促进细胞凋亡[21]。本实验证明Hcy可以通过增加心肌MMP-9的表达,促进心肌纤维化,导致心室重构。但是Hcy是如何激活MMP-9并通过何种机制参与心肌纤维化并导致心室重构值得深入研究。
总之,HHcy时LVEDd增大,EF下降,LVW/BW、心肌MMP-9表达量、心肌胶原纤维化增加,心室重构;而叶酸、维生素B6和维生素B12可以有效降低血浆Hcy水平,同时可以改善HHcy引起的心肌纤维化,减少心室重构过程中起重要作用的MMP-9的表达,延缓心室重构。这一发现可能为HHcy的一级预防提供了新方法。但本研究并未进行叶酸、维生素B6维生素B12的分组分析,未能证明各种维生素各自的作用及作用机制,尚待进一步研究。
1Konstam MA,Kramer DG,Patel AR,et al.Left ventricular remodeling in heart failure[J].J Am Coll Cardiol Img,2011,4(1):98-108.
2Bai YP,Liu YH,Chen J,et al.Rosiglitazone attenuates NF-kappaB-dependent ICAM-1 and TNF-alpha production caused by homocysteine via inhibiting ERK1/2/p38MAPK activation[J].Biochem Biophys Res Commun,2007,360(1):20-26.
3Walker E,Black J,Parris C,et al.Effect of experimental hyperhomocysteinemia on cardiac structrue and function in the rat[J].Ann Clin Lab Sci,2004,34(2):175-180.
4Sipkens JA,Krijnen PA,Meischl C,et al.Homocysteine affects cardiomyocyte viability:concentration-dependent effects on reversible flip-flop,apoptosis and necrosi[J].Apoptosis,2007,12(8):1407-1418.
5Hansson J,Lind L,Hulthe J,et al.Relations of serum MMP-9 and TIMP-1 levels to left ventricular measures and cardiovascular risk factors:a population-based study[J].Eur J Cardiovasc Prev Rehabil,2009,16(3):297-303.
6Matsumoto Y,Park IK,Kohyama K.Matrix metalloproteinase(MMP)-9,but not MMP-2,is involved in the development and progression of C protein-Induced myocarditis and subsequent dilated cardiomyopathy[J].J Immunol,2009,183(7):4773-4781.
7Zile MR,DeSantis SM,Baicu CF,et al.Plasma biomarkers that reflect determinants of matrix composition identify the presence of left ventricular hypertrophy and diastolic heart failure[J].Circ Heart Fail,2011,4(3):246-256.
8Chen HC,Chen KJ,Wang CH,et al.Association of B vitamins status and homocysteine levels in elderly Taiwanese[J].Asia Pac J Clin Nutr,2005,14(3):250-255.
9Heinz J,Kropf S,Domröse U,et al.B vitamins and the risk of total mortality and cardiovascular disease in end-stage renal disease:results of a randomized controlled trial[J].Circulation,2010,121(12):1432-1438.
10Glynn RJ,Manson JE,Christen WG,et al.Effect of folic acid and B vitamins on the occurrence of venous thromboembolism:a randomized trial in women at high cardiovascular risk[J].Circulation,2008,118:S1137-S1143.
11Dayal S,Lentz SR.Murine models of hyperhomocysteinemia and their vascular phenotypes[J].Arterioscler Thromb Vasc Biol,2008,28(9):1596-1605.
12Zhou Ji,Werstuck GH,Lhoták S,et al.Hyperhomocysteinemia induced by methionine supplementation does not independently cause atherosclerosis in C57BL/6J mice[J].FASEB J,2008,22(7):2569-2578.
13Nasir K,Tsai M,Rosen BD,et al.Elevated homocysteine is associated with reduced regional left ventricular function:the multi-ethnic study of atherosclerosis[J].Circulation,2007,115(2):180-187.
14Guéant-Rodriguez RM,Juillière Y,Nippert M,et al.Left ventricular systolic dysfunction is an independent predictor of homocysteine in angiographically documented patients with or without coronary artery lesions[J].J THromb Haemost,2007,5(6):1209-1216.
15Ducharme A,Frantz S,Aikawa M,et al.Targeted deletion of matrix metalloproteinase-9 attenuates left ventricular enlargement and collagen accumulation after experimental myocardial infarction[J].J Clin Invest,2000,106(1):55-62.
16Moshal KS,Rodriguez WE,Sen U,et al.Targeted deletion of MMP-9 attenuates myocardial contractile dysfunction in heart failure[J].Physiol Res,2008,57(3):379-384.
17Waskiewicz A,Sygnowska E,Broda G.Dietary intake of vitamins B6,B12and folate in relation to homocysteine serum concentration in the adult Polish population-WOBASZ project[J].Kardiol Pol,2010,68(3):275-282.
18Sipkens JA,Krijnen PA,Meischl C,et al.Homocysteine affects cardiomyocyte viability:concentration-dependent effects on reversible flip-flop,apoptosis and necrosis[J].Apoptosis,2007,12(8):1407-1418.
19Levrand S,Pacher P,Pesse P,et al.Homocysteine induces cell death in H9C2 cardiomyocytes through the generation of peroxynitrite[J].Biochem Biophys Res Commum,2007,359(3):445-450.
20Dong F,Zhang X,Li SY,et al.Possible involvement of NADPH oxidase and JNK in homocysteine induced oxidative stress and apoptosis in human umbilical vein endothelial cells[J].Cardiovascular Toxicol,2005,5(1):9-20.
21Sipkens JA,Krijnen PA,Hahn NE,et al.Homocysteine-induced cardiomyocyte apoptosis and plasma membrane flip-flop are independent of S-adenosylhomocysteine:a crucial role for nuclear p47(phox)[J].Mol Cell Biochem,2011,358(1/2):229-239.
