阿米福汀在局部晚期非小细胞肺癌放疗中的作用研究
2013-04-19严浩林朱海生梁雷锋
林 展,严浩林,朱海生,梁雷锋
流行病学资料显示,全球每年因肺癌而死亡的病例多达100万,肺癌已经成为发病率和病死率最高的恶性肿瘤[1]。80%的肺癌患者确诊时已进展为晚期或局部晚期,失去了手术机会,大多需要化疗和放疗,但随着根治性放疗所需放射性剂量的增大,放疗相关毒副作用会显著增加。阿米福汀目前已经被美国食品药品监督管理局(FDA)批准用于减轻头颈部放疗引起的口腔干燥等毒副作用,但其是否可以降低非小细胞肺癌(NSCLC)放疗期间严重的放射性食管炎和放射性肺炎的发生率,及是否会降低放疗疗效尚无定论[2-3]。本研究旨在评价阿米福汀在局部晚期NSCLC放疗中对近期疗效的影响及对降低放射性食管炎和放射性肺炎的作用。
1 资料与方法
1.1 病例入选标准
1.1.1 纳入标准 (1)病理或细胞学检查确诊为NSCLC患者;(2)胸部CT提示肺部肿块为可评价病灶;(3)体力状况评分(KPS评分)≤2分;(4)既往未接受过放疗;(5)无远处转移病灶;(6)肝、肾功能等符合放疗要求;(7)填写知情同意书,自愿加入试验研究。
1.1.2 中止试验标准 (1)放疗过程中患者出现难以耐受的非血液学毒性,如严重的恶心、呕吐、放射性肺炎等;(2)放疗过程中出现严重的血液学毒性,如Ⅳ级粒细胞减少,贫血和血小板计数减少;(3)严重的阿米福汀毒副作用,如过敏反应、不能耐受的恶心、呕吐等。
1.2 一般资料 选取2008年1月—2010年2月我院放疗科收治的符合上述纳入标准的局部晚期NSCLC患者62例为研究对象,采用随机数字表分为单纯三维适形放疗组(对照组)和阿米福汀+三维适形放疗组(试验组)。根据中止试验标准最终完成放疗计划者44例,对照组23例,试验组21例,两组患者性别、年龄、KPS评分、病理类型、临床分期比较,差异均无统计学意义(P>0.05,见表1),具有可比性。本研究通过医院伦理委员会审核。
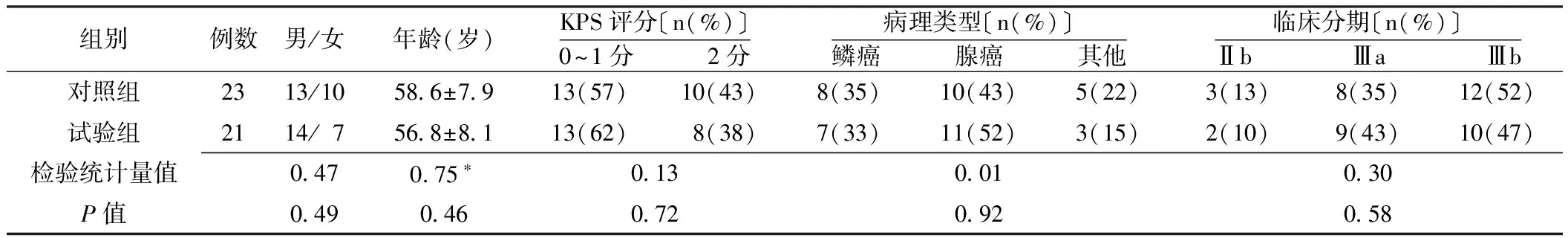
表1 两组患者一般资料比较Table 1 Comparison of general characteristics between the two groups
注:*为t值,余检验统计量值为χ2值;KPS评分=体力状况评分
1.3 方法
1.3.1 阿米福汀给药方案 试验组患者每次放疗前15~30 min,给予阿米福汀300 mg/m2缓慢静脉滴注,同时给予昂丹司琼100 mg 静脉滴注,以降低阿米福汀引起的恶心、呕吐等毒副作用。给药后观察10 min无明显低血压、过敏反应等情况后进入放疗室内行放射治疗。
1.3.2 放疗方案 首先在放疗模拟机下做固定体模,激光标记CT定位,层距、层厚均为5 mm。将CT图像资料传入TPS放疗计划系统,分别于肺窗和纵隔窗勾画肺内病灶和纵隔内病灶。显见肿瘤区(GTV)包括肺内原发肿瘤和纵隔淋巴结。临床靶区(CTV)指定GTV基础上外放1.5~2.0 em,计划靶区(Prv)主要考虑呼吸动度、摆位误差等因素引起的靶区位移,一般沿CTV纵向或横向外扩0.5~0.8 em。治疗师根据剂量体积直方图优化放疗计划,使95%的等剂量线包括Prv,并以此作参考剂量为1.8 Gy/f。肺受量20 Gy体积占全肺比例(V20)<25%,食管受量<60 Gy;Prv高剂量区<105%,脊髓受量≤45 Gy。常规分割1.8 Gy/f,在剂量达36 Gy/20 f时给予缩野1次。总剂量54 Gy/30 f。每周5次,持续6周。
1.3.3 近期疗效及毒副作用评价标准 近期疗效评价:根据世界卫生组织(WHO)制定的实体肿瘤近期疗效评价标准分为完全缓解(CR):全部病灶消失维持4周;部分缓解(PR):瘤体缩小30%~50%维持4周;客观有效:完全缓解+部分缓解。于患者放疗疗程结束后6周评价。
毒副作用:根据放射治疗协作组(RTOG)制定的放疗相关毒副作用标准[4]评价放射性食管炎、放射性肺炎的发生率。于每周放疗结束后评价。
2 结果
2.1 脱落情况 44例患者完成了预定试验(44/62),对照组23例,试验组21例,完成率为71%。其中8例患者未能完成放疗计划,终止放疗的原因主要为:Ⅳ级血液学毒性4例,无法耐受的恶心、呕吐2例,急性心肌梗死1例,急性脑梗死1例;放疗过程中试验组4例患者未能按最初设计的给药方案进行〔给药时间和(或)给药剂量发生变化〕,对照组6例患者放疗中途要求给予阿米福汀,两组共10例患者虽完成放疗,但不符合纳入分析的条件,因而排除在最终结果数据统计外。
2.2 近期疗效比较 对照组CR 1例,PR 11例,客观有效率为52%;试验组CR 2例,PR 12例,客观有效率为67%。两组客观有效率比较,差异无统计学意义(χ2=0.95,P>0.05)。
2.3 放射性食管炎、放射性肺炎累计发生率比较 对照组累计发生放射性食管炎15例(65%),放射性肺炎16例(70%);试验组累计发生放射性食管炎和放射性肺炎各5例(24%)。两组放射性食管炎和放射性肺炎累计发生率比较,差异均有统计学意义(P值分别为0.017和0.003)。
3 讨论
流行病学资料显示,全球肺癌的年发病率超过了120万,每年因肺癌而死亡的人数多达100万[5]。近年来发达国家烟草消费下降,但我国烟草消费却出现上升趋势,我国肺癌的发病率正呈现逐渐上升趋势,预计到2015年我国将成为拥有全球最多肺癌患者的国家[6]。无疑,肺癌已给我国造成了沉重的医疗负担,严重威胁着我国居民的健康。肺癌患者中3/4为NSCLC,而NSCLC确诊时80%已进展为晚期或局部晚期,常无法手术,大多需要行放化疗。在一定的范围内,放疗的疗效和放射线的剂量有关,放疗剂量越大,其疗效越好。因此,高剂量的放疗可以提高肿瘤的缓解率,延长患者的总生存时间和疾病进展时间,甚至可能达到治愈。但大剂量放疗带来肿瘤高缓解率的同时也会带来严重的毒副作用,如严重的放射性食管炎、放射性肺炎和放疗相关血液学毒性,这些严重的毒副作用常会延缓放疗进程,甚至造成患者中止放疗[7-8]。因此,在提高放疗剂量的同时如何降低放疗相关毒副作用成为了研究的热点。目前,关于上述问题的研究方向主要有两方面,一是提高放疗技术,尽量减少正常组织接受的放射线剂量,如目前流行的三维适形调强放疗技术和Cybernife;另一方面为寻找有效的放疗保护药物,此类药物能够降低放疗相关毒副作用但不影响放疗效果。阿米福汀是目前临床上应用较为广泛的放疗细胞保护剂,该药物是20世纪50年代美国Walter Reed陆军研究院研制的一种预防核辐射保护剂,当时研发的目的主要是用于保护美军在核战争中减少核辐射的伤害[9]。但随后的研究发现,阿米福汀可以显著降低NSCLC和卵巢癌患者使用顺铂引起的肾脏毒性和头颈部放疗引起的口腔黏膜干燥[10]。但阿米福汀是否可以降低肺癌放疗过程中的放射性食管炎、放射性肺炎和相关血液学毒性发生率及是否影响放疗疗效一直存在争议。Senzer[11]和Movsas等[12]的两项随机临床对照研究显示,阿米福汀对肺癌放疗过程中严重的放射性食管炎和放射性肺炎并无保护作用。但Komaki等[13]研究结果却显示,阿米福汀可以使肺癌放疗过程中严重的放射性食管炎和放射性肺炎的发生率降低19%和16%。而后的Antonadou等[3]的研究也证实了这一点,在他们的研究结果中,阿米福汀组肺癌患者严重放射性食管炎和放射性肺炎的发生率仅为对照组的1/5和1/3,阿米福汀显示出了良好的疗效。本研究结果显示,对照组放射性食管炎和放射性肺炎的累计发生率分别为65%和70%,试验组均为24%,试验组明显低于对照组,表明阿米福汀有放射防护作用,与Komaki等[13]和Antonadou等[3]研究结果基本一致。
关于放疗过程中应用阿米福汀是否会降低放疗疗效的问题也存在一定的差异。大多数研究结果认为,阿米福汀的应用并不会降低放疗的近期疗效[3,11],但Movsas等[12]的一项较大样本的Ⅲ期临床对照研究结果却提示,阿米福汀的应用可能会降低肺癌放疗的肿瘤缓解率。本研究结果中,对照组客观有效率为52%,试验组客观有效率为67%,无明显差异,提示阿米福汀并不降低放疗的近期疗效。
综上所述,阿米福汀可以降低 NSCLC放疗中放射性食管炎和放射性肺炎的累计发生率,但不降低放疗的近期疗效,与既往大多数随机临床对照研究结果相一致。但应用阿米福汀后患者的长期疗效、总生存时间、疾病无进展生存时间等肺癌治疗的更重要的临床指标有待进一步研究。
1 Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
2 Koukourakis MI,Kyrias G,Kakolyris S,et al.Subcutaneous administration of amifostine during fractionated radiotherapy:arandomized phase Ⅱ study[J].J Clin Oncol,2000,18(11):2226-2233.
3 Antonadou D,Coliarakis N,Synodinou M,et al.Randomized phase Ⅲ trial of radiation treatment +/-amifostine in patients with advanced-stage lung cancer[J].Int J Radiat Oncol Biol Phys,2001,51(4):915-922.
4 Cox JD,Stetz J,Pajak TF.Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer(EORTC)[J].Int J Radiat Oncol Biol Phys,1995,31(5):1341-1346.
5 Jemal A,Siegel R,Ward E,et al.Cancer statistics,2009[J].CA Cancer J Clin,2009,59(4):225.
6 中国抗癌协会肺癌专业委员会.2010中国肺癌临床指南[M].北京:人民卫生出版社,2010:7.
7 杨媚,张莉,艾力,等.非小细胞肺癌放化疗不同联合模式对生活质量影响的评价[J].中国全科医学,2011,14(4):381-387.
8 彭培建,林忠,张红雨,等.厄罗替尼治疗晚期非小细胞肺癌患者的疗效及安全性研究[J].中国全科医学,2010,13(5):1420.
9 Koukourakis MI.Amifostine in clinical oncology:current use and future applications[J].Anticancer Drug,2002,13(3):81-109.
10 彭莉华,孙宜,张修龙,等.阿米福汀对头颈部鳞癌放、化疗疗效和血液学毒性的临床研究[J].中国药房,2006,17(15):1166-1168.
11 Senzer N.A phase Ⅲ randomized evaluation of amifostine in stage ⅢA/ⅢB non-small celllung cancer patients receiving concurrent carboplatin,paclitaxel,and radiation therapy followed by gemcitabine and cisplatin intensification:preliminaryfindings[J].Semin Oncol,2002,29(Suppl 19):38-41.
12 Movsas B,Scott C,Langer C,et al.Randomized trial of amifostine in locally advanced non-small-cell lung cancerpatients receiving chemotherapy and hyperfractionated radiation:radiationtherapy oncology group trial 98-01[J].J Clin Oncol,2005,23(10):2145-2154.
13 Komaki R,Lee JS,Milas L,et al.Effects of amifostine on acute toxicity from concurrent chemotherapy andradiotherapy for inoperable non-small-cell lung cancer:report of a randomizedcomparative trial[J].Int J Radiat Oncol Biol Phys,2004,58(5):1367-1377.
