左心室射血分数正常的慢性心力衰竭患者血清脂联素、B型脑钠肽及肿瘤坏死因子-α的相关性研究
2013-04-19龚玮琦
龚玮琦,江 华,陈 巍,刘 玥
慢性心力衰竭(chronic heart failure,CHF)是各种心脏疾病的严重表现或终末阶段,也是心脏疾病引起死亡的主要原因,其5年生存率与肿瘤相仿。随着人口老龄化程度日趋严重,CHF的发病率呈不断上升的趋势。CHF是由血流动力学、神经内分泌激素以及代谢异常组成的一种复杂的临床症候群。左心室射血分数(LVEF)正常或轻度异常者占CHF患者的50%。脂联素是来源于脂肪细胞参与代谢的细胞因子,B型脑钠肽(BNP)是一种心脏神经激素,肿瘤坏死因子-α(TNF-α)是主要由单核巨噬细胞分泌的具有多种生物学效应的细胞因子。研究发现,收缩性CHF患者血浆脂联素、TNF-α、BNP均显著升高,且升高水平与CHF的严重程度及预后明显相关[1-3],对于LVEF正常的CHF的病理机制研究较少,本研究通过观察LVEF正常的CHF患者血清脂联素、BNP、TNF-α的相关性,探讨其在CHF发病机制中的相关性。
1 对象与方法
1.1 研究对象 选择2009—2011年在上海市东方医院心内科、老年医学科治疗的CHF患者120例(CHF组),其中男84例,女36例;平均年龄(61.8±9.2)岁;基础疾病包括冠心病52例、高血压32例、扩张性心肌病28例、肥厚型心肌病8例。LVEF正常的CHF患者按2007欧洲心脏病学会有关诊断标准:(1)有CHF的症状和体征;(2)LVEF>45%~50%;(3)存在左室松弛度、充盈异常或左心室肥厚、舒张期扩张异常的依据,如超声心动图E/A比值<1,且BNP>220 ng/L。所有患者按美国心脏病协会(NYHA)分级方法对心功能分级,其中心功能Ⅱ级62例、Ⅲ级44例、Ⅳ级14例。排除急性心肌梗死、严重肝肾功能不全者。同时选择健康体检者50例为对照组,其中男35例,女15例;平均年龄(60.1±6.5)岁;经临床及超声心动图检测无器质性心脏病。两组患者的年龄、性别、体质指数(BMI)比较,差异无统计学意义(P>0.05,见表1),具有可比性。
1.2 方法
1.2.1 试剂和仪器 脂联素检测试剂盒(美国assaypro公司),BNP检测试剂盒(美国Biosite公司),人TNF-α检测试剂盒。
1.2.2 全自动生化分析仪标本收集及检测 受试者禁食8 h后于次日凌晨空腹采取外周静脉血,分别测定脂联素、BNP、TNF-α、空腹血糖、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、肌酐、尿酸,同时收集相关临床资料如血压、年龄、BMI。脂联素、TNF-α血清标本-20 ℃保存,其他检测的血清标本采血后1 h内测定。脂联素、TNF-α、BNP均采用酶联免疫吸附双抗体夹心法(ELISA)测定,试剂配制和操作步骤严格按说明书进行。超声心动图检查:采用美国GE公司ViViD7型,M3S经胸探头,探头频率3.5 MHz彩色多普勒超声诊断仪,于标准胸骨旁长轴切面测量左室舒张末期内径、LVEF值;脉冲多普勒在心脏4腔切面测左房室瓣血流频谱E/A比值。
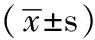
2 结果
2.1 两组临床资料及相关指标比较 CHF组TC及LDL-C较对照组低,且差异有统计学意义(P<0.05);CHF组脂联素、BNP及TNF-α均较对照组高,且差异有统计学意义(P<0.01);其余指标两组间差异均无统计学意义(P>0.05,见表2)。
2.2 不同NYHA分级的各观察指标比较 CHF组Ⅱ、Ⅲ及Ⅳ级患者间的脂联素、BNP、TNF-α水平比较,差异均有统计学意义(P<0.01)。其中Ⅲ级与Ⅱ级比较、Ⅳ级与Ⅲ级比较,血清脂联素、BNP、TNF-α水平均升高,且差异有统计学意义(P<0.05);而Ⅲ级与Ⅱ级比较、Ⅳ级与Ⅲ级比较,LVEF水平均降低,且差异有统计学意义(P<0.05,见表3)。
2.3 CHF组患者血清脂联素与BNP、TNF-α的关系 Pearson偏相关分析显示,经对数转换的血清脂联素与血浆BNP(r=0.682)、TNF-α(r=0.533)呈线性正相关关系(P<0.05)。
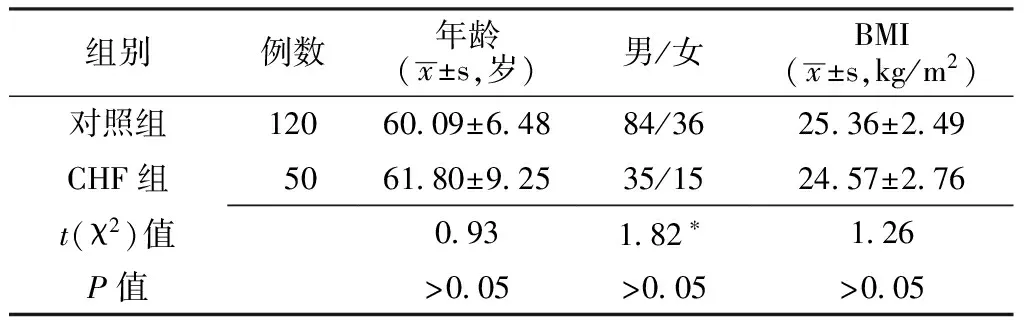
表1 两组一般资料比较Table 1 Comparison of general data between the two groups
注:*为χ2值;BMI=体质指数
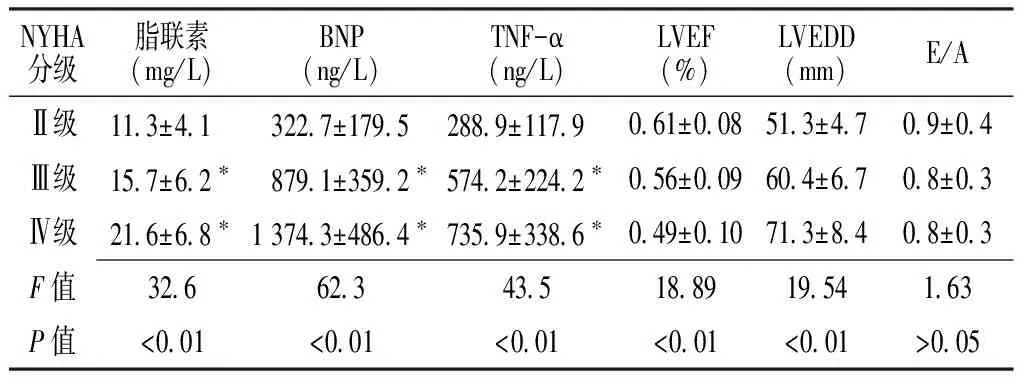
表3 不同NYHA分级患者各观察指标比较Table 3 Comparison of the observed indexes in NYHA classification
注:LVEF=左心室射血分数,LVEDD=左心室舒张末期内经,E/A=舒张晚期左房室瓣血流速度比值;与上一级比较,*P<0.05
表2 两组临床资料及相关指标比较Table 2 Comparison of clinical data and index between the two groups
注:TC=总胆固醇,TG=三酰甘油,LDL=低密度脂蛋白,HDL=高密度脂蛋白,BNP=B型脑钠肽,TNF-α=肿瘤坏死因子-α
3 讨论
近期研究表明,脂肪细胞是一个积极的内分泌细胞,是释放游离脂肪酸,产生许多脂肪因子,包括TNF-α、白介素、纤溶酶原激活抑制物1、瘦素、抵抗素、内脂素和脂联素[4]。脂联素是一个30 kD的蛋白质,含有N末端和C端的球状域,与补体Ck大单位具有同源性[5-6]。脂联素是脂肪组织分泌的具有调节能量代谢作用且与心血管疾病密切相关的细胞因子。有研究发现,血清脂联素水平在CHF患者中是增高的,可作为预测死亡率的指标[7-8]。在心脏恶病质、缺血性和非缺血性CHF中脂联素水平明显升高,考虑与慢性消耗及总体质量下降相关。最近的研究提示,相比于野生鼠,敲除脂联素的鼠模型有严重的心脏纤维化和左室功能异常[9]。Ouchi等[10]研究表明,重组脂联素能阻断蛋白激酶(AMPK)途径导致心肌肥大的信号传导,从而阻止心功能的恶化。Liao等[9]研究证实,压力负荷过重小鼠中,脂联素缺乏将促进其心室重构,补充外源性脂联素能逆转小鼠左室肥厚和心腔扩大,提示脂联素与心室重构关系密切。近期的一项肥厚型心肌病导致的LVEF正常的CHF研究中发现,脂联素在LVEF正常的CHF患者明显升高,脂联素受体1在LVEF正常的CHF患者心肌局部表达明显增高,提示脂联素对诊断CHF具有重要价值[11]。本研究显示,与对照组相比,LVEF正常的CHF患者,血清脂联素水平显著升高,提示脂联素水平是CHF严重程度的独立危险指标。
BNP是一种由32个氨基酸残基组成的神经激素,在血容量增加和压力超载的刺激下,主要由心室肌细胞分泌,具有较强的利尿利钠、舒张血管和降低血压等作用。近年来研究发现脑利钠肽水平在CHF患者血浆中显著升高,且增高水平同CHF严重程度及预后密切相关[12],在欧洲心脏协会2001年CHF诊断指南中已将其作为CHF标志物用于CHF的诊断、预后评估及疗效监测,血浆BNP随着NYHA分级增高,其水平明显增高。LVEF正常的CHF是一种具有CHF的症状和体征,LVEF正常、心室壁增厚而舒张功能异常为特征的临床综合征。由于LVEF正常的CHF常发生于收缩期CHF之前,对其早期检测、早期干预可改善预后。但长期以来,其诊断主要依赖临床表现、心脏超声等容易漏诊,较收缩期CHF诊断更为困难,近年来认为BNP对诊断舒张期CHF具有一定的价值[13]。本研究显示,与正常对照组比较,LVEF正常的CHF患者血浆BNP水平显著升高,提示BNP在诊断LVEF正常的CHF具有很高的价值。因BNP具有脂肪动员作用,能间接刺激脂联素水平升高。本研究显示,CHF患者脂联素与BNP呈正相关。
TNF-α是一种主要由单核-巨噬细胞分泌的具有多种生物学效应的细胞因子,能降低心肌收缩力,增加氧自由基的释放,促进心肌细胞凋亡。1990年Levine等[14]首先发现CHF伴心源性恶病质的患者血清TNF水平明显增高,此后众多学者先后证实了CHF患者血清TNF-α水平升高,且发现血清TNF-α水平与CHF的严重程度直接相关。在CHF中TNF-α可通过以下途径发挥作用[15-16]:(1)增加细胞内一氧化氮合成酶mRNA的表达使心肌内的一氧化氮的合成增加,造成心肌组织损伤,抑制心肌细胞的收缩力;(2)促进左室重构,心肌纤维化及心室扩张;(3)影响心肌细胞对钙的敏感性。本研究结果显示,各NYHA分级间存在差异性,血浆脂联素、BNP、TNF-α水平Ⅲ级比Ⅱ级高、Ⅳ级比Ⅲ级高,而LVEFⅢ级比Ⅱ级低、Ⅳ级比Ⅲ级低,血清脂联素与TNF-α、BNP呈正相关,从而说明脂联素升高的原因之一可能在于激活的神经内分泌因子进一步刺激脂肪组织,促进其分泌脂联素。因此,血清脂联素增高是CHF预后不佳的标志,血清脂联素可能参与了心肌细胞凋亡和心脏重构[17-18]。
本研究结果显示,各NYHA分级间,高级别比低级别血浆脂联素、BNP、TNF-α水平高,而LVEF高级别比低级别低。CHF患者血清脂联素水平越高BNP和TNF-α水平越高,这些变化都对判断心功能有很高的价值,如重组脂联素、TNF-α抑制剂、合成BNP可能是治疗CHF的新思路。
1 Biolo A,Shibata R,Ouchi N,et al.Determinants of adiponectin levels in patients with chronic systolic heart failure[J].Am J cardiol,2010,105(8):1147-1152.
2 Kuster GM,Tanner H,Printzen G,et al.B-type natriuretic peptide for diagnosis and treatment of congestive heart failure[J].Swiss Med Wkly,2002,132(43-44):623-628.
3 Yndestad A,Kristian D,Oie E,et al.Systemic inflammation in heart failure the whys and wherefores[J].Heart Fail Rev,2006,11(1):832-921.
4 Berg AH.Scherer PE:Adipose tissue,inflammation,and cardiovascular disease[J].Circ Res,2005,96(9):939-949.
5 Scherer PE,Williams S,Fogliano M,et al.A novel serum protein similar to C1q,produced exclusively in adipocytes[J].J Biol Chem,1995,270(45):26746-26749.
6 Tsao TS,Tomas E,Murrey HE,et al.Role of disulfide bonds in Acrp30/adiponectin structure and signaling specificity.Different oligomers activate different signal transduction pathways[J].J Biol Chem,2003,278(50):50810-50817.
7 GeorgeJ,Patal S,Wexler D,et al.Circulating adiponectin concentrations in Patients with congestive heart failure[J].Heart,2006,92(10):1420-1424.
8 Laoutaris ID,Vasiliadis IK,Dritsas A,et al.High plasma adiponectin is related to low functional capacity in patients with chronic heart failure[J].Int J Cardiol,2010,144(2):230-231.
9 Liao Y,Takashima S,Maeda N,et al.Exacerbation of heart failure in adiponectin deficient mice due to impaired regulation of AMPK and glucose etabolism[J].Cardiovasc Res,2005,67(4):705-713.
10 Ouchi N,Kobayashi H,Kihara S,et al.Adiponectin stimulates angiogenesis by promoting cross-talk between AMP-activated protein kinase and Akt signaling in endothelial cells[J].J Biol Chem,2004,279(2):1304-1309.
11 Unno K,Shibata R,Izawa H,et al.Adiponectin acts as a positive indicator of left ventricular diastolic dysfunction in patients with hypertrophic cardiomyopathy[J].Heart,2010,96(5):331-332.
12 Bozkurt B,Mann DL.Use of biomarkers in the management of heart failure.Are we there yet?[J].Circulation,2003,107(9):1231-1233.
13 Lubien EB,DeMaria A,Krishnaswamy P,et al.Utility of B-type natriuretic peptide in detecting diastolic dysfunction:comparison with Doppler velocity recordings[J].Circulation,2002,105(5):595-601.
14 Levine B,Kalman J,Mayer L,et al.Elevated circulating levels of tumor necrosis factor in severe chronic heart failure[J].N Engl J Med,1990,323(4):236-241.
15 Bradham WS,Bozkurt B,Gunasinghe H,et al.Tumor necrosis factor-alpha and myocardial remodeling in progression of heart failure:a current perspective[J].Cardiovasc Res,2002,53(4):822-830.
16 Kumar A,Paladugu B,Mensing J,et al.Nitric oxide-dependent and independent mechanisms are involved in TNF-α-induced depression of cardiac myocyte contractility[J].Am J Physiol,2007,292(5):1900-1906.
17 Kitaoka H,Kubo T,Okawa M,et al.Plasma adiponectin levels and left ventricular remodeling in hypertrophic cardiomyopathy[J].Int Heart J,2010,51(1):51-55.
18 Shinmura K.Is adiponectin a bystander or a mediator in heart failure? The tangled thread of a good-natured adipokine in aging and cardiovascular disease[J].Heart Fail Rev,2010,15(5):457-466.
