钙通道基因CACNA1C基因多态性与脑卒中关系的研究
2013-04-19晏峰孙倩陈婧林燕杜兵王晓欧倪莉胡云良
晏峰 孙倩 陈婧 林燕 杜兵 王晓欧 倪莉 胡云良
●论著
钙通道基因CACNA1C基因多态性与脑卒中关系的研究
晏峰 孙倩 陈婧 林燕 杜兵 王晓欧 倪莉 胡云良
目的 探讨钙通道基因CACNA1C基因多态性与脑卒中的关系。方法检测CACNA1C基因5个SNP位点rs10848683、rs2299661、rs1051375、rs216008、rs215976的基因型和等位基因频率。结果脑梗死组与高血压组CACNA1C rs2299661基因型CC频率高于脑出血组和对照组(均P<0.05),脑梗死组与高血压组比较,差异无统计学意义(P>0.05);脑梗死组C等位基因频率高于脑出血组、高血压组及对照组(均P<0.05);脑出血组、高血压组及对照组间C等位基因频率两两比较,差异均无统计学意义(均P>0.05)。rs216008、rs1051375、rs10848683、rs215976各SNP位点基因型频率及等位基因频率差异均无统计学意义(均P>0.05)。结论CACNA1C的rs2299661 C/G多态性与中国人高血压缺血性脑卒中的发生呈显著相关,C等位基因可能为高血压缺血性脑卒中的易感位点。
CACNA1C基因 脑卒中 脑出血 脑梗死 多态性

【 Abstract】 ObjectiveTo investigate the relationship between CACNA1C polymorphism and stroke.MethodsTotal 795 hypertensive patients with stroke were enrolled in the study,including 377 cases of hemorrhagic stroke and 418 cases of ischemic stroke;413 cases of hypertension and 355 healthy subjects were also enrolled as controls.The mass spectrometry technology and direct CACNA1C gene sequencing technology were applied to test five SNP sites rs10848683,rs2299661,rs1051375, rs216008,rs215976,and the genotype and allele frequency were analyzed.ResultsThe frequencies of CACNA1C rs2299661 CC genotype in cerebral infarction and hypertension patients were higher than those in cerebral hemorrhage patients and normal controls(both P<0.05),there was no significant difference between cerebral infarction and hypertension patients(P>0.05).The frequency of C allele in cerebral infarction patients was higher than that in cerebral hemorrhage,hypertension and control groups (all P<0.05);there was no significant difference among cerebral hemorrhage,hypertension and control groups(all P>0.05).There were no significant differences in genotype frequencies and allele frequency of rs216008,rs1051375,rs10848683,rs215976 SNP locus among all groups(all P>0.05).ConclusionThe CACNA1C rs2299661 C/G polymorphisms is correlated with ischemic stroke in hypertensive patients,which indicates that C allele may be a susceptibility loci for hypertensive ischemic stroke.
脑卒中是一组以脑组织局部缺血和(或)出血引起脑组织损伤为主要临床表现的疾病。有资料显示我国脑卒中的发病率及病死率均高于世界平均水平[1]。据报道,我国原发性高血压人群脑卒中的发生率较正常人群高5~30倍[2],且高血压病为脑卒中首要且独立的危险因素[3],提示两者可能拥有共同的遗传易感基因。其中L型钙通道及其相关的多种病理生理现象与高血压产生有密切联系[4],目前的研究认为钙通道α1C亚基是形成L型钙通道的中心孔蛋白[5],L型钙通道亚基基因CACNA1C的突变易导致钙通道主要功能丧失[6],这种功能丧失可能导致高血压的发生[4]。基于整个CACNA1C基因序列测序的基础上,我们选取可能有功能学意义的5个位点。这5个SNP来自于dbSNP库,除去rs2299661位于内含子以外,其余均位于外显子。本研究在此基础上拟探讨钙通道基因CACNA1C与高血压性脑卒中的发病是否具有相关性。
1 资料和方法
1.1 一般资料 收集2010-03—2011-08就诊的高血压性脑卒中患者795例(其中温州医学院附属第二医院494例,温州医学院附属第一医院187例,鹿城区人民医院114例)。男494例,女301例,年龄28~92(63.86± 11.21)岁。其中高血压合并出血性脑卒中(脑出血组)377例,男243例,女134例,年龄28~92(61.43±11.33)岁;高血压合并缺血性脑卒中(脑梗死组)418例,男250例,女168例,年龄34~90(65.82±11.40)岁。脑出血组、脑梗死组的选取分别符合2007年《中国脑血管病防治指南》诊断标准和《中国急性缺血性脑卒中诊治指南2010》诊断标准。排除瓣膜性心脏病,心房颤动,血液病,肿瘤、脑血管药物、脑血管畸形或动脉瘤等引起的继发性脑卒中。在上述3家医院同一时段另收集高血压病患者(高血压组)413例(温州医学院附属第二医院255例,温州医学院附属第一医院95例,鹿城区人民医院63例),男274例,女139例,年龄36~88(62.52±9.42)岁。高血压组符合2004年《中国高血压防治指南》高血压诊断标准(未治疗前非同日3次测量,收缩压≥140mmHg和(或)舒张压≥90mmHg者,或者血压<140/90mmHg,但正在服用降压药者)。(3)收集上述3家医院同一时段健康体检者355例作为对照组(温州医学院附属第二医院223例,温州医学院附属第一医院76例,鹿城区人民医院56例),男219例,女136例,年龄46~88(61.78± 9.88)岁。纳入标准:收缩压<140mmHg,舒张压<90mmHg,排除有心脑血管病或心脑血管病史者,有脑卒中家族史者。所有病例通过询问病史、临床生化相关指标,排除继发性脑卒中、排除严重肝肾功功能不全和肿瘤疾病。同时问卷调查年龄、性别、吸烟史、饮酒史、测量身高、体重,并计算体重指数等临床资料。
1.2 方法
1.2.1 临床指标的测量 采集研究对象空腹外周血5ml,其中2ml EDTA抗凝,于-70℃冰箱冷冻保存,准备抽提DNA。另留取静脉血用于血脂[总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)]、脂蛋白(a)[LP(a)]、同型半胱氨酸(Hcy)、空腹血糖(FBG)等项目测定,研究用横断面病例-对照相关分析。
1.2.2 试验方法步骤 (1)DNA的制备。采用细胞裂解和血红素/蛋白沉淀技术,结合DNA制备膜选择性地吸附DNA的方法提取基因组DNA(AXYGEN公司)。(2)引物合成。全部引物(5对PCR扩增引物及5条延伸引物)均由由SEQUENOM公司的软件Assay Design Design 3.1设计,北京擎科公司合成,见表1。(3)PCR扩增及SNP分型。利用多重PCR对目的序列进行扩增,通过多重PCR技术实现对所选的SNP位点的基因序列进行扩增。将上述扩增产物中加入ddNTP,并通过延伸引物(约20 bp)只能延伸一个碱基来实现SNP位点的扩增。延伸完毕后,通过基质辅助激光解吸电离飞行时间质谱(MALDI-TOFMS)基因分型技术,进行SNP分型。

表1 5个SNP位点的PCR引物及延伸引物
1.3 统计学处理 采用SPSS 16.0统计软件。各组基因型Hardy-Weinberg平衡吻合度采用χ2检验,各组基因型和等位基因频率比较用χ2检验或Fisher确切概率法,计量资料用s表示,组间比较采用方差分析。
2 结果
2.1 群体代表性检验 脑梗死组、脑出血组、高血压组和对照组CACNA1C 5个SNP位点基因型分布,差异有统计学意义(P>0.05),符合Hardy-Weinberg平衡,表明此4组研究对象具有群体代表性。
2.2 CACNA1C基因多态性质谱分析 见图1-5(峰表示多态性位点,单峰表示纯合子,双峰表示杂合子)。
2.3 脑梗死组和脑出血组CACNA1C基因5个SNP位点基因型及等位基因分布频率比较 见表2、3。
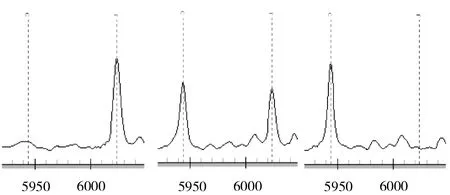
图1 rs216008经分型后得到3种基因型,依次为T/T、C/T和C/C型
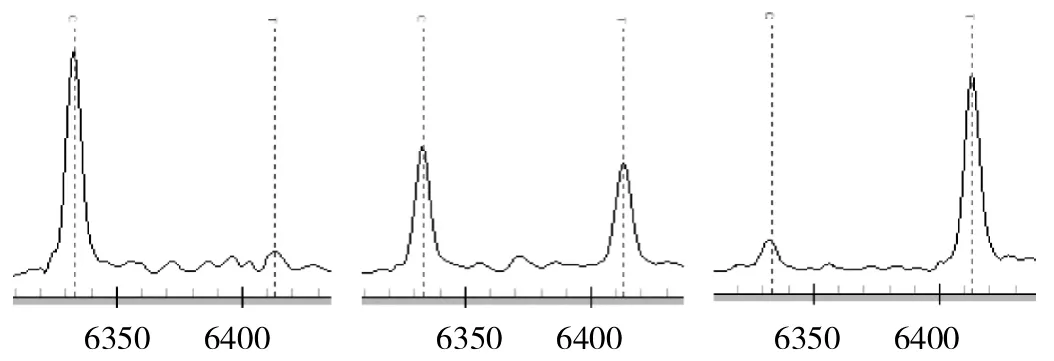
图2 rs215976经分型后得到3种基因型,依次为C/C、C/T及T/T型

图3 rs1051375分型得到3种基因型,依次为A/A型、G/A型及G/G型

图4 rs2299661经分型后得到3种基因型,依次为C/C、C/G及G/G型
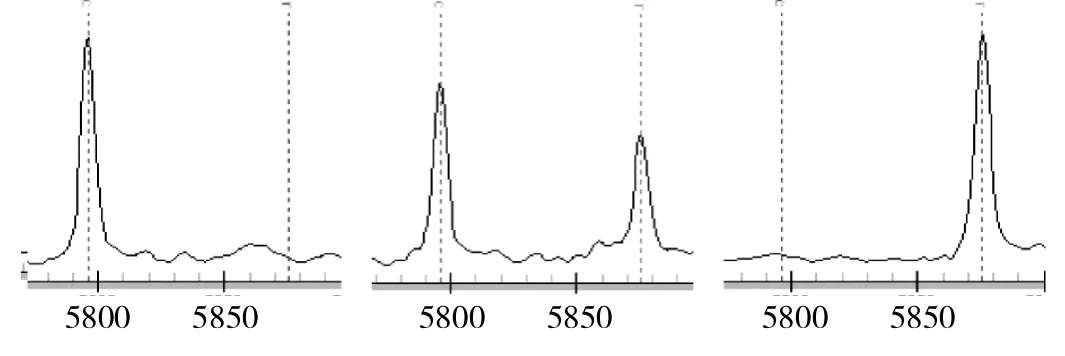
图5 rs1084683经分型后得到3种基因型,依次为C/C、C/T及T/T型
由表2、3可见,脑梗死组、高血压组CACNA1C rs2299661基因型CC频率高于脑出血组和对照组(均P<0.05),脑梗死组与高血压组比较,差异无统计学意义(P>0.05);脑梗死组C等位基因频率高于脑出血组、高血压组及对照组(均P<0.05);脑出血组、高血压组及对照组间C等位基因频率两两比较,差异无统计学差异(均P>0.05)。rs216008、rs1051375、rs10848683、rs215976各SNP位点基因型频率及等位基因频率差异均无统计学意义(均P>0.05)。

表2 脑卒中各组、高血压组和对照组CACNA1C各位点基因型分布频率的比较[例(%)]
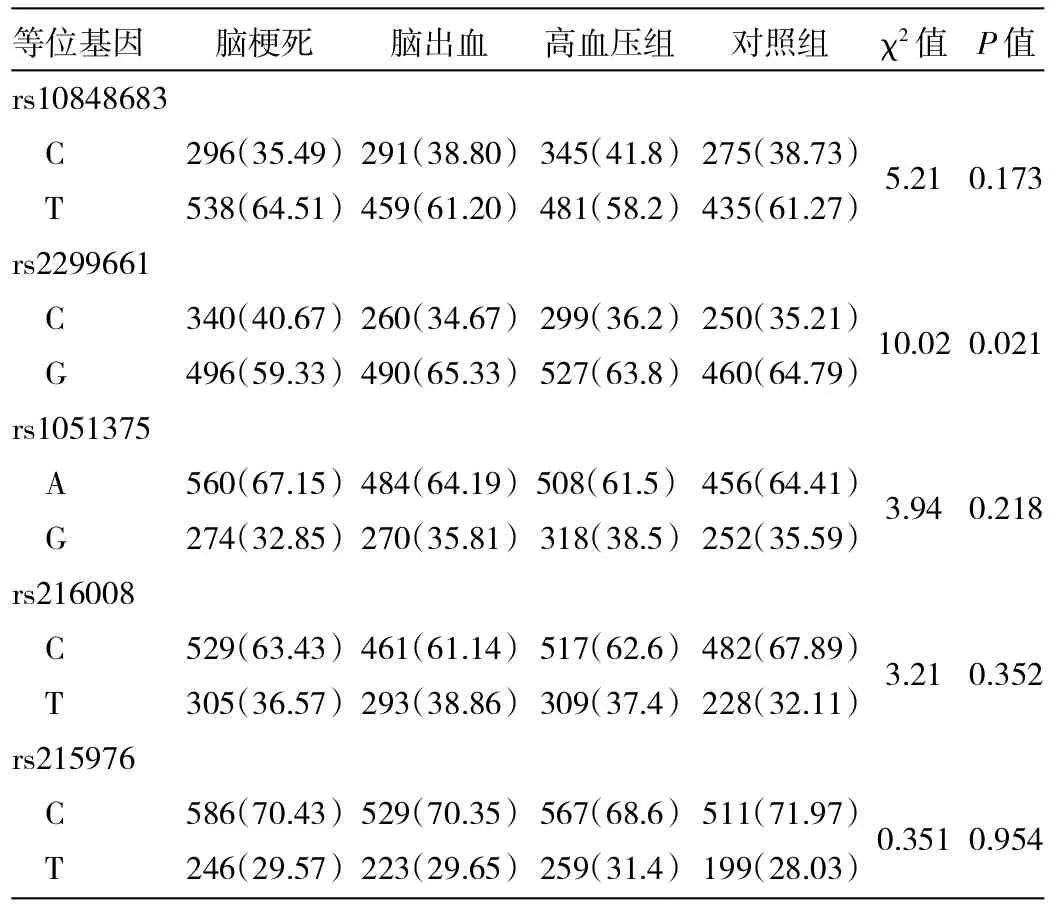
表3 脑卒中各组、高血压组和对照组CACNA1C基因各SNP位点等位基因频率比较[例(%)]
2.4 4组rs2299661 SNP与生化指标间的关系分析 见表4。

表4 四组不同rs2299661C/G不同基因型携带者生化指标比较
由表4可见,经方差分析显示rs2299661不同基因型之间的FBG、TC、TG、HDL-C和LDL-C差异均无统计学意义(均P>0.05),而LP(a)和Hcy水平差异均有统计学意义(均P<0.05)。两两比较显示CC型和CG型的LP(a)和Hcy明显高于GG型者(均P<0.01),但CC与CG型之间差异无统计学意义(P>0.05)。
2.5 脑梗死组患者rs2299661C/G不同基因型携带者生化指标比较 见表5。

表5 脑梗死组患者rs2299661C/G不同基因型携带者生化指标比较
由表5可见,对脑梗死组患者的rs2299661等位基因携带者(CC+CG基因型)与非携带者(GG纯合子)的生化参数进行比较,结果也显示LP(a)和Hcy水平两组有明显差异,C等位基因携带者的LP(a)和Hcy水平明显高于非携带者(P<0.05),而FBG、TC、TG、HDL-C和LDL-C两组之间差异无统计学意义(均P>0.05)。
3 讨论
脑卒中是遗传易感性和环境因素共同决定的多基因遗传性疾病,因此提倡寻找及并予积极干预脑卒中相关危险因素。已往对脑卒中遗传致病基因主要集中在ACE基因、AGT基因、ApoE基因等的研究[2,7],多数研究表明这些基因与脑卒中均存在相关性,但对这些基因在脑卒中的发病机制还不明,需更进一步的科学研究。目前已知的脑卒中危险因素中高血压病为脑卒中首要且独立的危险因素,且收缩压每增加10mmHg,脑卒中发病相对危险增加49%;舒张压每增加5mmHg,脑卒中危险增加46%[3]。提示两者可能拥有共同的遗传易感基因,故近年来有关脑卒中候选基因研究较多集中于与血压调节和高血压有关的基因。
电压依赖性钙通道L-VDCC[Ca(V)1]为钙通道电压依赖性钙通道的一种类型,为调控钙离子内流的离子通道,是目前已知选择性最强的离子通道[8]。研究认为L型钙通道及其相关的多种病理生理现象与高血压产生有密切联系[4],而研究证实L型钙通道α1C亚单位是调节Ca2+进入细胞内的主要通道,因此对人类编码LTCCα1C亚基的基因CACNA1C研究[9],对高血压及脑卒中的防治有着重要的理论和临床意义。
目前临床应用最广泛的降压药——钙通道阻滞剂(CCB),其靶位点是位于细胞膜上的钙通道α1C亚基[5]。但每一种特定的CCB都可能引起个体间降压疗效的差异,这可能是由于基因变异及各种非遗传性因素等造成的不同患者的分子病理遗传学机制不同[5-6],因此推测α1C亚基基因(CACNA1C)的多态性可能会对CCB的疗效产生影响。基于国外的研究,我们从dbSNP库中选取了CACNA1C的5个 SNP(rs216008、rs1051375、rs2299661、rs10848683、rs215976),包括CACNA1C内含子的61765C/G(rs2299661)、外显子的 558674 C/T(rs216008)外显子的628667 C/G(rs10848683)、外显子的626417A/G(rs1051375)、外显子的532175C/T(rs215976)。从结果显示发现脑梗死组与高血压组CACNA1C rs2299661基因型CC频率高于脑出血组和对照组(P<0.05),脑梗死组与高血压组rs2299661基因型CC频率分布差异无统计学意义(P>0.05),但等位基因频率检测呈现脑梗死组大于高血压组现象,提示:(1)CACNA1C的rs2299661C/G多态性与中国人群缺血性脑卒中的发生有关联;(2)脑梗死组与高血压组两者间可能存在着共同的遗传易感基因。推测这种作用机制作为内含子的rs2299661在脑梗死组中C/G可能产生基因变异,对钙通道蛋白mRNA剪接产生影响:①出现原有的剪接位点消失,新的剪接位点生成;②编码钙通道氨基酸序列改变,这种改变可能引起钙通道蛋白相关元件的变化,引发钙通道通透性变化;③钙离子内流增加,肌细胞表面的动作电位改变,引起肌细胞的兴奋收缩耦联加强,外周血管阻力增加,出现脑血管的持续痉挛。另发现rs216008、rs1051375、rs10848683、rs215976 SNP位点脑梗死组、高血压组与对照组组间的比较,未见统计学差异(P>0.05),说明所选其它CACNA1C SNP位点与脑梗死间并无关联性。
已有研究证实LP(a)是一种LDL样脂蛋白,但由于尚含一高度糖基化和异质性的载脂蛋白apo(a),使其有别于LDL-C。体外研究表明,LP(a)致病作用明显强于LDL-C,可损伤内皮功能[10],刺激平滑肌增殖[11]。而平滑肌增殖为导致心脑血管疾病的病理基础。Hcy是一含硫氨基酸,其水平升高与动脉粥样硬化和血栓形成有关,而血栓形成为脑卒中的表现。本研究通过对4组rs2299661各基因型之间的生化指标进行比较发现,C等位基因携带者(CG和CC型)的LP(a)和Hcy水平明显高于非携带者(GG纯合子)(P<0.01);再进一步通过对脑卒中患者不同基因型的生化指标进行分析,同样显示C等位基因携带者的血LP(a)和Hcy水平明显高于GG型者,提示CACNA1C rs2299661 C/G多态性可能参与LP(a)与Hcy高水平的表达。
脑卒中是多基因、多因素疾病,是遗传和环境因素互相作用所致。全基因组关联分析的实现,使得筛选出与脑卒中疾病相关的单核苷酸多态性(SNPs)成为可能,准确、高通量的SNP分型技术建立的发展,将为复杂疾病易感基因的研究,找出其发病机制获得可能[12]。
[1] Powles J,Day N.Interpreting the global burden of disease[J].Lancet,2002,360(9343):l342-1343.
[2] Szolnoki Z,Somogyvari F,Kondacs A,et al.Evaluation of the interactions of common genetic mutations in stroke subtypes[J].J Neurol,2002,249(10):1391-1397.
[3] 中国高血压防治指南修订委员会.中国高血压防治指南(2005年修订版)[J].高血压杂志,2005,13Suppl:5-41.
[4] Soon J L,Ping L,Chua Y L,et al.Absence of calcium channel alpha1C-subunitmutation in human artial fibrillation[J].Asian Cardiovascar Thorac Ann,2010,18(4):349-353.
[5] Abernethy D R,Schwartz J B.Cacium-antagonist drugs[J].N Engl J Med,1999,341(19):1447-1457.
[6] Antzelvitch C,Pollevick G D,Cordeiro J M,et al.loss-of-function mutations in the cardiac calcium channel underlie a new clinical entity characterized by segment elevation,short QT intervals,and sudden cardiac death[J].Circulation 2009,115:442-449.
[7] Rubattu S,Giliberti R,Russo R,et al.Analysis of the genetic basis of the endothelium-dependent impaired vasorelaxation in the stroke prone spontaneously hypertensive rat:a candidate gene approach[J].J Hypertension,2000,18(2):161-165.
[8] Welling A,Kwan Y W,Bosse E,et al.Subunit-Dependent Modula tion of Recombinant L-Type Calcium Channels Molecular Basis for Dihydropyridine Tissue Selectivity[J].Circulation research,ISSN:0009-7330,1993,73(5):974-980.
[9] Wang F,McIntosh A M,He Y,et al.The association of genetic variation in CACNA1C with structure and function of a front temporal system[J].Bipolar Disord.2011,13(7-8):696-700.
[10] Tsurumi Y,Nagashima H,Ichikawa K,et al.Influence of plasma lipoprotein(a)levels on coronary Asomoto response to acetylcholine[J].Am Coll Cardiol,1995,26:1242-50.
[11] Arab L,Liu W,Elashoff D.Green and Black Tea Consumption and risk of Stroke.A Meta Analysis[J].Stroke,2009,40(5):1786-1792.
[12] Botstein D,Risch N.Discovering genotypes underlying human phenotypes:past successes for mendelian disease,future approaches for complex disease[J].Nat Genet,2009,33:228-237.
Relationship between CACNA1C gene polymorphism and stroke
CACNA1Cgene Stroke Cerebral hemorrhage Ischemic stroke Polymorphism
2012-07-16)
(本文编辑:杨丽)
浙江省自然科学基金资助项目(LY12H09003)
323000 温州医学院附属第六医院(丽水市人民医院)检验科(晏峰);温州医学院附属第二医院(孙倩、陈婧、林燕、杜兵、王晓欧、倪莉、胡云良)
胡云良,E-mail:huyunliang66@163.com
