8-OH-DPAT对弥漫性脑损伤及合并二次脑损伤大鼠神经元凋亡的影响
2013-04-15宋振全梁国标毛振立李晓明
李 宾,宋振全,梁国标,赵 旭,毛振立,李晓明,吕 伟,雷 伟,蒋 为
我们前期的研究证实8-OH-DPAT在大鼠创伤性脑损伤(traumatic brain injury,TBI)后能够通过降低脑温抑制神经元的凋亡[1]。国外研究报告显示5-HT1A受体激动剂在多种脑损伤模型中具有神经保护作用,能够促进运动、认知功能的恢复及减轻脑组织病理学表现[2-4]。然而,8-OH-DPAT对TBI后神经元凋亡的影响研究还不充分[5-6],并且8-OHDPAT对二次脑损伤的影响未知。我们制作二次脑损伤模型,研究8-OH-DPAT对大鼠弥漫性脑损伤及合并二次脑损伤后的神经元凋亡的影响。
材料与方法
1 实验分组
182只(330±25)g健康雄性Wister大鼠随机分为6组:空白对照组(A组,n=7),假手术组(B组),单纯DBI+NS对照组(C组),单纯DBI+8-OH-DPAT治疗组(D组),DBI合并SBI+NS对照组(E组),DBI合并SBI+8-OH-DPAT治疗组(F组);B、C、D、E、F各组根据伤后取脑时间分为6、12、24、72、168h亚组,各亚组7只,n=35。A组不做任何损伤,B组除了不接受铁棒打击和双侧颈总动脉结扎其余手术操作同E组,DBI模型参照Marmarou方法制作,DBI后稳定15min,结扎大鼠双侧颈总动脉30min,做成缺血性二次脑损伤模型。
2 药物应用及取材
A、B组不使用任何药物;D、F组在DBI 15min后腹腔注射8-OH-DPAT(0.5mg/kg)[2-4],8-OHDPAT(5mg/支)购自美国Sigma公司;C、E组在DBI 15min后腹腔注射等体积的NS;E、F组注射药物或NS后再施加二次损伤。到达时间点后,常规方法取脑、石蜡包埋,备做切片。
3 观察指标
将每只大鼠随机抽取5张切片分别观察以下指标,每张切片任取5个视野在400倍光镜下观察,取其平均值。
3.1 苏木精-伊红(HE)染色观察前额皮层病理表现。
3.2 TUNEL法检测前额皮层细胞凋亡:凋亡检测试剂盒购买自北京中衫金桥公司,求出每张切片各视野的凋亡指数(凋亡指数=凋亡细胞数/细胞总数×100%)。
3.3 免疫组化检测前额皮层神经元Bax、Bcl-2及Caspase-3蛋白的表达:抗体购于美国Santa Cruz公司。应用Image-Pro Plus 6.0软件(Media Cybernetics公司)观察各组切片Caspase-3、Bcl-2、Bax阳性表达的积分光密度(integral optical density,IOD)值并进行比较。
4 统计分析
实验数据以均数±标准差表示,采用SPSS 18.0统计软件进行单因素方差分析,P<0.05为差异有显著性意义。
结 果
1 HE染色可见A、B组无损伤表现;C、D、E、F组有明显的脑组织水肿、神经元变性、细胞数目减少、毛细血管充血、炎细胞浸润,与A、B组比较E组损伤最为明显,D组表现最轻;D组用药后损伤较C组减轻,F组较E组也有减轻(见图1)。

图1 各组72h亚组前额皮层病理表现(HE×400)
2 A、B组凋亡细胞少见,阳性反应为细胞核染色呈明确棕黄色,A组凋亡指数为(1.36±0.14)%,各损伤组于损伤后6h即可见凋亡细胞,逐渐增多,72h时达高峰,第7d仍有较高的表现;D组用药后较C组降低(P<0.05或P<0.01),同样可见F组小于E组(P<0.01)(见表1,图2)。
3 Caspase-3阳性反应为胞浆内棕黄色颗粒,A、B组Caspase-3阳性表达少见;与A、B组比较,各损伤组各时间点阳性表达明显增多(P<0.01),尤其在损伤后72h增多最明显(P<0.01);D组用药后较C组表达减少(P<0.05或P<0.01),同样可见F组表达低于E组(P<0.05或P<0.01)(见表2,图3)。
4 Bax阳性表现为胞浆内黄染颗粒,A、B组Bax阳性表达少见;与A、B组比较,各损伤组各时间点脑损伤后Bax表达明显增多(P<0.01),72h可见高峰,7d后有所降低;D组用药后表达较C组降低(P<0.05或P<0.01),同样可见F组表达低于E组(P<0.05或P<0.01)(见表3,图4)。
5 Bcl-2阳性表现同Bax,A、B组即可见Bcl-2的少量表达;各损伤组6h Bcl-2表达可见增多,24h达高峰,之后逐渐减少;与A、B组比较,各损伤组各时间点Bcl-2阳性表达明显增多(P<0.01);D组用药后较C组促进了Bcl-2的表达(P<0.05或P<0.01),同样F组表达高于E组(P<0.05或P<0.01)(见表4,图5)。

表1 各组不同时间点凋亡指数(%)观察结果

表2 各组不同时点Caspase-3阳性表达情况比较(IOD)

表3 各组不同时点Bax的表达结果统计(IOD)

表4 各组不同时点Bcl-2的表达结果统计(IOD)

图2 各损伤组72h亚组细胞凋亡表现(TUNEL染色 ×400)。镜下见凋亡细胞胞体缩小,核膜皱缩,染色质浓缩,浓集于核膜附近,核内出现棕黄色颗粒,核不规则、固缩块状浓染呈棕黄色

图3 各损伤组72h亚组脑组织Caspase-3的表达(免疫组织化学染色 ×400)。镜下见胞浆有黄染,尤其是核膜周围黄染最为明显,D、F组用药后Caspase-3的表达减少

图4 各损伤组72h亚组前额皮层Bax的表达(免疫组织化学染色 ×400)。可见各损伤组胞浆有黄染,E组表达最为明显,D组表现最轻(只在核膜周围可见)
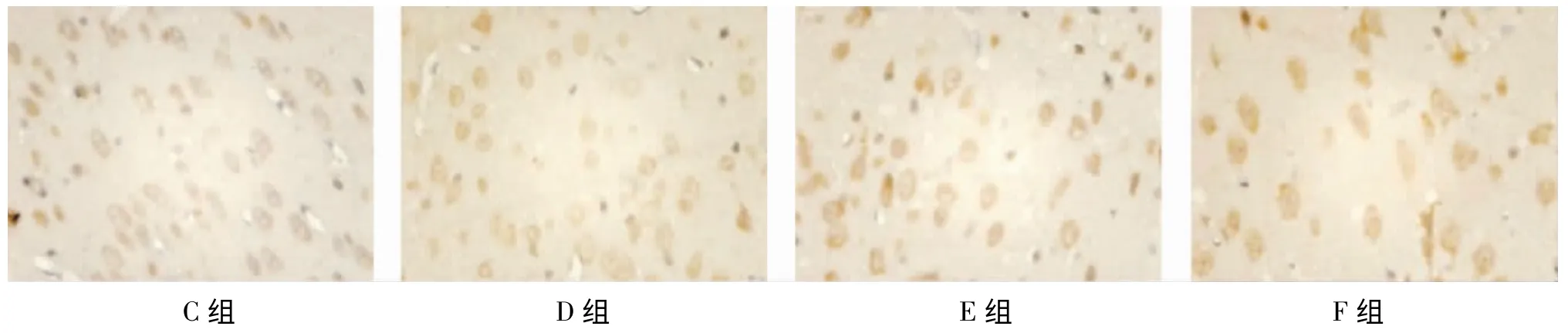
图5 各损伤组24h亚组前额皮层Bcl-2的表达(免疫组织化学染色 ×400)。上图神经元及胞核清晰可见,各组在胞浆内均有Bcl-2蛋白的表达,尤其在核膜周围有大量的聚集
讨 论
DBI是临床常见的TBI类型,主要以非手术综合治疗,尚缺少针对神经元凋亡的有效药物治疗。TBI后除了最初的损伤还有二次的脑损伤[3],最初的损伤是不可逆的,比如损伤区域的细胞坏死,然而低氧、低血压等二次损伤因素会持续几分钟到几小时甚至更久,这为药物发挥作用提供了时机。在临床工作中二次脑损伤很常见,即便是在重症监护室二次损伤因素依然难以避免[4]。通过后期治疗尽可能减弱或阻止二次损伤的发生,可提高患者的功能预后。2001年Kline等[7]第一次报道了5-HT1A受体激动剂在TBI中的神经保护作用,后续的一些实验主要集中于观察大鼠运动和认知功能的恢复[2-4]。研究认为8-OH-DPAT提供的这种神经保护作用与抑制谷氨酸盐释放、抑制细胞外钙离子内流、引起神经元超极化、保护脑组织多巴胺及胆碱能神经系统等有关[2-4,7]。
DBI及SBI模型制作方便,实验设备简单,便于操作,稳定重复性好。HE染色观察可见脑组织水肿,细胞水肿、变性坏死,血管充血,炎细胞浸润,C、E盐水对照组损伤比相应的D、F药物组损伤重,说明8-OH-DPAT具有神经保护作用,和一些研究的结果是相吻合的[1-4]。
Caspase-3在细胞凋亡中具有重要作用,在Caspases家族中处于核心位置,是Caspase家族中最重要的凋亡执行者[8]。活化的Caspase-3能特异性地切割DNA,使参与DNA损伤修复过程的聚ADP核糖聚合酶(PARP)以及DNA依赖的蛋白激酶(DNA-PK)等失活,促使染色质凝聚和核酶激活,导致细胞凋亡[1]。若细胞中检出活化的Caspase-3和(或)细胞TUNEL染色(+)则有细胞凋亡存在[9]。Adayev等[5]研究5-HT1A G蛋白偶联抑制Caspase-3其可能机制见图6。实验显示给予8-OH-DPAT后,细胞凋亡减少,Caspase-3表达降低,表明8-OHDPAT可通过减少Caspase-3表达,抑制DBI后的细胞凋亡同时能够减弱二次损伤。
Bcl-2的过量表达可以抑制凋亡发生,主要通过稳定线粒体膜阻止线粒体释放Caspase、凋亡诱导因子和细胞色素C等作用抑制细胞凋亡[10]。Bax可与Bcl-2形成异源二聚体使凋亡易于发生[11],同时Bax可以促进细胞色素C的释放,从而激活Caspase-3诱导细胞凋亡的发生,因此Bax高表达可能是颅脑损伤后细胞凋亡增加的主要原因。两者对细胞凋亡调控作用相反,认为它们之间可能存在一种平衡共同调节细胞凋亡[1]。Hsiung等[6]研究8-OH-DPAT抑制AC从而阻断Caspase-3的活化途径,其可能机制见图7。实验观察了8-OH-DPAT对大鼠脑损伤后前额皮质Bcl-2及Bax表达的影响,结果发现其可在一定程度上提高Bcl-2的表达,同时抑制Bax的表达,说明8-OH-DPAT可通过调节Bax/Bcl-2的表达抑制细胞凋亡,发挥神经保护作用。

图6 5-HT1A受体激动剂抑制Caspase-3的可能机制

图7 8-OH-DPAT抑制Bax/Bcl-2的可能机制
实验证实了8-OH-DPAT可抑制DBI后的细胞凋亡,同时对SBI有一定的抑制作用,研究8-OHDPAT对细胞凋亡的影响,有助于为临床治疗DBI及防治SBI提供参考依据。8-OH-DPAT通过抑制Caspase-3蛋白表达、降低Bax表达、促进Bcl-2的表达发挥其抗凋亡作用。本实验的用药方式、时间及剂量参照以往的研究,存在一定的局限性,例如用药是在脑损伤15min后,这在临床很难实现,需要更进一步的研究。8-OH-DPAT抑制凋亡的机制是多方面的,还需进一步探索。
[1]Mao ZL,Song ZQ,Li Gi,et al.8-hydroxy-2-(di-npropylamino)tetralin intervenes with neural cell apoptosis following diffuse axonal injury[J].Neural Regeneration Res,2013,8(2):133-142.
[2]Kline AE,Zafonte RD,Cheng JP,et al.A delayed and chronic treatment regimen with the 5-HT1A receptor agonist 8-OH-DPAT after cortical impact injury facilitates motor recovery and acquisition of spatial learning[J].Behavioural Brain Resh,2008,194(1):79-85.
[3]Yelleswarapu NK,Tay JK,Kline AE,et al.Elucidating the role of 5-HT1A and 5-HT7 receptors on 8-OH-DPAT-induced behavioral recovery after experimental traumatic brain injury[J].Neurosci Lett,2012,515(2):153-156.
[4]Henderson KA,Kline AE,Sozda CN,et al.Evaluation of a combined therapeutic regimen of 8-OH-DPAT and environmental enrichment after experimental traumatic brain injury[J].J Neurotrauma,2010,27(11):2021-2032.
[5]Adayev T,Ray I,Sondhi R,et al.The G protein-coupled 5-HT1A receptor causes suppression of caspase-3 through MAPK and protein kinase Calpha[J].Biochem Biophys Acta,2003,1640(1):85-96.
[6]Hsiung SC,Tin A,Tamir H,et al.Inhibition of 5-HT1A receptor-dependent cell survival by cAMP/protein kinase A:role of protein phosphatase 2A and Bax[J].Neurosci Res,2008,86(10):2326-2338.
[7]Kline AE,Yu J,Horvath E,et al.The selective 5-HT(1A)receptor agonist repinotan HCL attenuates histopathology and spatial learning deficits following traumatic brain injury in rats[J].Neuroscience,2001,106(3):547-555.
[8]Thornberry NA,Lazebnik Y.Caspases:enemies within[J].Science,1998,281(5381):1312-1316.
[9]Clark RS,Kochanek PM,Watkins SC,et al.Caspase-3-medeiated neuronal death after traumatic brain injury in rats[J].J Neurochem,2000,74(2):740-753.
[10]Fiskum G.Mitochondrial participation in ischemic and traumatic neuronal cell death[J].Neurotrauma,2000,17(7):843-845.
[11]莫纪华,郑秀珏,杨小锋.大鼠严重脑损伤后细胞凋亡状态及相关基因Bcl-2、Bax的表达[J].中华创伤杂志,2004,20(7):432-433.
