高渗盐水治疗创伤性脑水肿合并颅内高压的疗效分析
2013-04-15颜玉峰姚慧斌季耀东
颜玉峰,姚慧斌,沈 晓,季耀东
应用高渗盐水(hypertonic saline,HS)治疗脑水肿和颅内高压是目前国内外学术界的一个研究热点,国外大量的临床实践已经证实HS可有效治疗创伤性脑水肿合并颅高压[1-2],但目前临床上使用的HS浓度及剂量相差甚远。我们于2011年12月~2012年4月,对16例重度颅脑损伤(TBI)因脑水肿致颅内高压的患者,分别静脉给予等渗透量的3.0%、7.5%HS和20%甘露醇治疗,旨在评价现今临床常用的渗透性脱水剂的疗效,为创伤性脑水肿合并颅内高压的临床治疗提供参考。
临床资料
1 研究对象
本组重度TBI患者16例,男性11例,女性5例;年龄30~52岁,平均43.5岁。格拉斯哥昏迷评分(GCS)平均(6.25±1.65)分。所有病例均行开颅颅内血肿清除及去骨瓣减压术,脑室内放置颅内压探头(Codman&Shurtleff Inc.,美国);16例随机分入2组,第1组分别接受3.0%HS和20%甘露醇治疗,第2组接受7.5%HS和20%甘露醇治疗,两组一般资料比较,差异无统计学意义(P>0.05)。
2 病例入选标准
(1)入院GCS≤8分;(2)创伤后24h内行开颅颅内血肿清除及去骨瓣减压术,脑室内放置颅内压探头;(3)颅内压(ICP)>25mmHg,持续时间>5min;(4)无心、肺、肝、肾等脏器的功能不全;(5)无呼吸困难及生命体征不平稳;(6)除外多发伤及休克患者。此研究均已征得患者及家属同意。
3 方法
本研究应用250ml 20%甘露醇(渗透浓度1 100mOsm/L)、300ml 3.0% HS(渗透浓度1 026mOsm/L)和120ml 7.5% HS(渗透浓度2 400mOsm/L)作为实验药物,以ICP实测值为用药标准,入选患者一旦ICP>25mmHg,持续时间>5min,即接受渗透性脱水治疗;第1组患者随机接受3.0%HS与20%甘露醇治疗各2次,第2组患者随机接受7.5%HS与20%甘露醇治疗各2次,每次间隔6h,治疗药物使用的先后顺序用随机数字表法决定,16例共接受64次脱水治疗,药物均在15min内由深静脉快速滴注。
4 观察指标
连续监测用药后6h内每小时ICP、平均动脉压(MAP)及尿量的变化、用药前及用药后2、4、6h血钠浓度变化。
5 统计学处理
采用SPSS 13.0软件行统计学分析,数据以均数±标准差(±s)表示,采用非参数的Wilcoxon秩和检验,检验3种渗透性脱水剂使用前后各观察指标值是否存在差异。同时检验3.0%HS与7.5%HS使用前后所对应的各观察指标值间的差异是否存在统计学差异,以P<0.05为差异有统计学意义。
结 果
1 ICP
第1组给予静脉快滴3.0%HS和20%甘露醇后,ICP均有显著下降(P<0.05)。3.0%HS平均起效时间为(20.3±7.6)min,平均约30minICP降至最低点,平均降幅(9.2±3.1)mmHg,有效降颅压时间为(4.7±1.1)h;20%甘露醇平均起效时间(19.4±6.8)min,平均约55min ICP降至最低点,降幅为(10.1±3.1)mmHg,有效降颅压时间为(3.7±0.4)h。两者的起效时间和ICP降幅无显著差异(P>0.05),但3.0%HS作用持续时间更长(P<0.05)(图1)。
第2组给予静脉快滴7.5%HS和20%甘露醇后,ICP均亦有显著下降(P<0.05)。7.5%HS平均起效时间为(18.2±6.6)min,平均约30min ICP降至最低点,平均降幅(10.2±2.2)mmHg,有效降颅压时间为(4.0±1.1)h;20%甘露醇平均起效时间(18.9±7.1)min,平均约50minICP降至最低点,降幅为(11.1±4.0)mmHg,有效降颅压时间为(3.6±0.4)h。两者的起效时间和ICP降幅无显著差异(P>0.05),但7.5%HS作用持续时间较20%甘露醇长(P<0.05))(图2)。
3.0%和7.5%HS的起效时间和ICP降幅无显著差异(P>0.05),但3.0%HS降颅压作用持续时间较7.5%甘露醇长(P<0.05))(图3)。
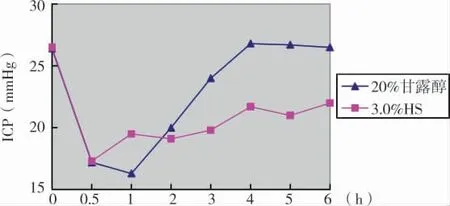
图1 3.0%HS和20%甘露醇治疗前后ICP变化
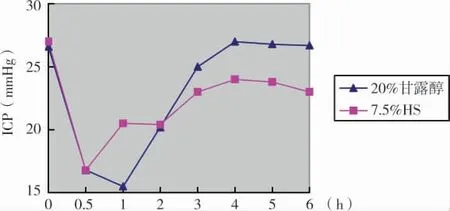
图2 7.5%HS和20%甘露醇治疗前后ICP变化
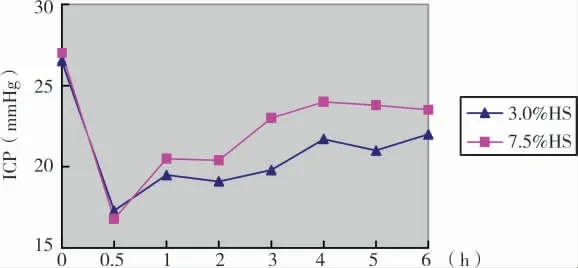
图3 3.0%HS和7.5%HS治疗前后ICP变化
2 MAP
第1组患者接受3%HS治疗后MAP显著升高(P<0.05),约30min达到高峰,升幅为(9.4±2.2)mmHg,有效持续时间为(5.0±1.8)h;20%甘露醇治疗后的MAP与用药前相比无显著差异(P>0.05)(图4)。
第2组患者接受7.5%HS治疗后MAP亦显著升高(P<0.05),约30min达到高峰,升幅为(8.6±2.1)mmHg,有效持续时间仅为(2.7±1.4)h;20%甘露醇治疗后的MAP与用药前相比亦无显著差异(P>0.05)(图5)。
3.0%和7.5%HS治疗前后MAP的升幅无差异(P>0.05),但3.0% HS的作用持续时间较7.5%HS延长(P<0.05)(图6)。
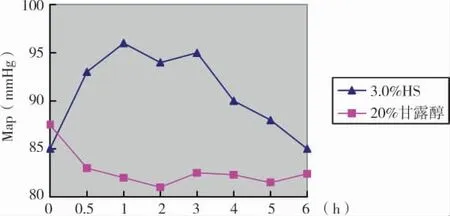
图4 3.0%HS和20%甘露醇治疗前后MAP变化
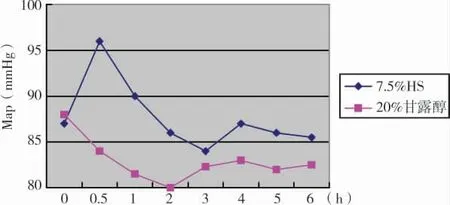
图5 7.5%HS和20%甘露醇治疗前后MAP变化
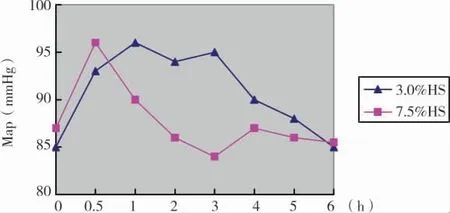
图6 3.0%HS和7.5%HS治疗前后MAP变化
3 血钠浓度
第1组与第2组患者分别接受3.0%和7.5%HS治疗后2、4及6h测量血钠浓度较前相比无差异(P<0.05),两组患者20%甘露醇治疗后血钠均明显下降(P<0.05)(表1)。
4 尿量
20%甘露醇较3.0%和7.5%HS利尿作用明显(P<0.05);3.0%和7.5%HS治疗前后尿量无明显差异(P<0.05)(表2)。
5 并发症
HS治疗中合并低钾血症2例(12.5%),予以静脉补钾后纠正;静脉炎1例(6.25%),予以对症处理后好转。未出现充血性心力衰竭、代谢性酸中毒以及血清钠和渗透压的迅速变化产生抽搐、中枢性桥脑脱髓鞘、颅内压反跳等副作用。
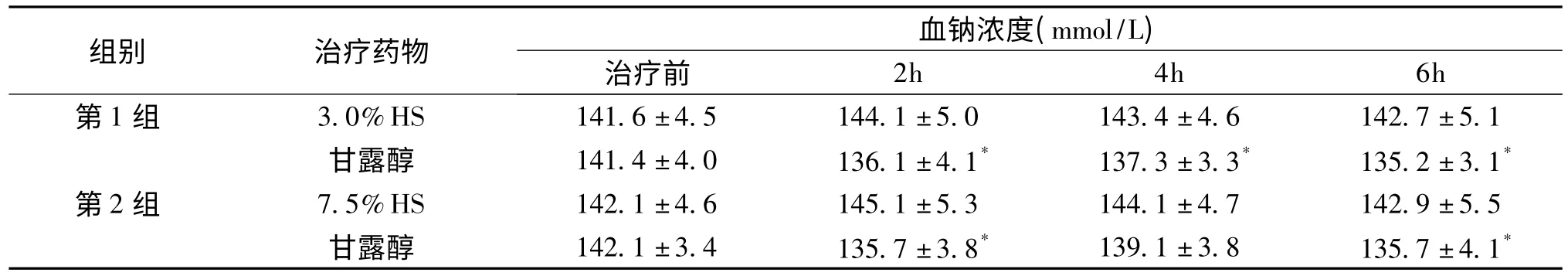
表1 两组治疗前后血钠离子浓度比较
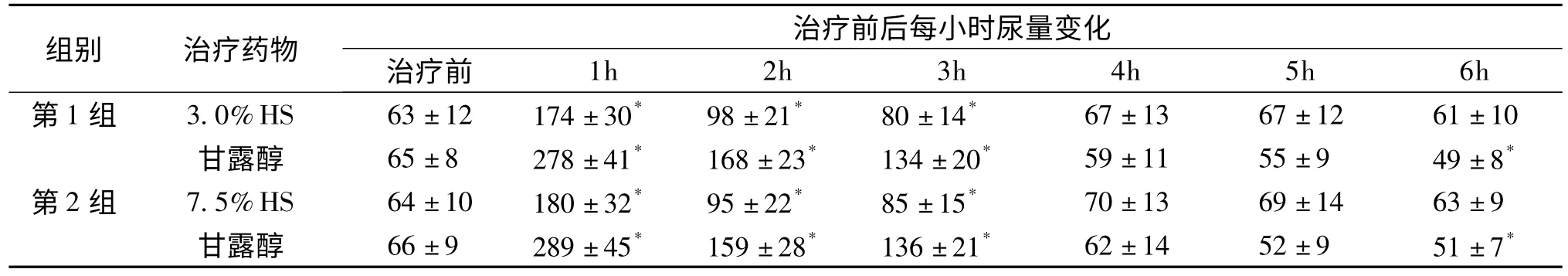
表2 两组治疗前后尿量比较
讨 论
TBI是最常见的严重创伤之一,其中尤以重度TBI的致残率及死亡率高。TBI后继发性脑水肿可引起ICP升高,因此如何有效控制ICP是改善TBI患者预后的关键。甘露醇目前仍然是治疗颅高压的常用药物之一,但随着甘露醇的普遍应用,其致肾损伤、增加心脏后负荷及停药后易出现“反跳现象”等不良反应逐渐被人们认识。因此,临床上亟需寻找一种新的、安全有效的降颅压药物。HS是指浓度高于0.9%的氯化钠溶液,最早于1919年应用于动物实验,此后的动物实验和临床研究均证实HS通过多种机制降低ICP。
1 HS的作用机制
(1)渗透梯度效应:在通常情况下,血-脑脊液屏障对钠和氯离子的通透性很低,HS在血-脑脊液屏障内外建立渗透梯度,促使脑组织内的水分转移到血管内,降低了脑组织的水含量、减少了水在脑组织内的蓄积,从而降低了ICP[3-4];(2)改善脑血流:使用HS后脑血管内皮细胞和红细胞脱水,从而改善血管内皮细胞水肿、降低毛细血管阻力和血液黏度来改善脑组织微循环,增加脑组织灌注和氧供[5-6];(3)免疫调节:TBI诱发脑组织急性炎症反应,表现为炎性细胞聚集、浸润,微循环血管扩张和血管内皮细胞损伤[7],HS可降低中性粒细胞在血管内的黏附、激活,减少氧自由基和细胞因子释放,减轻血管内皮损伤[8-9]。
2 HS浓度的选择
在HS的基础和临床研究中,国内外常用的HS的浓度有3.0%、4.1%、7.5%、10.0%和23.4%,但是什么浓度的HS对于减轻脑水肿,降低ICP疗效最理想目前尚无定论。Qureshi等[10]利用颅内出血犬模型研究比较了23.4%、3.0%HS和甘露醇降低ICP的作用,结果发现23.4%HS降低ICP作用最快,而3.0%HS作用维持时间更长。根据文献报道[11],目前7.5%HS最为常用,因为7.5%的浓度是安全范围内渗透压的上限,浓度过高明显会增加并发症,浓度过低则渗透压不够,影响疗效。本试验中我们选择创伤性脑水肿合并颅高压的患者作为治疗对象,对3.0%、7.5%HS和20%甘露醇的疗效进行临床随机对比分析,研究结果显示,在等渗透量给药的前提下,静脉快速滴注3.0%、7.5%HS和20%甘露醇后,ICP均有明显下降,三者用药前后ICP降幅之间无显著差异,但是HS有效持续时间较甘露醇长,且HS治疗后MAP及CPP明显提高。其中3.0%HS降ICP持续时间较7.5% HS更长,这与Qureshi试验结果一致[10]。
3 并发症
应用HS可能会产生神经系统和全身性副反应。(1)桥脑中央脱髓鞘病变:这可能与低钠血症及低钠血症的快速纠正有关,控制每天的血钠增加不超过10~20mmol/L可以避免其发生[12-14]。在本次研究中未发生桥脑脱髓鞘病变。(2)昏迷和癫痫:这与血浆渗透压和血钠浓度的突然改变有关。(3)电解质紊乱:目前大部分文献显示HS的使用对患者血钠无明显影响,这与本次研究结果一致,但文献报道大剂量使用HS的会导致低钾血症及高氯血症[15],因此,HS治疗过程中必须监测血钾浓度并及时纠正血钾异常。(4)溶血:HS可能会导致红细胞皱缩引起溶血[16]。(5)反跳现象:有报道在用HS治疗颅内高压的过程中可能出现ICP的反跳,特别是在其快速输注后或者停止持续性静脉输注后[15]。反跳现象易发生在血脑屏障广泛损伤的患者,长时间使用HS引起血脑屏障两侧的渗透压梯度消失,当停用HS时会降低血钠水平,导致相反的渗透压梯度,脑组织中的渗透压相对增高,促使水进入脑组织,引起脑水肿加剧。(6)凝血障碍:大量输注HS可损害内皮细胞和血小板的功能,使血小板在内皮下及血管损伤部位的黏附和血小板之间的相互聚集作用减弱[17]。
4 HS治疗的预后
目前已有大量的动物实验和临床研究证明HS应用于TBI能有效降低ICP,改善脑水肿,增加CPP。Cooper等[18]在包含229例严重颅脑损伤(GCS≤8,收缩压<100mmHg)患者的随机、双盲、对照研究中,应用250ml 7.5%HS对实验组患者进行院前复苏治疗,对照组则应用250ml乳酸林格液治疗,两组其他治疗措施无差异,结果发现两组患者中生存并顺利出院的比例差异无显著性(P>0.05),6个月后的生存率及Glasgow预后评分差异无显著性(P>0.05)。当然,目前关于HS对TBI长期预后疗效的研究较少,得出确定的结论尚为时过早,本次研究样本数较小,尚未能完成对患者预后全面随访,有待今后大量随机对照试验积累经验。
综上所述,HS已被证实具有降低ICP,改善脑水肿,增加CPP的效果,但目前临床实验报道所用的HS浓度不等,所用的剂量也不一致,如何针对TBI患者自身基础情况以及TBI的类型、轻重选择合适的HS浓度、剂量和治疗时机,进行个体化治疗,以达到最佳的治疗效果,最大程度减少不良反应是今后临床研究的方向。
[1]Vialet R,Albanese J,Thomachot L,et al.Isovolume hypertonic solutes(sodium chloride or mannitol)in the treatment of refractory posttraumatic intracranial hypertension:2ml/kg 7.5% saline is more effective than 2ml/kg 20%mannitol[J].Crit Care Med,2003,31(6):1683-1687.
[2]Francony G,Fauvage B,Falcon D,et al.Equimolar doses of mannitol and hypertonic saline in the treatment of increased intracranial pressure[J].Crit Care Med,2008,36(3):795-800.
[3]陈世文,周晓平.高渗盐水溶液对脑外伤及合并休克的治疗作用[J].国外医学:神经病学神经外科学分册,2004,31(3):241-244.
[4]Qureshi AI,Suri MF,Ringer AJ,et al.Regional intraparenchymal pressure difference in experimental intracerebral hemorrhage:effect of hypertonic saline[J].Crit Care Med,2002,30(2):435-441.
[5]Roquilly A,Mahe PJ,Latte DD,et al.Continuous controlled-infusion of hypertonic saline solution in traumatic brain-injured patients:a 9-year retrospective study[J].Crit Care,2011,15(5):R260.
[6]Noppens R,Christ M,Brambrink AM,et al.An early bolus of hypertonic saline hydroxyethyl starch improves longterm outcome after global cerebral ischemia[J].Crit Care Med,2006,34(8):2194-2200.
[7]Rockswold GL,Solid CA,Paredes-Andrade E,et al.Hypertonic saline and its effect on intracranial pressure,cerebral perfusion pressure,and brain tissue oxygen[J].Neurosurgery,2009,65(6):1035-1041.
[8]Zallen G,Moore EE,Tamura DY,et al.Hypertonic saline resuscitation abrogates neutrophil priming by mesenteric lymph[J].J Trauma,2000,48(1):45-48.
[9]Rhee P,Burris D,Kaufmann C,et al.Lactated Ringer's solution resuscitation causes neutrophil activation after hemorrhagic shock[J].J Trauma,1998,44(2):313-319.
[10]Qureshi AI,Wilson DA,Traystman RJ.Treatment of elevated intracranial pressure in experimental intracerebral hemorrhage:comparison between mannitol and hypertonic saline[J].Neurosurgery,1999,44(5):1055-1063.
[11]朱志宏,沈洪.高渗盐水溶液抗休克的实验研究和临床应用进展[J].世界急危重病医学杂志,2005,2(5):923-926.
[12]Cottenceau V,Masson F,Mahamid E,et al.Comparison of effects of equiosmolar doses of mannitol and hypertonic saline on cerebral blood flow and metabolism in traumatic brain injury[J].J Neurotrauma,2011,28(10):2003-2012.
[13]Qureshi A,Suarez J,Bhardwaj A,et al.Use of hypertonic(3%)saline/acetate infusion in the treatment of cerebral edema:effect on intracra-nial pressure and lateral displacement of the brain[J].Crit Care Med,1998,26(3):440-446.
[14]Khanna S,Davis D,Fisher B,et al.Prolonged hypernatremia controls elevated intracranial pressure in pediatric head injury patients[J].Crit Care Med,2000,26(3):421-422.
[15]Qureshi A,Suarez J.Use of hypertonic saline solutions in treatment of cerebral edema and intracranial hypertension[J].Crit Care Med,2002,28(9):3301-3313.
[16]Bulger EM,May S,Brasel KJ,et al.Out-of-hospital hypertonic resuscitation following severe traumatic brain injury:a randomized controlled trial[J].JAMA,2010,304(13):1455-1464.
[17]Farahvar A,Gerber LM,Chiu YL,et al.Response to intracranial hypertension treatment as a predictor of death in patients with severe traumatic brain injury[J].J Neurosurg,2011,114(5):1471-1478.
[18]Cooper DJ,Myles PS,McDermott FT,et al.Prehospital hypertonic saline resuscitation of patients with hypotension and severe traumatic brain injury[J].JAMA,2004,291(11):1350-1357.
