Prohibitin启动子中胆固醇活性作用位点研究*
2013-04-13蒋丽娟郭胜杰刘卓炜李永红秦自科周芳坚
董 培, 蒋丽娟, 郭胜杰, 刘卓炜, 李永红, 尧 凯, 秦自科, 韩 辉, 周芳坚△
(1华南肿瘤学国家重点实验室,中山大学肿瘤防治中心泌尿外科, 广东 广州 510060;2 广州医科大学附属第一医院广东省泌尿外科重点实验室,广东 广州 510120)
随着现代分子生物学技术的发展,靶向性基因治疗已成为前列腺癌治疗研究的热点,而寻找高效特异的启动子则是基因治疗研究的关键。我们的前期研究表明,低胆固醇培养的PC-3前列腺癌细胞中抑制素(prohibitin,PHB)表达升高,从而抑制细胞增殖[1-2]。PHB是高度保守的蛋白质,是一类新型的分子伴侣蛋白,广泛存在于卵巢、乳腺、前列腺等上皮细胞的细胞核上,发挥负性转录调控作用[3],其具体的分子机制尚未完全阐明。研究表明,PHB通过正向调节磷脂酰肌醇3-激酶/蛋白激酶B (phosphatidylinositol 3-kinase/protein kinase B,PI3K/Akt)和促分裂素原活化蛋白激酶(mitogen-activated protein kinase,MAPK) 信号通路而在调节细胞代谢、活化和分化方面发挥多向性调控的重要作用[4]。 PI3K/Akt和MAPK通路是调控固醇调节元件结合蛋白(sterol regulatory element binding protein,SREBP)、雄激素受体(androgen receptor,AR)和脂肪酸合成酶(fatty acid synthase,FAS)的主要通路,提示PHB能够调控SREBP信号通路。本实验通过构建PHB启动子重组质粒,转染至前列腺癌PC-3细胞,并通过检测萤光素酶报告基因的表达活性变化,分段切除PHB启动子上约200 bp胆固醇敏感启动元件区域,探讨并评价PHB启动子上的胆固醇活性位点,为进一步将其应用于前列腺癌靶向基因治疗研究打下基础。
材 料 和 方 法
1材料
萤光素酶报告基因载体pGL3-Basic 为Promega产品,前列腺癌细胞系PC-3 细胞为中山大学肿瘤防治中心实验室保存。DNA聚合酶、XhoI 、HindIII和T4 DNA连接酶为New England Biolabs产品,脂质体Lipofectamine 2000 为Invitrogen产品,质粒纯化试剂盒及胶回收试剂盒为Qiagen产品,Luciferase Assay System为Promega产品,其它试剂均为国产或进口分析纯。
2方法
2.1PHB基因启动子引物的设计和合成、PCR扩增及鉴定同前所述[2]。
2.2pGL3重组质粒的构建用XhoI和HindIII内切酶双酶切PCR合成的PHB-Pro、低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)启动子LDLR-Pro 和pGL3-Basic 载体,凝胶电泳后从凝胶中提取纯化DNA,回收的片段用T4 DNA连接酶16 ℃连接过夜, 将连接产物转化E.coliDH5α感受态细胞,在氨芐青霉素抗性平板上筛选重组质粒。用SacⅠ和HindⅢ双酶切鉴定并送公司DNA测序。测序正确的重组质粒命名为pPHB-1192和pLDLR-234。
2.3重组质粒的活性分析分别将pPHB-1192、pLDLR-234及阴性对照质粒pGL3-Basic转染前列腺癌细胞系PC-3,以未转染质粒的细胞为未转染对照组,同步进行实验。转染后继续37 ℃、5% CO2培养箱内孵育8 h后,更换细胞培养液,分成脂蛋白缺乏胎牛血清(lipoprotein-deficient fetal bovine serum,LPDS)组和LPDS+胆固醇(cholesterol,CHO)组。LPDS组中加入10% LPDS+ 50 μmol/L 甲羟戊酸盐(mevalonate) 和50 μmol/L司伐他汀(simvastatin),LPDS+CHO组中再加入10 μmol/L CHO+1 μmol/ L 25-羟基胆固醇(25-hydroxycholesterol),继续放入37 ℃、5% CO2培养箱培养48 h。裂解细胞,加入萤光素酶检测试剂, 化学发光酶标仪 (Promega)上每孔自动加入100 μL Luciferase Assay Reagent 检测萤光素酶活性。
2.4PHB启动子分段引物设计和合成按照PHB启动子中固醇调控元件(sterol regulatory element,SRE)同源位点位置设计合成正向引物:Trun 1: 5’-GCAACTCGAGTGCACTCCAGCCTGGGCAA-3’(-910/+138);Trun 2: 5’-GCAACTCGAGGAGCCAAAGTTTAACGTGCGTT-3’(-858/+138);Trun 3: 5’-GCAA-CTCGAGCTGAGGACGTTTGCAGACAG-3’(-507/+138);Trun 4: 5’-GCAACTCGAGGGCTCTCCTTGCGGCAGTCTTA-3’(-317/+138);Trun 5: 5’-GCAA-CTCGAGGTAGTTCATCTGCTAAGAGCCG-3’(-153/+138);Trun 6: 5’-GCAACTCGAGAGGAGCTCATGCGCAGTATGTG-3’(-35/+138)(下划线核苷酸部分为1个XhoI内切酶 位点, 前面采取4个碱基进行硫代修饰)。 同时采用PHB启动子全长的反向引物作为反向引物,5’-GCAAAAGCTTCCTCACAAGTCGGACTCACGC-3' (下划线核苷酸部分为1个HindIII内切酶 位点, 前面采取4个碱基进行硫代修饰)。
2.5点突变引物设计和合成限制PHB启动子对胆固醇敏感的作用区域位于Trun 5和Trun 6之间,检测发现在这个区域的基因同源于SRE 的核苷酸位置位于 5’-GGTTCTAAGC-3’(-117/-108),见图1。设计点突变引物如下:Muta(-118/-108)L: GCA GAA CCA GGG TGA CTC ATA TGA GCA CCC TTC CCA GAA C;Muta(-118/-108)R: GTT CTG GGA AGG GTG CTC ATA TGA GTC ACC CTG GTT CTG C。采用Quick Change Site-directed Mutagenesis Kit (Stratagene) 试剂盒,dsDNA 50 ng制备成50 μL反应体系,PCR 反应条件如下: 95 ℃ 30 s,然后进行18次循环:95 ℃ 30 s,55 ℃ 1 min,68 ℃ 2 min,4 ℃终止反应。待PCR反应产物冷却后,加入1 μLDpnⅠ,混合均匀,37 ℃ 孵育1 h。转化到DH5α大肠杆菌和提取质粒DNA,最后转染到PC-3细胞,萤光素酶分析同前。

Figure 1. Putative SRE and point mutation site in prohibitin promoter DNA sequence.
图1推测的SRE位点和点突变位点
3统计学处理
用SPSS 16.0统计软件分析。数据用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD法)。以P<0.05为差异有统计学意义。
结 果
1PHB启动子和各分段产物构建检测
琼脂糖凝胶电泳可见分子量从1 192 bp~179 bp不等的条带,符合实验设计长度,见图2。DNA测序进一步证实。

Figure 2. PCR results of constructedPHBpromoter(P-1192)and successive promoter truncations.
图2PCR扩增得到的PHB启动子和各分段产物的凝胶电泳
2PHBpromoter和各分段产物构建质粒检测
XhoI和HindIII双酶切后,采用T4连接载体PGL3,转染到PC-3 细胞内提取质粒产物凝胶电泳,可见分子量从约6 000 bp~3 000 bp不等的条带,符合实验设计,见图3。DNA测序进一步证实。
Figure 3. PCR results of constructed plasmids ofPHBpromoter(pP-1192) and successive promoter truncations.
图3PHB启动子和各分段产物构建质粒检测
3双酶切检测PHB启动子和各分段产物构建质粒
采用XhoI和HindIII双酶切质粒产物后凝胶电泳,可见酶切下的PHB启动子和各分段产物,长度符合PCR构建产物,在5 000 bp处可见平行酶切产物,为酶切下的pCL3,见图4。DNA测序进一步证实。

Figure 4. Double digestion ofPHBpromoter plasmid (pP-1192) and successivePHBpromoter truncated product plasmids.
图4双酶切检测PHB启动子和各分段产物构建质粒
4PHB启动子各分段产物萤光素酶活性
同转染完整PHB启动子的PC-3细胞比较,转染pPHB-179的细胞萤光素酶活性显著降低(P<0.05)。pPHB-179中LPDS组和LPDS+CHO组萤光素酶活性无显著差异(P>0.05),见图5。

Figure 5. Relative luciferase activity ofPHBpromoter and successive promoter truncations. LPDS: lipoprotein-deficient fetal bovine serum; CHO: cholesterol.Mean±SD.n=3.*P<0.05vsLPDS group;#P<0.05vsother plasmids.
图5PHB启动子各分段产物的相对萤光素酶活性
5SRE基因位点点突变对萤光素酶活性的影响
点突变位于PHB启动子上的-117~-108 bp的SRE可能位点后,同pPHB-1192 比较,SREMUT 点突变组萤光素酶活性显著降低(P<0.05)。SREMUT中LPDS组和LPDS+CHO组萤光素酶活性无显著差异(P>0.05),见图6。
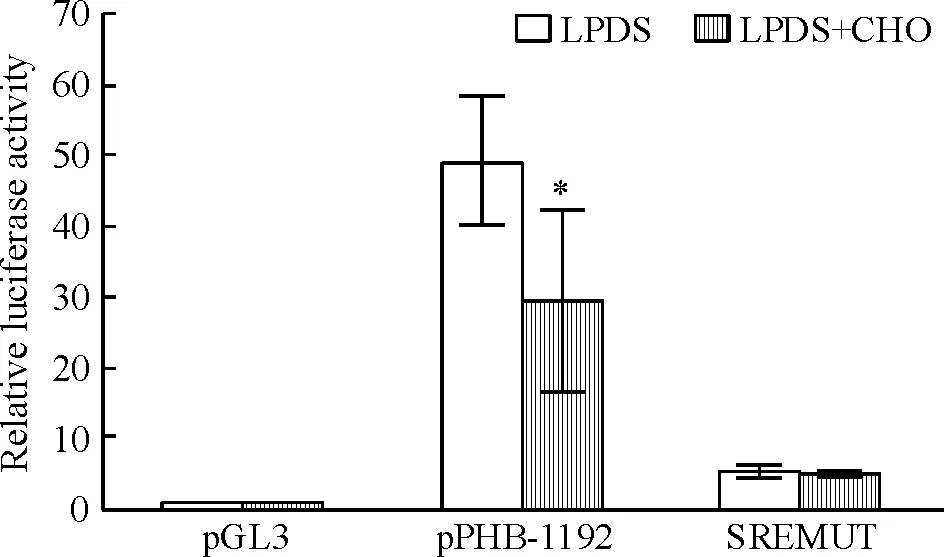
Figure 6. Relative luciferase activity of pGL3 vector (pGL3), fullPHBpromoter (pPHB-1192) andPHBpromoter with mutation of SRE site(SREMUT).Mean±SD.n=3.*P<0.05vsLPDS group.
图6pGL3、pPHB-1192和SREMUT的相对萤光素酶活性
讨 论
胆固醇在前列腺癌进展中发挥重要作用。我们既往研究结果表明,培养基中胆固醇降低抑制前列腺癌PC-3细胞生长,同时PHB基因表达升高[1-2],提示PHB可能是前列腺癌细胞的胆固醇敏感活性的细胞周期调控因子。
SREBP是脂肪生成的重要转录因子,在去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC)发展过程中,前列腺癌组织内SREBP表达升高, SREBP的N端(68 kD)转录进入细胞核增加,与胆固醇和脂肪酸合成有关的多种基因启动子上SRE位点相结合,激活相关基因的转录,合成胆固醇[5],最终转变为雄激素导致肿瘤进展[6]。SREBP及其靶基因FAS具有代谢活性的致癌基因,在前列腺癌进展中发挥作用[7]。
近年一项研究表明,SREBP表达升高诱导AR启动子活化和基因表达并且促进前列腺癌细胞增殖[8]。在乳腺癌细胞、肝癌细胞和巨噬细胞中都发现了SREBP受PI3K/Akt以及MAPK信号通路调控[9],采用MAPK和PI3K信号通路抑制剂能够下调SREBP和FAS表达并且抑制脂肪酸合成。在LNCaP及C4-2B前列腺癌细胞中采用MAPK选择性抑制剂,能够抑制SREBP、FAS和AR蛋白表达[10],抑制前列腺癌细胞生长,提示在AR阳性表达的前列腺癌细胞中,MAPK通路是调控SREBP、AR和FAS的主要通路。基于以上研究表明,SREBP通过结合SRE使胆固醇合成相关靶基因表达上调,在CRPC进展过程中发挥重要作用。
目前研究已经证实,PHB基因3′非翻译区(untranslated region,UTR)具有阻止细胞G和S期间增殖功能的作用。在正常成纤维细胞和HeLa细胞中显微注射PHB mRNA能阻止细胞进入S期[11]。在病毒和质粒载体中基于PHB mRNA 3′UTR的抑制子RNA的表达能用于治疗癌症,相似的反义抑制靶标编码序列作用PHB 3′UTR可能会通过降低RNA稳定性而降低PHB蛋白表达水平,编码区的反义治疗可特异地降低蛋白水平并使抑制子RNA 3′UTR整体抑制细胞增殖。对PHB的3′UTR与α-原肌球蛋白和核苷酸还原酶关系的研究表明,PHB3′UTR片段代表着一类独特的RNA调节因子,对控制增殖、分化和抑制肿瘤有重要作用[22]。
我们的前期研究和本研究均证实,低胆固醇培养基中前列腺癌PC-3细胞中的PHB表达显著高于对照组。 本研究进一步通过系列的PHB基因启动子分段切除并结合pGL3载体,转染至PC-3细胞进行萤光素酶活性测定。结果发现对胆固醇敏感区域位于PHB启动子3′UTR上的-153~-35 bp区间,这同其它研究认为PHB 3′UTR为其发挥作用位点的结论一致。此后通过序列分析证实在PHB启动子-117 bp~-108 bp存在SRE同源位点(5’-GGTTCTAAGC-3’),点突变此位点导致萤光素酶活性显著下降。以上证据表明,此SRE同源位点是PHB发挥其胆固醇敏感活性的作用位点。SRE是SREBP通路合成胆固醇中的重要调控基因,同时提示了PHB同SREBP可能存在联系。在前列腺癌CRPC进展过程中,SREBP表达上调合成胆固醇最终转变为雄激素。这也是目前采用雄激素阻断的内分泌治疗失败的重要机制之一。进一步研究胆固醇敏感PHB在前列腺癌CRPC进展中的作用,不仅能深入阐述CRPC进展机制,并且为临床提供新的靶向治疗理论依据及新的预后指标。
[参考文献]
[1]董培,李永红,尧凯,等. Prohibitin 在低胆固醇培养人前列腺癌细胞系PC-3中表达上调及其可能机制[J].中国病理生理杂志,2011,27(11):2116-2119.
[2]Dong P, Flores J, Pelton K, et al. Prohibitin is a cholesterol-sensitive regulator of cell cycle transit [J]. J Cell Biochem, 2010,111(5):1367-1374.
[3]Mishra S, Murphy LC, Murphy LJ. The Prohibitins: emerging roles in diverse functions [J]. J Cell Mol Med, 2006,10(2):353-363.
[4]Mishra S, Ande SR, Nyomba BL.The role of prohibitin in cell signaling[J]. FEBS J, 2010, 277(19): 3937-3946.
[5]Ettinger SL, Sobel R, Whitmore TG, et al. Dysregulation of sterol response element-binding proteins and downstream effectors in prostate cancer during progression to androgen independence[J]. Cancer Res, 2004,64(6): 2212-2221.
[6]Loeb S, Kan D, Helfand BT, et al. Is statin use associa-ted with prostate cancer aggressiveness? [J]. BJU Int, 2010,105(9):1222-1225.
[7]Menendez JA, Decker JP, Lupu R. In support of fatty acid synthase (FAS) as a metabolic oncogene: extracellular acidosis acts in an epigenetic fashion activating FAS gene expression in cancer cells[J]. J Cell Biochem, 2005, 94(1):1-4.
[8]Huang WC, Li X, Liu J, et al. Activation of androgen receptor, lipogenesis, and oxidative stress converged by SREBP-1 is responsible for regulating growth and progression of prostate cancer cells[J]. Mol Cdancer Res, 2012, 10(1):133-142.
[9]Fuhrman B, Gantman A, Khateeb J,et al. Urokinase activates macrophage PON2 gene transcription via the PI3K/ROS/MEK/SREBP-2 signalling cascade mediated by the PDGFR-β[J]. Cardiovasc Res, 2009, 84(1):145-154.
[10] Huang WC, Zhau HE, Chung LW. Androgen receptor survival signaling is blocked by anti-β2-microglobulin monoclonal antibody via a MAPK/lipogenic pathway in human prostate cancer cells[J]. J Biol Chem, 2010, 285(11): 7947-7956.
[11] Jupe ER,Liu XT,Kiehlbauch JL, et al.The 3′ untranslated region of prohibitin and cellular immortalization[J]. Exp Cell Res,1996,224(1):128-135.
[12] Grimm C, Polterauer S, Zeillinger R, et al. The prohi-bitin 3’ untranslated region polymorphism in patients with ovarian cancer[J]. Eur J Obstet Gynecol Reprod Biol, 2008, 137(2):236-239.
