黑乳海参硫酸化多糖的提取纯化、结构特征及其抗凝活性
2013-04-11卢锋吴明一高娜刘光明赵金华
卢锋,吴明一,高娜,刘光明,赵金华*
(1.大理学院药学与化学学院,云南大理671000;2.中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室,昆明650201)
黑乳海参硫酸化多糖的提取纯化、结构特征及其抗凝活性
卢锋1,2,吴明一2,高娜2,刘光明1,赵金华2*
(1.大理学院药学与化学学院,云南大理671000;2.中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室,昆明650201)
目的:研究黑乳海参(Holothuria nobilis Selenka)中硫酸化多糖类型、理化性质及抗凝活性。方法:利用化学和物理相结合的分离方法进行纯化,采用色谱、化学、光谱等方法对其纯度、化学组成、分子量、特性黏度、旋光度、凝血活性等进行分析。结果:分离获得F-I、F-II两种多糖组分。F-I由葡萄糖醛酸、乙酰氨基半乳糖、岩藻糖和硫酸基(摩尔比1.00∶0.96∶1.18∶2.99)组成;F-II仅由岩藻糖和硫酸基(摩尔比1.00∶0.51);它们的理化性质显著不同,前者的抗凝效价约为后者的6倍。结论:黑乳海参中至少存在两种不同的硫酸化多糖,岩藻糖化糖胺聚糖和α-L-硫酸化岩藻聚糖,均具有强的抗凝血活性。
海参;多糖;纯化;理化性质;抗凝活性
近二十多年来,海参来源的硫酸化多糖的研究受到广泛关注。已报道的海参来源的硫酸化多糖的化学结构独特,其与哺乳动物来源的酸性黏多糖(糖胺聚糖)、陆生植物来源的酸性杂聚糖以及海洋来源的硫酸化岩藻聚糖均存在显著差异。研究表明,海参来源的硫酸化多糖可具有多种生物活性,如抗肿瘤、抗病毒、抗心血管疾病、抗氧化和免疫调节等〔1〕。黑乳海参(Holothuria nobilis Selenka)属棘皮动门(Echinodermata)海参纲(Holothuroidea)楯手目(Aspidochirotida)海参科(Holothuriidae)动物,在我国福建东山及西沙群岛海域均有分布,在东非等海域也有分布〔2〕,资源相对丰富。目前,研究表明〔3〕,黑乳海参含有多种皂苷类化学成分,但体壁多糖类组分则报道较少。本文研究黑乳海参体壁中硫酸化多糖组分,分离纯化了两种硫酸化多糖组分F-I和FII,其中,对F-I和F-II的化学组成、理化性质进行初步研究,确认F-I为杂聚糖,其化学结构鉴定为岩藻糖化糖胺聚糖(fucosylated glycosaminoglycan,FGAG),而F-II为均聚糖,其化学结构为硫酸化岩藻聚糖(fucan sulfate,FS)。
1 材料
1.1 实验材料木瓜蛋白酶(规格:1 kg/瓶,批号SLBB9515V),岩藻糖标准品(批号060M1320),氨基半乳糖标准品(批号030M1865)厂家均为美国Sigma;葡萄糖醛酸标准品(批号10136713),半乳糖标准品(批号10134490),葡萄糖标准品(批号10145311)厂家均为美国AlfaAesar;右旋糖酐系列标准品(批号140637-2000-01至140646-2000-01),购自中国药品生物制品检定所。其他试剂均为分析纯。
1.2 实验仪器FE20 pH计(瑞士梅特勒-托利多公司);Agilent 1200型高效液相色谱仪(美国安捷伦公司);FD-5冷冻干燥机(北京博医康公司);BSZ-100自动部分收集器(上海康华生化公司);3.5 kDa透析袋(上海欧韦达仪器科技有限公司);1836A乌氏黏度计(上海良晶玻璃仪器厂);DDSJ-308A雷磁电导率仪(上海精科公司);p-1-020全自动数字旋光仪(日本Jasco);Bruker Tensor27型红外光谱仪;AvanceIII 600 MHz超导核磁共振仪(瑞士布鲁克公司);Dowex(r)50WX8 50-100目(1×13 cm)强酸型阳离子交换树脂(美国Alfa Aesar);DE 52(3×10 cm)阴离子交换树脂(北京经科宏达生物公司)。
1.3 实验动物市售黑乳海参的干燥体壁,经中国科学院青岛海洋研究所肖宁博士鉴定为黑乳海参(Holothuria nobilis Selenka)。
2 实验方法
2.1 黑乳海参多糖的提取纯化干燥黑乳海参310 g,10倍去离子水浸泡过夜后捣碎,0.5 mol/L NaOH中60℃下碱解2 h,冷却后,6 mol/L HCl调pH中性后,以5%木瓜蛋白酶50℃下酶解6 h,90℃灭酶冷却后,等电点法(pH 2.8,4℃)除蛋白。提取液醇沉淀(60%乙醇,4℃),沉淀经无水乙醇洗涤后,真空干燥得粗多糖(约19.5 g)。粗多糖20倍量水溶,H2O2氧化法脱色(3%H2O2,pH 11,50℃),冷却后将pH调至7,离心去沉淀,上清液在4℃下以终浓度40%和60%乙醇分级醇沉。
40%醇沉产物水溶后,继以2 mol/L醋酸钾盐析,透析(3.5 kDa透析袋)所得沉淀,冻干得多糖组分FI(1.26 g)。60%醇沉产物水溶后,过DE 52(3×10 cm)阴离子交换树脂柱,含0.05 mol/L醋酸钾的0.50~2.00 mol/L NaCl溶液梯度洗脱,自动部分收集器收集的各流份经高效凝胶色谱(HPGPC)法检测。HPGPC保留时间相同的流份合并后,3.5 kDa的透析袋透析,冻干,得多糖组分F-II(1.88 g)。
2.2 分子量及其分布的测定HPGPC法分析F-I、F-II的分子量及其分布〔4〕。Agilent 1200型高效液相色谱仪,Shodex Ohpak SB-804 HQ(7.8 mm×300 mm)凝胶色谱柱,柱温35℃,G1362A示差检测器检测,流动相为0.1 mol/L NaCl,流速0.5 mL/min。以系列分子量右旋糖酐作分子量工作曲线,再以已知分子量(6.582 kDa)的FGAG校正上述曲线。样品、标准品溶液进样量均为25 μL,根据HPGPC色谱图,绘制多糖分子量-洗脱体积标准曲线。根据标准曲线,GPC专用软件计算F-I、F-II的分子量及其分布。
2.3 理化性质检测
2.3.1 比旋光度测定精确称取F-I、F-II各5.00 mg,溶于1 mL H2O,按中国药典(2010版)二部附录VIE方法测定。
2.3.2 特性黏数的测定精确称取F-I、F-II各40.0 mg溶于4 mL 0.1 mol/L NaCl,按照中国药典(2010版)二部附录VIG方法,应用乌式黏度计测定。
2.4 化学组成检测
2.4.1 柱前衍生化法检测单糖组成取F-I、F-II 5.00 mg,加2 mol/L三氟乙酸1 mL 100℃水解8 h,水解液蒸干,加1 mL水溶解,取水解液与0.6 mol/L NaOH,混匀;加0.5 mol/L PMP进行衍生化30 min,取出冷至室温,HCl中和;加水溶解,等体积氯仿萃取,弃去氯仿相,将水相过滤后与混合单糖对照品利用高效液相色谱法(HPLC)进行分析。
2.4.2 葡萄糖醛酸的测定将多糖组分F-I、F-II配成1 mg/mL的水溶液,以葡萄糖醛酸为标准品,利用间羟邻苯法进行测定〔5〕。
2.4.3 氨基半乳糖的测定将F-I、F-II经酸水解后,以乙酰氨基半乳糖为标准品,利用Elson-morgan法进行测定〔5〕。
2.4.4 岩藻糖的测定将F-I、F-II配成1 mg/mL的水溶液,以岩藻糖为标准品,利用半胱氨酸法进行测定〔8〕。
2.4.5 硫酸羧酸摩尔比的测定准确称取样品5 mg,经Dowex(r)50WX8 50-100目(1×13 cm)强酸型阳离子交换树脂转化成氢型,用0.01 mol/L的NaOH滴定液在电导率仪监测下滴定,通过滴定曲线计算〔5〕。
2.5 红外光谱KBr压片法,Bruker Tensor27型红外光谱仪扫描样品在4000~400 cm-1的红外光谱。
2.61H NMR谱图称取样品5 mg,溶于500 μL D2O(99.9 Atom%D)中,于25℃600 MHz超导核磁共振仪下测定。
2.7 抗凝活性参照文献〔6〕检测活化部分凝血活酶时间(Activated Partial Thromboplastin Time,APTT)、凝血酶原时间(Prothrombin Time,PT)、凝血酶时间(Thrombin Time,TT)。
3 结果与分析
3.1 黑乳海参多糖的提取与纯化本文采用碱解-酶解法提取黑乳海参体壁多糖,其粗多糖得率约6.29%。海参所含糖胺聚糖类成分FGAG以糖蛋白形式存在于体壁,碱解的目的是通过去垢消解组织结构,也是裂解FGAG连接核心蛋白的糖苷键;酶解的作用是水解蛋白,促进多糖释放以及利于后续纯化。
黑乳海参粗多糖的HPGPC图谱(图1中A)可见a、b、c等主要色谱峰,其中,根据二极管整列检测器获得的c峰UV光谱信息判断,其主要组成成分是蛋白解聚过程产生的寡肽类物质,并非糖类化合物。
所得粗多糖首先通过分级醇沉初步分离a、b两个色谱峰对应的多糖组分,继而通过盐析、透析等纯化步骤获得与色谱峰b(图1中B)对应的多糖组分FI,通过离子交换色谱层析以及透析纯化等步骤获得与色谱峰a(图1中C)对应的多糖组分处理获得F-II。所得多糖组分F-I、F-II的得率分别为0.41%和0.61%。
检测结果显示,F-I、F-II的HPGPC色谱峰的峰形对称,结合后文所述理化性质检测可以判断,F-I、F-II均为均一性多糖。
3.2 F-I与F-II的基础理化性质
3.2.1 分子量及分布HPGPC检测结果显示,F-I、F-II多糖组分的重均分子量分别为约55,320 Da和约475,800 Da,体现分子量分布特征的分散系数(Mw/Mn)分别为约1.3和1.6,表明两种多糖成分均具有良好的均一性。见图1和表1。

图1 黑乳海参粗多糖及其纯化组分的HPGPC色谱图
3.2.2 旋光度与特性黏度如表1所示,F-I、F-II的比旋度分别为约-46°和约-193°,其数值分别接近文献报道的岩藻糖化糖胺聚糖〔7〕以及岩藻聚糖〔8〕,并且提示,F-I、F-II多糖组分中均可能存在α-L-岩藻糖残基。F-I、F-II的特性黏数分别为约34和约428 mL/g,显然,其黏度与多糖组分的分子量大小相关,同时也与硫酸酯多糖的属性相关。

表1 多糖组分F-I与F-II的理化特征
3.2.3 单糖组成柱前衍生化单糖组成分析结果,见图2。F-I的组成单糖包括葡糖糖醛酸(GlcUA)、乙酰氨基半乳糖(GalNAc)和岩藻糖(Fuc),而F-I的组成单糖仅岩藻糖(Fuc)。见表2。F-I、F-II均含有一定量的硫酸基团。电位滴定法检测的F-I多糖组分中的羧酸基和硫酸基的摩尔比为1∶2.99。显然,F-I、F-II均为硫酸化多糖。F-II是由硫酸化L-岩藻糖组成的大分子均聚糖,硫酸化岩藻聚糖(FS)。F-I由三种单糖组成,其中,GlcUA和GalNAc两种单糖的组成比例接近1∶1,提示其可能存在类糖胺聚糖结构的多糖主链。
3.3 波谱分析

图2 柱前衍生化法分析单糖组成的HPLC图谱

表2 多糖组分F-I与F-II的化学组成
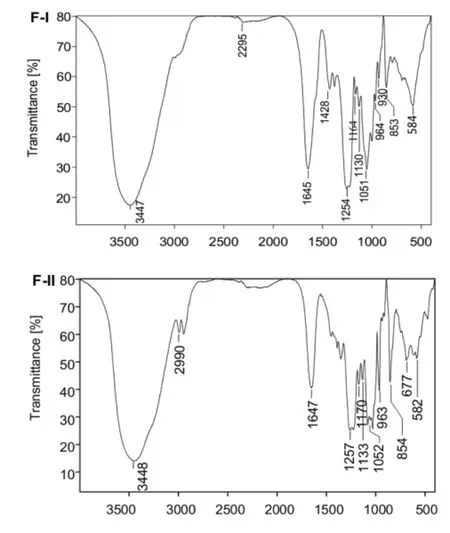
图3 F-1、F-II红外吸收光谱
3.3.1 IR光谱F-I、F-II的红外光谱,见图3。其中,F-I IR谱图显示了较典型的岩藻糖化糖胺聚糖的结构特征〔9〕。1 254 cm-1为S=O非对称伸缩振动〔10〕,显示硫酸酯基的存在;1 645 cm-1的C=O伸缩振动峰以及1 428 cm-1的羧基C-O伸缩振动,提示GlcUA羧基及GalNAc乙酰基的存在;853和822 cm-1谱峰提示FI中GalNAc可存在4-、6-位硫酸酯基取代。F-I、F-II中3 347和3 348 cm-1处的宽峰为醇羟基O-H和N-H伸缩振动峰,1 130-1 170 cm-1范围内的谱峰显示了糖环内C-O-C伸缩振动;1 051-1 052 cm-1显示糖环仲醇C-O伸缩振动。此外,F-II谱图中和1 257 cm-1为S=O谱峰,1 647 cm-1为结晶水吸收峰〔11〕。
3.3.21H NMR谱图F-I1H NMR谱图。见图4中A。Fuc甲基峰出现在约1.29~1.35 ppm处,GalNAc甲基峰位于约2.04~2.06 ppm,两甲基峰的面积比约1∶1.15,此与单糖组成的化学法分析结果基本一致。FII1H NMR谱图中可见约1.28 ppm处的Fuc甲基峰,未见GalNAc甲基峰,与F-II不含GalNAc相符。

图4 F-I和F-II的1H NMR谱图
F-I和F-II谱图中均可见位于5.1~5.7 ppm处信号峰,其为α-L-Fuc的异头碳质子信号〔6,12〕,其信号峰面积与Fuc甲基峰面积比约1∶3。F-I为岩藻糖化糖胺聚糖(FGAG),其α-L-岩藻糖的异头碳质子信号的位置与其硫酸酯的存在位置相关,黑乳海参FGAG中的Fuc的端基氢信号均位于5.35~5.48 ppm之间,与见于报道的梅花参、刺参以及L.grisea〔6,13-14〕来源的FGAG相比,基本不含端基信号位于约5.6 ppm的2,4-二硫酸岩藻糖基。F-II所含Fuc端基氢信号主要分为两组,其分别位于5.1~5.15 ppm和5.4~ 5.5 ppm处,且两组信号峰的面积比接近1∶1,其与提示其可能存在规则的单糖连接顺序。F-I和F-II谱图中的糖环氢信号复杂,重叠严重,尚难精确归属,但其基本特征分别与FGAG和FS硫酸化多糖的结构特征相符。
3.4 抗凝活性F-I、F-II对人血浆APTT、PT、TT时间的影响,见表3。结果表明,F-I和F-II均具有一定的抗凝血活性,且F-I对APTT的影响大于F-II,但二者均小于肝素,同时F-I、F-II对PT及TT几乎无影响。表中数据表明,F-I、F-II均有一定的抗内源性凝血活性,且F-I比F-II较强。

表3 多糖组分F-I与F-II的抗凝活性
4 讨论
本文从黑乳海参干燥体壁中分离纯化得到了两种硫酸化的多糖F-I和F-II,并初步表征了它们的理化性质。
单糖组成、IR和1H NMR分析结果显示,F-I为岩藻糖化糖胺聚糖(FGAG),1H NMR谱图分析表明,与已见报道的刺参、梅花参以及L.grisea来源的FGAG相比,其基本化学结构存在近似之处,但侧链岩藻糖基类型存在显著不同;F-II为硫酸化岩藻聚糖,其1H NMR显示其可能具有规则的连接次序。F-I和F-II均具有一定的抗凝活性,其中,以APTT时间影响计,FI的活性较F-II强约6倍。
〔1〕Bordbar S,Anwar F,Saari N.High-value components and bioactives from sea cucumbers for functional foods-a review〔J〕.Mar.Drugs,2011,9(10):1761-1805.
〔2〕廖玉麟.中国动物志棘皮动物门海参纲〔M〕.北京:科学出版社,1997:121.
〔3〕张佳佳,戴静波,巫军,等.黑乳海参化学成分的研究〔J〕.中药材,2008,31(4):538-539.
〔4〕Wu MY,Xu SM,Zhao JH,et al.Free-radical depolymerization of glycosaminoglycan from sea cucumber Thelenata ananas by hydrogen peroxide and copper ions〔J〕.Carbohydr.Polym,2010,80(4):1116-1124.
〔5〕张惟杰.糖复合物生化研究技术〔M〕.2版.杭州:浙江大学出版社,1999:14-21.
〔6〕Gao N,Wu MY,Zhao JH,et al.Preparation and characterization of O-acylated fucosylated chondroitin sulfate from sea cucumber〔J〕.Mar.Drugs,2012,10(8):1647-1661.
〔7〕Wu MY,Xu SM,Zhao JH,et al.Physicochemical characteristics and anticoagulant activities of low molecular weight fractions by free-radical depolymerization of a fucosylated chondroitin sulphate from sea cucumber Thelenota ananas〔J〕.Food Chem,2010,122:716-723.
〔8〕Alves AP,Mulloy B,Mourão PAS,et al.Sulfated polysaccharides from the egg jelly layer are speciesspecific inducers of acrosomal reaction in sperms of sea urchins〔J〕.J.Biol.Chem,1997,272(11):6965-6971.
〔9〕Zhang HJ,Mao WJ,Fang F,et al.Chemical characteristics and anticoagulant activities of a sulfated polysaccharide and its fragments from Monostroma latissimum〔J〕.Carbohydr.Polym,2008,71(3):428-434.
〔10〕Chen SG,Xue CH,Yin LA,et al.Comparison of structures and anticoagulant activities of fucosylated chondroitin sulfates from different sea cucumbers〔J〕. Carbohydr.Polym,2011,83(2):688-696.
〔11〕Giorgio B,Georg F.Properties of highly purified fucan〔J〕.J.Biol.Chem,1962,237(1):75-80.
〔12〕Cinelli LP,Castro MO,Mourão PAS,et al.Expression of two different sulfated fucans by females of lytechinus variegates may regulate the seasonal variation in the fertilization of the sea urchin〔J〕.Glycobiology,2007,17(8):877-885.
〔13〕Yoshida K,Minami Y,Nemoto H,et al.Structure of DHG,a depolymerized glycosaminoglycan from sea cucumber,Stichopus japonicas〔J〕.Tetrahedron Lett,1992,33(34):4959-4962.
〔14〕Mourão PAS,Pereira MS,Pavão MS,et al.Structure and anticoagulant activity of a fucosylated chondroitin sulfate from echinoderm.Sulfated fucose branches on the polysaccharide account for its high anticoagulant action〔J〕.J.Biol.Chem,1996,271(39):23973-23984.
(责任编辑 李杨)
Extraction,Purification,Structure Characteristics and Anticoagulation of the Sulfated Polysaccharides from the Sea Cucumber Holothuria nobilis
LU Feng1,2,WU Mingyi2,GAO Na2,LIU Guangming1,ZHAO Jinhua2*
(1.College of Pharmacy and Chemistry,Dali University,Dali,Yunnan 671000,China;2.State Key Laboratory of Phytochemistry and Plant Resources in West China,Kunming Institute of Botany,Chinese Academy of Sciences,Kunming 650201,China)
Objective:To study the polysaccharide types,physicochemical properties and anticoagulant activities of sulfated polysaccharides from the sea cucumber Holothuria nobilis Selenka.Methods:Sulfated polysaccharides were purified by methods of chemistry and physics.Physicochemical properties and biological activities of the saccharides,such as purity,chemical composition, molecular weight,intrinsic viscosity,optical rotation and anticoagulant activities were determined by methods of chromatography, chemistry,spectrum technologies,etc.Results:The polysaccharides were separated into two fractions,F-I and F-II,respectively.The components of F-I were identified as glucuronic acid,aminogalactose,fucan and sulfate(molar ratio 1.00∶0.96∶1.18∶2.99);F-II contained only fucan and sulfate(molar ratio 1.00∶0.51).The two polysaccharides were significantly different in the physicochemical properties,and F-I had 6 times of anticoagulant potency compared to the F-II.Conclusion:The sea cucumber H.nobilis contains at least two types of sulfated polysaccharides,a fucosylated glycosaminoglycan sulfate and a sulfated α-L-fucan which have anticoagulant activities.
sea cucumber;polysaccharides;purification;physico chemical characteristics;anticoagulant activities
R284.1
A
1672-2345(2013)06-0012-05
10.3969/j.issn.1672-2345.2013.06.004
云南省高端人才引进计划基金资助项目(2010CI116);国家自然基金青年科学基金资助项目(81102372)
2013-03-18
2013-04-06
卢锋,硕士研究生,主要从事天然药物化学研究. *通信作者:赵金华,研究员.
