水飞蓟素胶囊溶出度一致性评价研究
2013-04-08花逾冬刘延龙刘娟
花逾冬 刘延龙 刘娟
(1.上海市生物医药科技产业促进中心 上海 201203;2.上海世康特制药有限公司 上海 201809 )
水飞蓟素(silymarin,1)具有阻止或抑制脂质过氧化,稳定肝细胞膜,改善肝功能的作用,对急慢性肝炎、肝硬化和代谢中毒性肝损伤具有较好的疗效。1为水难溶性药物,用普通方法制备口服制剂,生物利用度较低。采用固体分散体等制剂工艺以期提高溶出度和生物利用度的研究有不少报道[1-4]。多种pH溶出介质中的溶出曲线对比已成为对口服制剂质量一致性和体内生物等效性评估的重要手段[5-7]。本文以市售1胶囊(利加隆)作为参比药物,同时与1原料药和市售益肝灵片作比较,考察以固体分散原理自制的试制品1胶囊的溶出度并作一致性评价研究。
按照USP和进口药品注册标准,将1含有的6种组份作为溶出度考察对象,并按以下方法组合进行计算:水飞蓟宾(sylibin,2)其中含水飞蓟宾A和水飞蓟宾B(sylibin A + sylibin B);异水飞蓟宾(isosylibin,3)其中含异水飞蓟宾A和异水飞蓟宾B(isosylibin A + isosylibin B);水飞蓟汀和水飞蓟泞(sylichristin +sylidianin,4)。上述各异构体组份含量之和为1含量。
1 仪器与试药
ZRS-8G智能溶出试验仪(天津天大天发科技有限公司),Agilent1200高效液相色谱仪, MP1100B型电子分析天平。
2对照品(中国药品生物制品检定所,批号110856-200604),3、4对照品(上海同田生物技术有限公司,批号分别为09121523和09121521);1胶囊(利加隆)(规格:140 mg/粒,德国马博士大药厂,批号B0802693);市售益肝灵片( 规格:38.5 mg/片,上海复兴朝辉药业有限公司,批号1103F030);试制品1胶囊(含量:143 mg/粒,批号110301);1原料药(辽宁省盘锦华成药业有限公司,含量:80.2%,粒度:过100目28.7%、80目至00目61.6%、80目以下9.7%,比表面积:0.375 m2/g,批号20090804);水为超纯水;甲醇(色谱纯);其他试剂均为分析纯。1的理化性质[8]:1在水中的溶解度为0.040 1 mg/ml。由丙酮加石油醚所得水飞蓟宾,为含1分子水之晶体,mp 167 ℃,180 ℃分解。水飞蓟宾溶于丙酮、乙酸乙酯、甲醇、乙醇,微溶于氯仿,不溶于水。
2 方法与结果
2.1 各组份定量方法及验证
2.1.1 色谱条件与系统适用性试验
色谱柱:十八烷基硅烷键合硅胶为填充剂,(4.6 mm×125 mm,5 µm);柱温40 ℃;流动相:混合溶剂A[85%磷酸-甲醇-水(5∶35∶65)]和混合溶剂B[85%磷酸-甲醇-水(5∶50∶50)]梯度洗脱(表1);流速为 0.8 ml/min;检测波长为288 nm;进样量10 µl;水飞蓟宾A、B峰的分离度不得低于1.8。

表1 流动相梯度洗脱时间表
2.1.2 对照品溶液的制备
精密称定2对照品10 mg、3对照品2.5 mg、4对照品5 mg,分别置100 ml量瓶中,加甲醇溶解并稀释至刻度,摇匀,作为对照品溶液(1)、(2)、(3),2~8 ℃储存备用。
2.1.3 供试品溶液的制备
取试制品20粒内容物,混匀;精密称定117 mg,置100 ml量瓶中,加甲醇90 ml,混匀,超声处理20 min,加甲醇稀释至刻度;摇匀,静置,取上清液,用微孔滤膜(0.45 µm)滤过,取续滤液,即得。
2.1.4 HPLC测定及图谱
分别精密吸取对照品溶液(1)、(2)、(3)与供试品溶液各10 µl,进样,记录色谱图(图1、2)。
供试品溶液各色谱峰的保留时间与相应对照品溶液色谱峰保留时间一致。

图1 对照品溶液色谱图
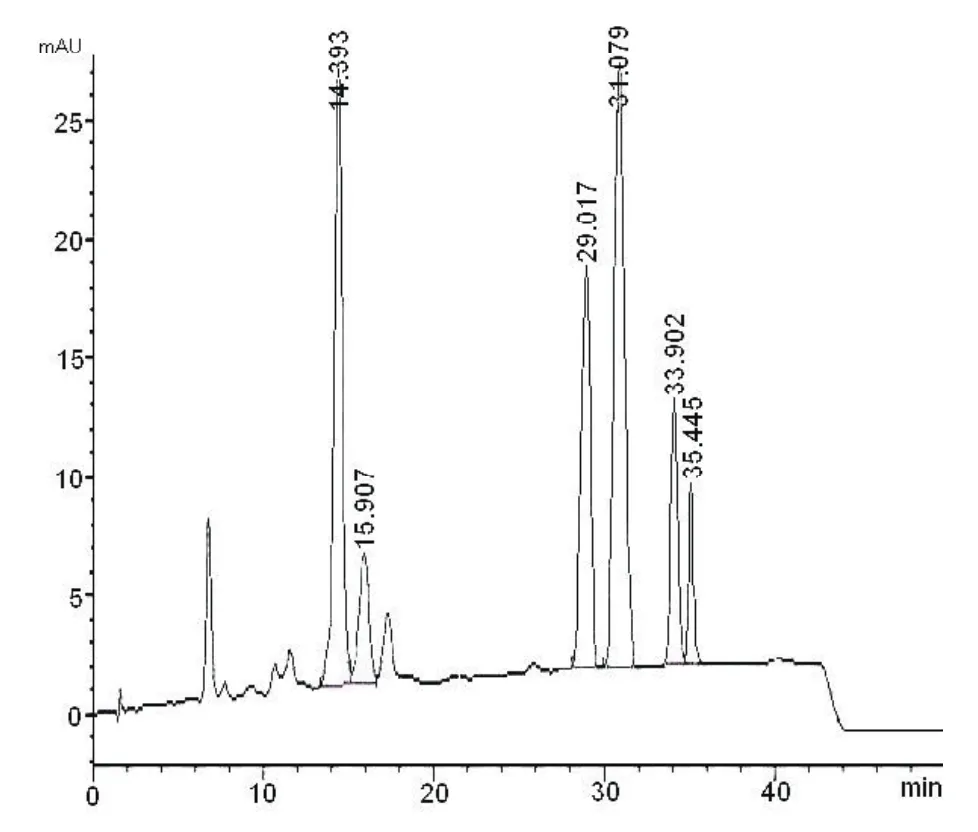
图2 供试品溶液色谱图
2.1.5 溶液稳定性试验
取室温存放的供试品溶液分别于0、2、4、8、12、24 h进样5 µl分析,结果见表2:
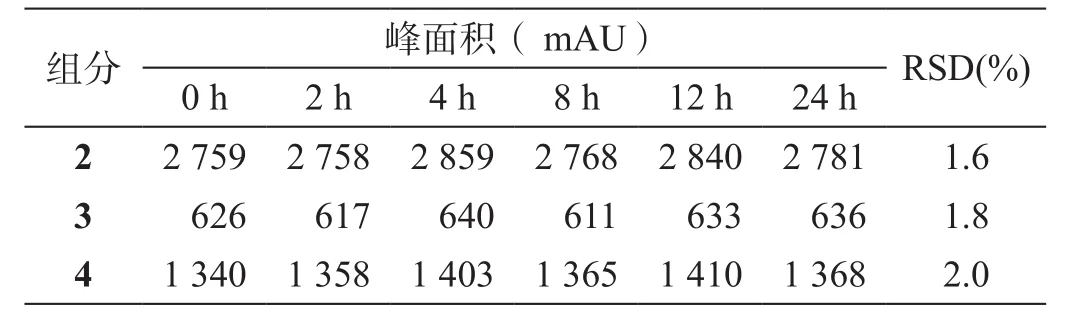
表2 室温保存不同时间样品溶液的稳定性试验
2.1.6 精密度试验
分别精密吸取对照品溶液(1)、(2)、(3)各 5 µl,连续进样6次,记录色谱图峰面积(表3)。

表3 含量测定的精密度试验测定结果(n=6)
结果显示,HPLC测定的2、3、4的峰面积的精密度RSD在0.1%~1.7%之间。
2.1.7 线性关系考察
取对照品溶液(1)、(2)、(3),每种分别进样 1、3、5、7 和10 µl,测定色谱图峰面积,以峰面积为纵坐标Y,进样量(µg)为横坐标X,得回归方程计算r,结果分别为:
水飞蓟宾:Y=3 010x+5.303,r=0.999,浓度范围 0.105 1 ~ 1.051 0 µg/ml;
异水飞蓟宾:Y=2 869x+0.196,r=0.999,范围浓度 0.027 1 ~ 0.271 5 µg/ml;
水飞蓟汀:Y=2 868x-4.647,r=0.999,浓度范围 0.055 5 ~ 0.554 7 µg/ml;
水飞蓟泞:Y=3 492x-19.69,r=0.999,浓度范围 0.055 1 µg/ml~ 0.550 8 µg/ml;
测定结果表明,各组份在相应的浓度范围内均呈现良好的线性关系。
2.1.8 加样回收率试验
精密吸取对照品溶液(1)、(2)、(3),分别用甲醇稀释0、5、10倍,得到高、中、低三种浓度的对照品,分别精密加入到已知浓度试制药物样品甲醇溶液中,照HPLC法测定各组分含量,并计算回收率、RSD(表4)。
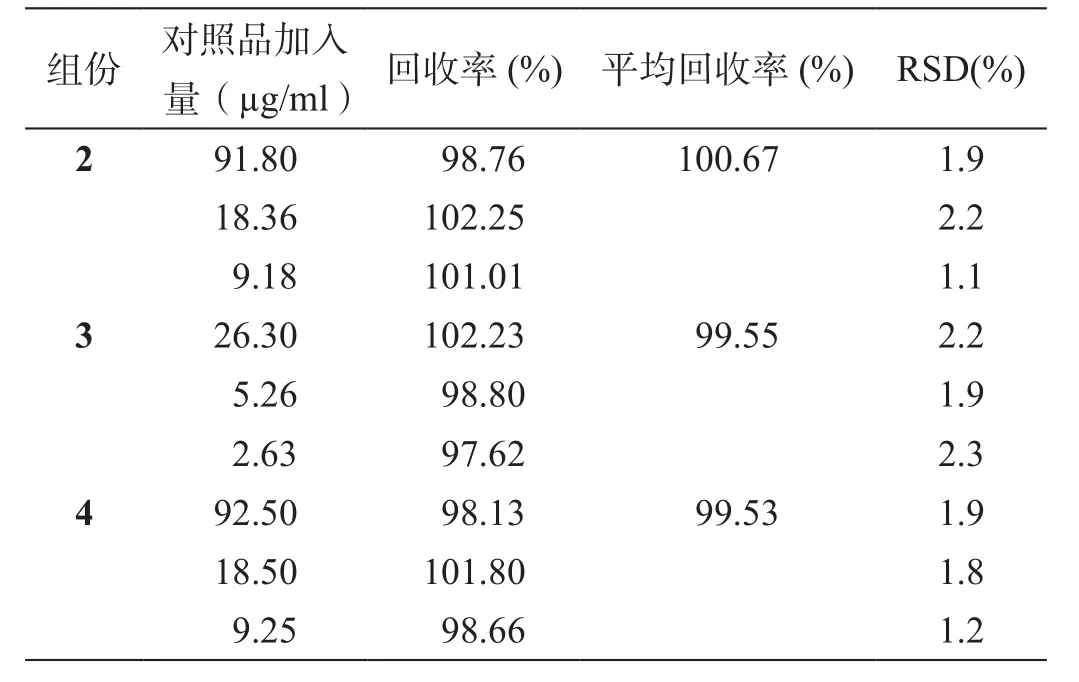
表4 加样回收率试验结果
结果表明,各组分回收率较好,方法可行。
2.2 溶出度测定条件
2.2.1 溶出介质的选择
按照《普通口服固体制剂溶出度试验技术指导原则》[9],并依照USP34,选择如下溶出介质:①pH 1.5盐酸溶液(取3.73 ml HCl加水稀释至1000 ml);②pH 5.8的磷酸盐缓冲溶液(取250 ml 0.2 mol/L KH2PO4溶液与18 ml 0.2 mol/L NaOH溶液混合,加水稀释至1000 ml);③pH 7.5的磷酸盐缓冲溶液(取250 ml 0.2 mol/L KH2PO4溶液与205 ml 0.2 mol/L NaOH溶液混合,加水稀释至1 000 ml);④含2%十二烷基硫酸钠的pH 7.5磷酸盐缓冲溶液。
2.2.2 转速及其他条件选择
USP34标准及水飞蓟素胶囊进口药品标准均采用桨法,转速均为100 r/min,本研究条件选择与其一致。
2.2.3 溶出度测定法
依照溶出度测定法(中国药典2010年版二部附录X C第二法),分别用以上溶出介质900 ml为溶剂,每杯放入试制品胶囊1粒,或参比药物胶囊1粒,或精密称定的装有含水飞蓟素140 mg的原料药的胶囊一粒,或益肝灵一片,依法操作,并分别在10、20、30、45、60和90 min取溶液,滤过,取续滤液作为供试品溶液。照HPLC方法测定,对照品溶液用相应溶出介质稀释5倍,计算每粒胶囊溶出的各组份含量,作溶出度曲线。
2.2.4 溶出度曲线
1各组份的溶出度曲线见图3。
2.2.5 不同介质中的溶出曲线
以各组份含量之和作为1含量,作不同介质中的溶出曲线(图4)。
2.3 数据处理及分析
采用非模型依赖法进行溶出曲线的比较,试制品和原料药与参比药中各组分的溶出曲线对比数据见表5,各样品与参比药中1的溶出曲线对比数据见表6。其相似因子(f2)是衡量两条溶出曲线相似度的参数,计算公式分别如下:
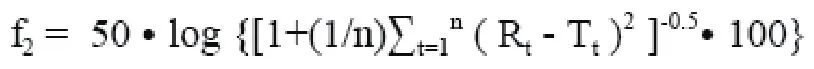
其中n为取样时间点个数,Rt为参比样品在t 时刻的溶出度值,Tt为在t 时刻的溶出度值。f2值越接近100,则认为两条曲线相似。一般情况下, f2值高于50,可认为两条曲线具有相似性,试制品与参比样品具有等效性。
实验取样时间点分别在10、20、30、45、60和90 min,共6个点,当药物溶出量低于85%时,n取值为6;当药物溶出量在某取样点超过85%时,以后的点不计入,n取值为去掉这些点后的取样点个数。

图3 1各组份的溶出度曲线
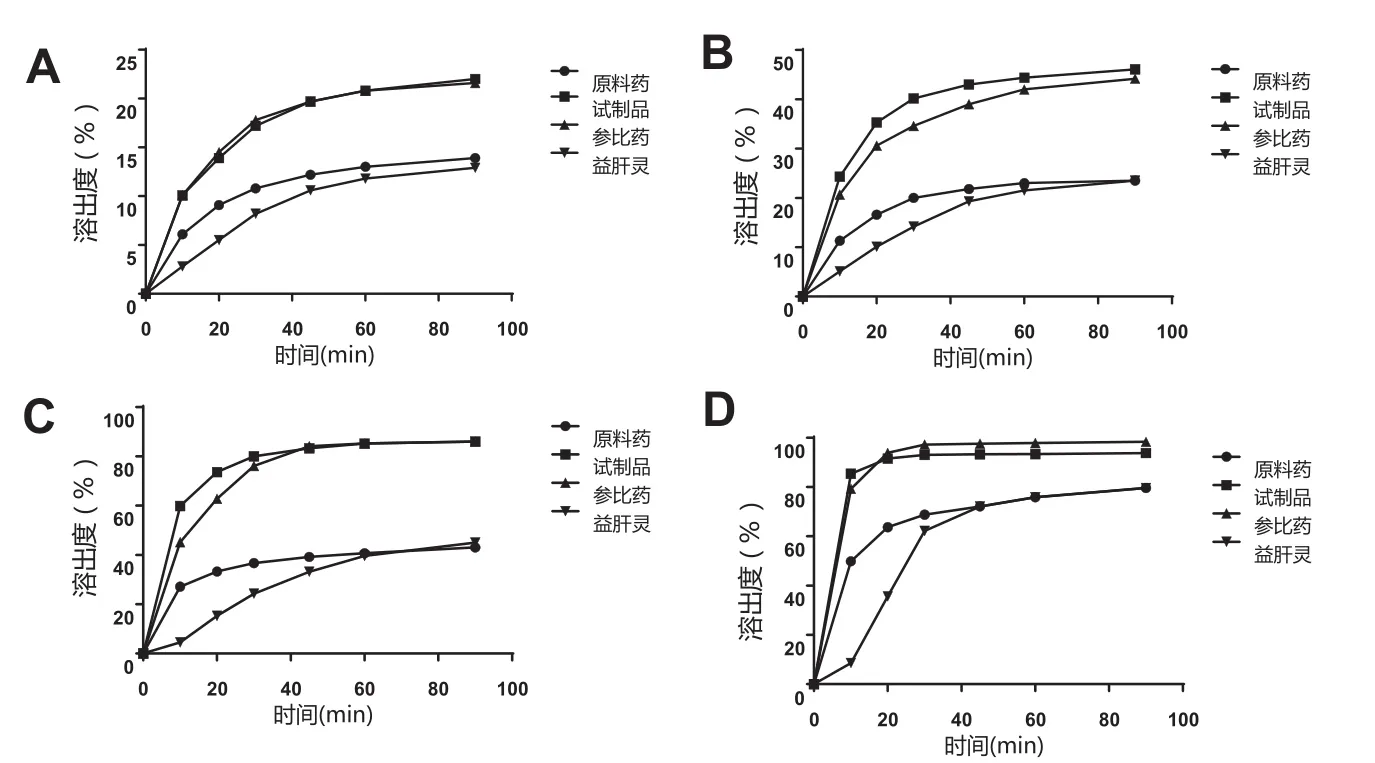
图4 各组份含量之和在不同介质中的溶出度
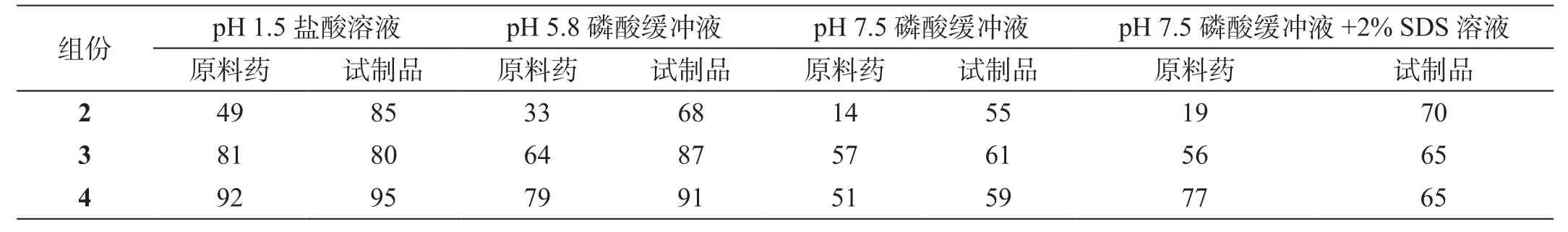
表5 不同溶出介质中各组份的溶出度相似因子(f2)

表6 不同溶出介质中各样品1的溶出度相似因子(f2)
3 讨论
1)试制品与参比药物对比,各试验条件下,各组份f2因子均大于50,显示二者溶出度具有相似性。
2)从原料药的溶出度数据可知,1所含的各组份在不同pH条件下溶解度有差异,在酸性条件下溶解较差,各组份的溶解度与pH值呈正相关性,在pH 7.5磷酸缓冲溶液中,组份3、4的溶解度达60%以上,组份2的溶解度仍然在20%以下。经制剂制备处理后,各组份溶出度随pH值变化趋势无显著改变。
3)对溶出度有限制性作用的主要因素是组份2。经适当方法制成制剂后,组份2溶出度明显改善,组份3的溶出度比原料药也有所提高,在pH 7.5磷酸缓冲溶液条件下均可达到75%以上。各制剂样品与原料药比较,组份4的溶出状况无明显差异。
4)在pH 1.5盐酸溶液条件下,各制剂样品与原料药比较,虽然f2因子显示差异不大,但各组份溶出都非常低,无实际意义。其他试验条件下,市售益肝灵片与参比药物对比,1的f2因子均小于50,显示溶出度有明显差异,市售益肝灵片溶出状况与原料药相似。
5)按照USP规定,以加2% SDS的pH 7.5磷酸缓冲溶液作溶出介质,在此条件下,未经任何处理的1原料药也有可能符合溶出75%的要求。这一标准显然有待商榷。
参考文献
[1]孙霞, 邱明丰, 李绍顺, 等. 水飞蓟素滴丸的溶出度研究[J]. 中国中药杂志, 2005, 30(4): 263-265.
[2]张自然, 陶建生, 邹凌燕, 等. 水飞蓟素原料药及制剂体外溶出度的研究[J]. 中南药学, 2007, 5(6): 496-499.
[3]欧少英, 龙晓英, 陈其邦. 水飞蓟素快速自增溶给药系统处方设计及体外释放度研究[J]. 广东药学院学报, 2004,20(03): 224-225.
[4]王建筑, 李菲, 郝吉福, 等. 水飞蓟素包合物和固体分散体的研究[J]. 泰山医学院学报, 2011, 32(1): 5-8.
[5]谢沐风. 溶出曲线相似性的评价方法[J]. 中国医药工业杂志, 2009, 40(4): 308-310.
[6]张启明, 谢沐风, 宁保明, 等. 采用多条溶出曲线评价口服固体制剂的内在质量[J]. 中国医药工业杂志, 2009,40(12): 946-955.
[7]谢沐风. 如何科学、客观地制订溶出度试验质量标准[J].中国医药工业杂志, 2012, 43(3): A23-A32.
[8]李计萍. 水飞蓟素药学研究进展综述[EB/OL]. (2005-03-26)[2013-06-04]. http://www.bioon.com/drug/chemdrug/95260.shtml.
[9]《口服固体制剂溶出度试验技术指导原则》(征求意见稿)[EB/OL].(2012-11-19)[2013-06-04]. http://www.cde.org.cn/zdyz.do?method=largePage&id=177.
