菊米提取液对人宫颈癌HeLa细胞生长的抑制作用*
2013-03-19陈慧玲蒋建平
况 炜,陈慧玲,蒋建平
(1.宁波卫生职业技术学院,浙江 宁波315100;2.浙江医学高等专科学校,杭州310053)
宫颈癌作为女性常见的恶性肿瘤之一,其发病率和死亡率一直居高不下。在我国,宫颈癌的发病率仅次于乳腺癌。目前,宫颈癌的治疗手段包括手术、放化疗、靶向治疗及中草药治疗等。多项研究表明[1-3],宫颈癌HeLa细胞对多种传统中草药及其有效成分敏感,如中药复方儿黄散、新木脂素、白花蛇舌草等分别通过下调Bcl-2蛋白、Mcl-1蛋白和Ki-67蛋白表达而诱导HeLa细胞凋亡;白桦脂酸则通过上调caspase-3、Cyto c蛋白表达而促进HeLa细胞凋亡。
菊米为菊科植物甘野菊(chrysanthemum seticuspe)的花蕾制作而成。经研究发现菊米提取液中的成分如小白菊内酯、木犀草素、芹菜素、萜类化合物等具有舒张血管、对抗心肌缺血再灌注损伤、抑制肿瘤细胞(如肝癌SMMC-7721、结肠癌SW620细胞)的增长并诱导其凋亡等作用[4]。本实验通过建立人宫颈癌HeLa细胞裸鼠移植瘤模型,研究菊米提取液对宫颈癌细胞生长的抑制作用,并将不同浓度的菊米提取液与HeLa细胞共同培养,观察药物对HeLa细胞增殖和凋亡的影响,为中药抗实体肿瘤及临床应用提供实验依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂与仪器 RPMI 1640(roswell park memorial institute1640)细胞培养基购自美国Gibco公司;碘化丙啶(propidium iodide,PI)、二甲基亚砜(DMSO)及噻唑蓝(thiazole blue,MTT)均购自 Sigma公司,caspase-3/7、caspase-6活性检测试剂盒购自 Promega公司,其他常规试剂均为国产分析纯。流式细胞仪(BD FACSCalibur)、酶联检测仪(Bio-Tek统一名称ELX800)、多功能分辨荧光仪 1420(Wallac 1420)均购自美国。
1.1.2 药物制备 野菊米购自遂昌华昊菊米有限公司。菊米提取液的制备:取干的野菊米加入10倍的无水乙醇室温萃取24 h,过滤去沉淀,上清液用旋转蒸发器浓缩后,用DMSO溶解,依次制备成1、2、5和10 mg/ml 4个浓度的母液。临用前再用含2%FBS的RPMI 1640培养液分别稀释1 000倍,制成相应的工作液(其中DMSO浓度为0.1%)。
1.1.3 细胞培养 人宫颈癌HeLa细胞购自中科院上海细胞库。含10%胎牛血清、100 U/ml青霉素及100μg/ml链霉素的 RPMI 1640完全培养液,置于37℃、饱和湿度、含5%CO2培养箱中培养人宫颈癌细胞株 HeLa。0.25%胰蛋白酶和 0.02%EDTA消化、传代细胞。选取对数生长期细胞进行实验。
1.1.4 实验动物 BALB/c-nu裸鼠50只,雌性,4~6周龄,体重18~22 g,购自杭州师范大学实验动物中心,饲养于SPF级动物实验室,保持恒定的湿度(40~80)%、温度(22~25)℃,经高压灭菌的标准饲料和水供动物自由饮食。裸鼠适应环境1周后即进行成瘤实验。
1.2 方法
1.2.1 裸鼠宫颈癌移植模型的建立 取处于对数生长期的HeLa细胞,经胰酶消化,PBS冲洗,经台盼蓝实验证实细胞存活率大于95%;制备单细胞悬液,调整密度至2×107cells/ml。在每只裸鼠右肩背部皮下注射0.2 ml单细胞悬液。动物继续饲养于SPF级环境内。待肿瘤长出后,每日测量肿瘤体积,7 d后所有裸鼠均出现大于100mm3的皮下结节,成瘤率为100%。
1.2.2 实验动物分组及给药 接种后第8天将成瘤裸鼠随机分为5组(n=10)。(1)对照组:荷瘤鼠不加以治疗,继续饲养至实验结束;(2)药物组:根据菊米提取液浓度不同又分为 4组(0.001、0.002、0.005、0.01mg/ml)。取不同浓度的菊米提取液灌胃,每只荷瘤鼠每天一次,每次胃内灌药5ml/kg,共14 d。
1.2.3 瘤体抑制率计算 实验结束将荷瘤鼠处死后,完整剥出瘤组织,测量各组裸鼠移植瘤的长度、宽度和高度,肿瘤体积=(长×宽×高)/2,取瘤体积的均值(cm3)。瘤体抑制率(%)=[1-(药物组瘤体积/对照组瘤体积)]×100
1.2.4 MTT法测定细胞生存率 用含2%FBS的DMEM培养液调整细胞密度至3×104cells/ml,180 μl/well(6×103个左右细胞量)接种于 96孔板中,16 h后给予各种不同处理,分为对照组(含终浓度为0.1%DMSO完全培养液培养)和4个不同浓度药物组(0.1%DMSO完全培养液中分别含 0.001、0.002、0.005、0.01mg/ml菊米培养液培养),并于 37℃、5%CO2条件下继续培养48 h。然后各孔中按1∶9加入5mg/ml MTT(用 pH 7.4 PBS配制),再置 37℃、5%CO2条件下继续培养4 h。弃去上清液,加入DMSO 150μl/well,摇床 30min后,在酶联检测仪上 570 nm波长处测吸光度(A)值,以A值间接反映存活细胞数量,计算细胞增殖抑制率。细胞增殖抑制率(%)=(1-A给药/A对照)×100
1.2.5 细胞凋亡测定 采用PI单染分析法,用流式细胞仪测定细胞周期以反映细胞凋亡情况。收集各处理组细胞,均匀打散,PBS冲洗3次后于70%乙醇中 4℃固定 18 h,洗去乙醇,加入 RNase(50mg/ml)消化并用 PI(100mg/ml)染色 30 min,用流式细胞仪检测细胞亚二倍体凋亡峰,根据此亚二倍体峰计算凋亡细胞的百分率。
1.2.6 Caspase-3/7,caspase-6活性分析 具体操作根据Promega试剂盒说明书,即将细胞均匀接种于96孔板中,给予不同处理后,各孔加入与培养基等体积的 caspase-3/7,caspase-6发光底物(分别为 ZDEVD-R110,Z-VEID-氨基荧光素),轻轻摇匀 30 s,室温孵育3 h后于多功能分辨荧光仪上测量荧光值(relative light units,RLU)。
1.2.7 统计学处理 各组资料以均数±标准差(±s)表示,并用Sigma Sata软件包处理,采用单因素方差分析(Ono-way ANOVA)和 Student-Newman-Keuls(SNK)进行显著性检验。
2 结果
2.1 菊米提取液对体内HeLa细胞成瘤体积的影响
各组荷瘤鼠经不同浓度菊米提取液(0.001~0.01mg/ml)连续灌胃给药 14 d后,与对照组相比,除了0.001 mg/ml药物浓度组外,其余各组荷瘤鼠背部皮下移植瘤体积均有缩小,瘤体抑制率呈剂量依赖性增长(P<0.05,表 1)。
Tab.1 Effectof Jumiextraction on inhibition rate of tumor volume inmice(±s,n=10)

Tab.1 Effectof Jumiextraction on inhibition rate of tumor volume inmice(±s,n=10)
*P<0.05,**P<0.01 vs control group
(mg/ml)Tumor volume(cm3)Inhibition rate of tumor volume(%)Group 94.16±3.97 Control — 1.7934±0.2885 —0.001 1.5226±0.4116 15.90±4.23 0.002 0.7286±0.4791* 56.46±9.20 Drug 0.005 0.2955±0.1429** 82.97±9.70 0.010 0.1031±0.0103**
2.2 菊米提取液对HeLa细胞增殖的影响
含不同浓度菊米提取液(0.001~0.01 mg/ml)的完全培养基培养48 h后,与对照组相比,菊米提取液对HeLa细胞的增殖抑制率逐渐上升,IC50(半数抑制浓度)为 0.004 mg/ml,且与其质量浓度呈正相关(r=0.9554),0.01 mg/ml时对 HeLa细胞增殖的抑制作用最大,达到(67.53±1.15)%(P<0.05,表 2)。
Tab.2 Effect of Jumi extraction on inhibition rate of cell viability(±s,n=4)
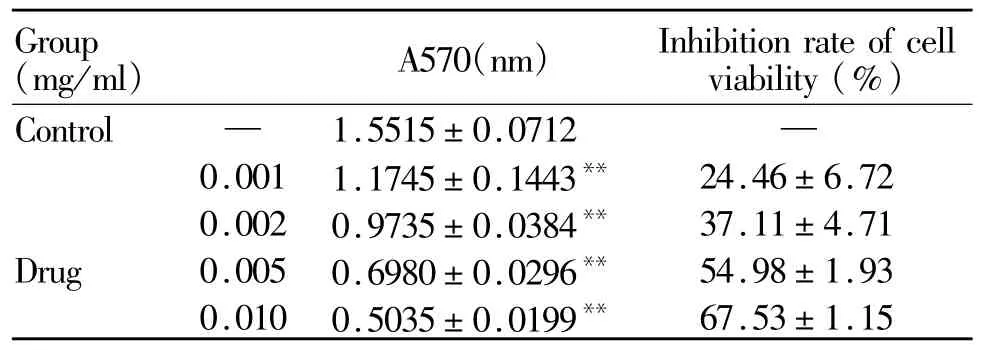
Tab.2 Effect of Jumi extraction on inhibition rate of cell viability(±s,n=4)
*P<0.05,**P<0.01 vs control group
(mg/ml) A570(nm) Inhibition rate of cell viability(%)Group 67.53±1.15 Control — 1.5515±0.0712 —0.001 1.1745±0.1443** 24.46±6.72 0.002 0.9735±0.0384** 37.11±4.71 Drug 0.005 0.6980±0.0296** 54.98±1.93 0.010 0.5035±0.0199**
2.3 菊米提取液对HeLa细胞凋亡的影响
HeLa细胞与含有菊米提取液(0.001~0.01 mg/ml)的完全培养基或不含提取液的完全培养基共同培养48 h后,收集全部培养细胞经流式细胞术检测。不含提取液对照组细胞凋亡发生率为(2.00±0.03)%,含菊米提取液 0.001、0.002、0.005、0.01 mg/ml的药物组细胞凋亡率分别为 (6.33±1.90)%、(9.73±1.32)%、(12.80±0.80)%、(31.00±4.01)%。与对照组相比,四个浓度药物组细胞凋亡率均显著提高,且呈现一定的剂量依赖性(P<0.05,图 1)。
2.4 菊米提取液对caspase-3/7、caspase-6酶活性的影响
HeLa细胞与含有菊米提取液(0.001~0.01 mg/ml)的完全培养基或不含提取液的完全培养基共同培养48 h后,与对照组相比,除0.001 mg/ml浓度药物组,其余三个浓度药物组的caspase-3/7、caspase-6酶活性均有显著增加,且呈现一定的剂量依赖性(P<0.05,P<0.01,图 2、图 3)。
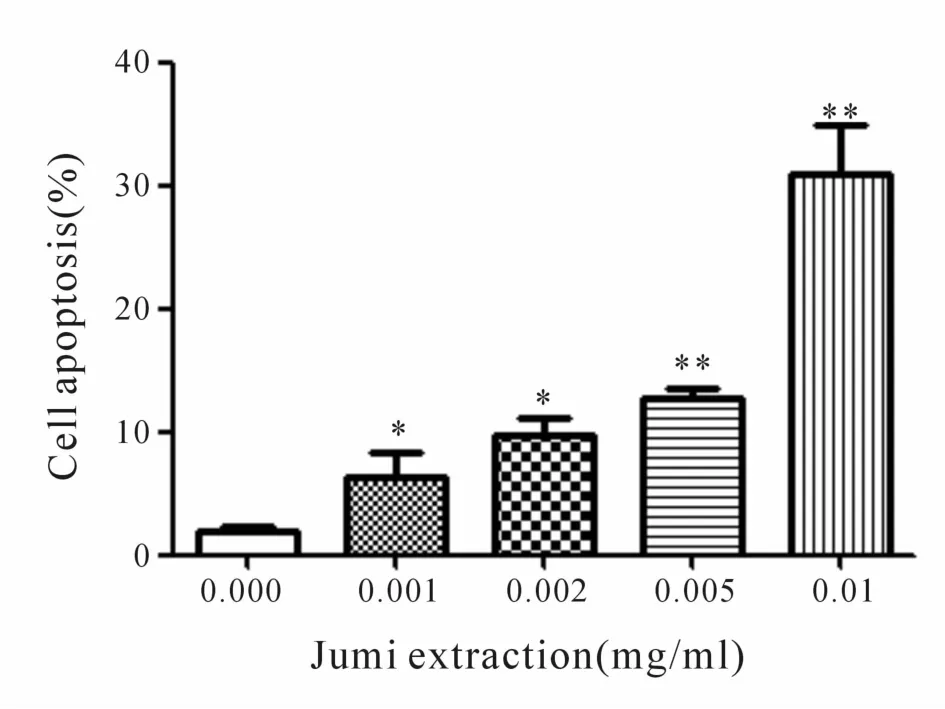
Fig.1 Effectof Jumiextraction on cell apoptosis(±s,n=3)

Fig.2 Effectof Jumiextraction on caspase-3/7 enzyme activity(±s,n=3)
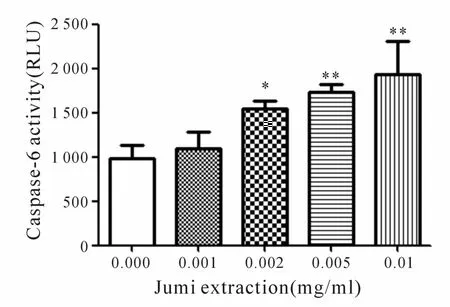
Fig.3 Effectof Jumiextraction on caspase-6 enzyme activity(±s,n=3)
3 讨论
我国宫颈癌的发病率及死亡率均列女性恶性生殖系统肿瘤的第二位,且其发病年龄呈年轻化趋势。由于宫颈癌对于化疗不敏感,故现有的治疗手段以手术和放疗为主,但对于肿瘤细胞已扩散的中晚期患者,手术和放疗的效果均不理想。因此,具有选择性高、作用强、毒副作用小等优点的新型抗肿瘤药物的研发已成为宫颈癌研究的重要任务之一。中药因其安全性较高及副作用少等特点,被用于癌症患者尤其是中晚期患者的治疗,可减轻放、化疗的不良反应,提高癌症患者的生活质量,延长生存期。菊米具有多种独特的药理作用,如增强免疫力、清火明目、抗菌消炎平肝、降血压等。菊米提取液含有丰富的黄酮、蛋白质、菊米内酯、野菊花素等营养成分,也含有小白菊内酯、萜类化合物、芹菜素、木犀草素等成分,已被证实具有抑制多种肿瘤细胞增殖和促进其凋亡的作用,但菊米提取液对宫颈癌HeLa细胞的作用及机制尚不明确。本研究一方面通过建立人宫颈癌HeLa细胞裸鼠皮下移植瘤模型,观察菊米提取液对HeLa细胞在裸鼠体内生长的影响;另一方面通过菊米提取液与HeLa细胞共同孵育,观察药物对HeLa细胞增殖和凋亡的影响,并探讨其可能的作用机制。
本研究结果显示,不同质量浓度的菊米提取液(0.001~0.01 mg/ml)在荷瘤鼠体内可明显抑制宫颈癌HeLa细胞的生长。随着菊米提取液剂量的增大,移植瘤体积逐渐减小;与空白对照组比较,除最低浓度药物组外(0.001 mg/ml),差异均有统计学意义(P<0.05,P<0.01);瘤体抑制率则逐渐增大。以上实验结果表明,菊米提取液在裸鼠体内可抑制宫颈癌HeLa细胞的增殖,并呈现剂量依赖性。
本研究采用MTT法测定细胞生存率,结果显示:随着菊米提取液浓度的增大(0.001~0.01mg/ml),间接反映存活细胞数量的吸光度值逐渐减小,与对照组相比,其差异均有统计学意义(P<0.01);细胞增殖抑制率则逐渐增大。以上实验结果表明,菊米提取液在体外与细胞共同孵育可抑制宫颈癌HeLa细胞的增殖,并呈现剂量相关性。
本研究采用流式细胞术检测细胞凋亡,结果显示:随着菊米提取液浓度的增大(0.001~0.01 mg/ml),细胞凋亡率由 6.33%升至 31.00%,各药物组与对照组比较,差异均有统计学意义(P<0.05,P<0.01)。以上实验结果表明,菊米提取液在体外与细胞共同孵育可促进宫颈癌HeLa细胞的凋亡,并呈现剂量相关性。
本研究采用比色法测定 caspase-3/7酶和 caspase-6酶活性,结果显示:随着菊米提取液浓度的增大(0.001~0.01mg/ml),caspase-3/7酶活性升高,各药物组 caspase-3/7酶活性分别为对照组的 1.33、1.87、2.09、2.95倍;caspase-6酶活性亦逐步升高,各药物组 caspase-6酶活性分别为对照组的 1.10、1.57、1.76、1.96倍。分别与对照组比较,除最低浓度药物组(0.001mg/ml)外,差异均有统计学意义(P<0.05,P<0.01)。以上实验结果进一步证实,菊米提取液可通过诱导细胞凋亡而抑制宫颈癌HeLa细胞的生长。
细胞凋亡是在基因调控下的一个严密完整的程序过程,它是细胞自主性死亡过程[5]。肿瘤细胞凋亡调节紊乱引起的细胞增殖与死亡的平衡失调,是导致人类多种恶性肿瘤发生发展的重要因素之一。细胞凋亡的主要途径有两条,一是通过胞外信号激活细胞内的凋亡酶caspase,二是通过线粒体释放凋亡酶激活因子激活caspase。Caspase家族在凋亡过程中起到关键性的作用,其可分为两类,一类为启动者如caspase-8、9,接受刺激后能通过自剪接而激活,然后引起 caspase级联反应;另一类为执行者 caspase-3,可直接降解胞内的结构蛋白和功能蛋白,引起凋亡。Caspase-3、caspase-7与 caspase-6是主要的处于细胞凋亡下游的凋亡效应分子。Caspase-3被称为“死亡蛋白酶”,是细胞凋亡的生物学标志,其活化及活性受到多种因素的调节[6]。Caspase-7与 caspase-3在诱导肿瘤细胞凋亡的过程存在正相关,但在细胞凋亡级联反应中caspase-7与caspase-3的相互关系并未明确[7]。Caspase-6参与细胞凋亡的执行并可降低凋亡信号诱导细胞死亡的阈值,其与caspase-3有38%同源性,二者是不同凋亡途径共同的下游路径。Caspase-3蛋白早于caspase-6蛋白的激活,并可促使caspase-6蛋白活化,活化的 caspase-6蛋白又能进一步活化caspase-3蛋白,形成对caspase-3蛋白活化的正性循环,但二者的具体调控机制及相互关系并不十分清楚[8]。结合本研究caspase-3/7酶和caspase-6酶活性结果,提示caspase-3/7基因和caspase-6蛋白基因的蛋白翻译水平同样可能是菊米提取液的作用位点,菊米提取液可能通过增加caspase-3/7、caspase-6蛋白表达、活化而促进细胞凋亡。
目前关于菊米提取液抗宫颈癌机制的相关研究还不多。本研究显示,菊米提取液能抑制宫颈癌细胞系HeLa增殖,诱导其凋亡,这是菊米提取液发挥抗肿瘤作用的机制之一,但是否还存在其他作用途径,有待进一步研究。
【参考文献】
[1] 陈秀玮,王丹云,刘 佳,等.白桦脂酸对HeLa细胞的抑制作用及其机制研究[J].中国癌症杂志,2012,22(4):252-256.
[2] 陈海丽,韩凤娟,宫艳秋,等.中国复方儿黄散对宫颈癌HeLa细胞增殖抑制及Bcl-2蛋白表达的影响[J].现代肿瘤医学,2010,18(11):2102-2104.
[3] 陈如洲.白花蛇舌草对鼠宫颈癌细胞抑制作用研究[J].海峡药学,2012,24(5):23-25.
[4] 司马军,陈 健,刘丹丹,等.菊米提取液对人结肠癌SW620细胞增殖和凋亡的影响[J].中国中西医结合外科杂志,2012,2(18):39-42.
[5] Foster SS,De S,Johnson L K,etal.Cell cycle-and DNA repair pathway-specific effects of apoptosis on tumor suppression[J].ProcNatlAcadSciUSA,2012,109(25):9953-9958.
[6] AleM T,Maruyama H,TamauchiH,etal.Fucose-containing sulfated polysaccharides from brown seaweeds inhibit proliferation ofmelanoma cells and induce apoptosis by activation of caspase-3 in vitro[J].MarDrugs,2011,9(12):2605-2621.
[7] Bressenot A,Marchal S,Bezdetnaya L,etal.Assessmentof apoptosis by immunohistochemistry to active caspase-3,active caspase-7,or cleaved PARP inmonolayer cells and spheroid and subcutaneous xenografts of human carcinoma[J].JHistochemCytochem,2009,57(4):289-300.
[8] Waldron-Roby E,Ratovitski T,Wang X,etal.Transgenic mouse model expressing the caspase 6 fragment of mutant huntingtin[J].JNeurosci,2012,32(1):183-193.
