内皮祖细胞条件培养基对VSMCs增殖、迁移及粘附功能的影响*
2013-03-19吴海燕楚海荣唐可欣孙金隆尹青令
吴海燕,楚海荣,李 宏,唐可欣,靖 旭,孙金隆,尹青令,成 敏△
(1.潍坊医学院麻醉学系,2.潍坊医学院医学研究实验中心,山东潍坊261053)
血管平滑肌细胞(vascular smooth muscle cells,VSMCs)增殖是动脉粥样硬化(atherosclerosis,AS)斑块形成和发展的关键病理环节。增殖的VSMCs由血管中层向内膜的迁移,导致内膜中VSMCs的大量积聚和结缔组织的形成,进而促进新生内膜形成和AS。通常情况下,体内VSMCs处于静息态,不会过度增生及向内膜迁移。但当内皮损伤和功能障碍时,可致使中膜VSMCs的功能及结构发生改变,导致新内膜的形成,而内皮细胞再生能够阻止由VSMCs增生带来的损害[1]。文献证实除成熟内皮细胞外,EPCs对维持内皮结构和功能的完整性具有重要作用。大量研究表明,EPCs参与受损内皮的修复不仅仅通过分化为内皮细胞整合入受损处,还可通过旁分泌的方式释放一些血管活性物质,包括前列环素(prostaglandin I2,PGI2)、一氧化氮(nitric oxide,NO)、血管生长因子(包括 VEGF,SDF-1,OGF-1,HGF)等[2,3]。为此,本研究观察 EPC-CM对 VSMCs增殖、粘附及迁移的影响,以期进一步阐明EPCs对心血管系统的保护作用,完善动脉粥样硬化等血管性疾病的发病机制,为EPCs移植治疗心血管系统疾病提供依据。
1 材料与方法
1.1 实验动物与试剂
雄性SD大鼠,体重200 g左右(山东省潍坊医学院实验动物中心);VEGF及 bFGF(peprotech);M199、胎牛血清和胰蛋白酶(Hyclone);Histopaque-1083(Sigma);纤维连接蛋白(Roche);Dil-LDL、FITCUEA(Molecular Probe),FITC-CD133、vWF-FITC及CD31-PE(BD);Cell Counting Kit试剂盒(碧云天生物技术研究所);Boyden小室(江苏海门麒麟仪器厂)。
1.2 EPCs分离培养和鉴定
1.2.1 EPCs分离培养 健康雄性SD大鼠,断颈处死,75%酒精浸泡10min后,无菌PBS冲洗长骨骨髓腔。Histopaque-1083密度梯度离心法分离单个核细胞,按105cells/cm2密度接种于预先包被有纤维连接蛋白的培养瓶中,使用15%胎牛血清的M199完全培养基培养,4 d后更换培养基。
1.2.2 EPCs的鉴定 贴壁细胞在37℃含Dil-LDL培养基中孵育4 h,然后用4%多聚甲醛固定细胞30 min。再将FITC-UEA加于上述标本,37℃孵育1 h。激光共聚焦显微镜下观察,红色和绿色双染色细胞为EPCs。流式细胞术(fluorescence-activated cell sorting,FACS)检测 CD133,vWF及 CD31的表达。
1.3 VSMCs分离培养和鉴定
无菌分离大鼠胸主动脉,纵向剖开,去除动脉外膜和内皮,将动脉中层剪成1mm×1mm小块,按每平方厘米3~5块的密度种植于玻璃培养瓶。粘有植块的瓶底朝上,放置6 h后,翻转培养瓶,使植块慢慢浸入培养基中。4~7 d,植块周围即可长出细胞,待细胞融合成片,常规消化传代。3~5代VSMCs用于实验。VSMCs鉴定采用α平滑肌肌动蛋白(α-SMA)染色阳性,以及形态学典型的“峰和谷”样生长状态判定。
1.4 EPCs条件培养基(EPCs-CM)的制备
传代后的EPCs在底面积为25 cm2培养瓶中生长融合后,再继续培养3 d,用 PBS(pH 7.4)洗 3次,换成无血清M199培养基4ml,24 h后收集培养基,1 500 r/min离心 5 min,取上清液即为 EPC-CM。EPC-CM经0.22μm滤膜过滤,贮存于-80℃冰箱中,备用。实验中以无血清的M199培养基为对照组。
1.5 CCK-8试剂盒检测VSMCs增殖
取处于对数生长期的VSMCs,按2×105cells/ml密度接种至12孔板。待细胞融合至80%左右时,用2%胎牛M199同步化12 h,然后以无血清M199或EPC-CM继续培养24 h后,用胰蛋白酶消化收集贴壁细胞,接种细胞悬液100μl(约5 000-10 000个细胞)于96孔板内,每组种5个复孔。待细胞融合80%左右,弃去各孔培养基,加入CCK-8试剂和培养基的混合液(按1∶10比例),在培养箱内孵育30~60 min,利用酶标仪测定各孔在450 nm波长的吸光度。
1.6 VSMCs粘附功能的观察
VSMCs经上述方法处理后,按 2×105cells/ml密度接种至包被有人纤维连接蛋白的24孔培养板中,37℃下培养30 min,PBS洗涤去除未贴壁细胞,显微镜下随机选取9个视野(×200),计数贴壁细胞,取其平均数。
1.7 改良Boyden小室检测VSMCs迁移能力
按上述方法收集贴壁细胞并计数。将200μl培养液加入改良的Boyden小室的下室,50μl VSMCs(2×104)悬浮液注入上室,置于37℃、5%CO2和饱和湿度的培养箱内。8 h后,刮去滤膜上面的未移动细胞,PBS洗涤3次,4%多聚甲醛固定,DAPI染色,显微镜下随机选取5个视野(×200),计数迁移细胞,取其平均数。
1.8 统计学分析
所有实验均重复3~4次。采用SPSS 13.0进行统计分析,实验数据以均值±标准差(±s)表示。组间差异采用单因素方差分析,两两比较采用LSD-t检验。
2 结果
2.1 EPCs培养和鉴定
刚分离的单个核细胞大多呈悬浮生长,培养4 d后,贴壁细胞数量增多且呈梭形,培养7 d的细胞有集落样结构出现,培养21 d的细胞呈明显铺路石样外观(图1A-C)。Dil-ac-LDL和 FITC-UEA-1染色呈双阳性表现(图1D-F),FACS结果显示:干细胞标志物CD133阳性细胞率较低,而内皮细胞标志物vWF及CD31阳性细胞率较高(图1G,图1见彩图页Ⅱ)。
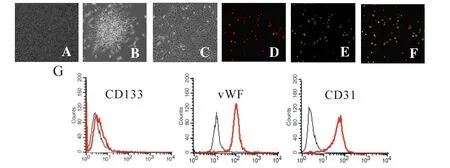
Fig. 1 Characterization of EPCs derived from rat bone marrow(A-F ×100)
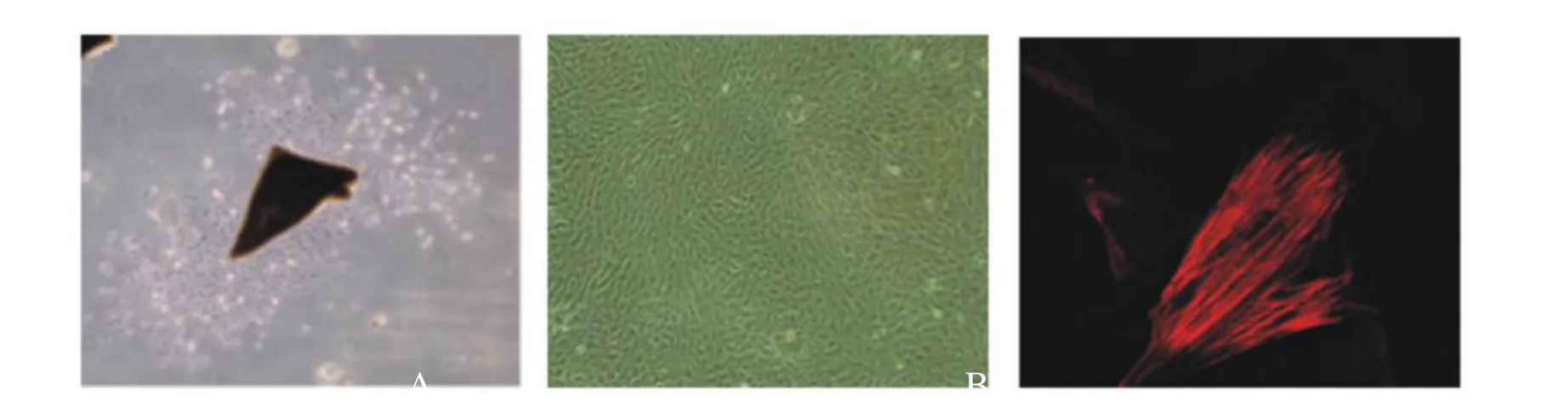
Fig. 2 VSMCs morphology and identification(A and B ×100,C ×400)
2.2 VSMCs培养和鉴定
培养4~7 d,细胞以垂直方向从组织块边缘游离出,向外生长形成细胞晕,进而形成细胞簇。细胞形态呈现多形性,如长梭形、三角形或不规则形,折光性强,有长短不一的胞突(图2A)。细胞密度高时呈典型的“峰-谷”生长(图2B)。免疫荧光的鉴定结果显示,培养的VSMCs表达平滑肌细胞特异性α-SMA(图2C,图2见彩图页Ⅱ)。
2.3 EPC-CM对VSMCs增殖的影响
CCK-8试剂盒检测结果显示:EPC-CM处理组与无血清M199培养基(对照组)比较,其OD值显著降低(P<0.01,图 3),提示 EPC-CM抑制了 VSMCs的增殖。
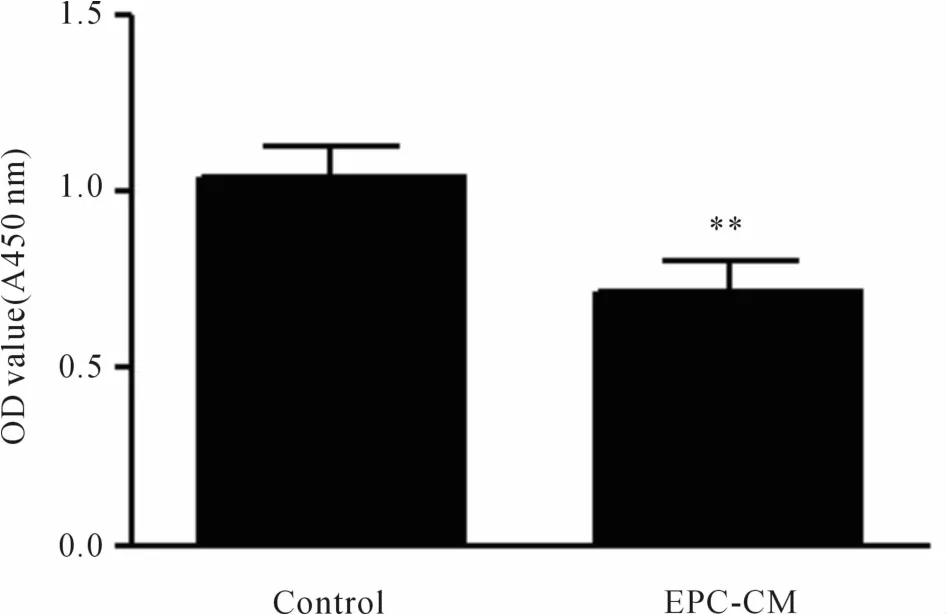
Fig.3 EPC-CM decreased VSMC proliferation(±s,n=5)
2.4 EPC-CM对VSMCs粘附的影响
粘附实验检测发现,与无血清M199培养基培养的VSMCs相比,EPC-CM处理抑制了VSMCs的粘附(P<0.01,图 4)。
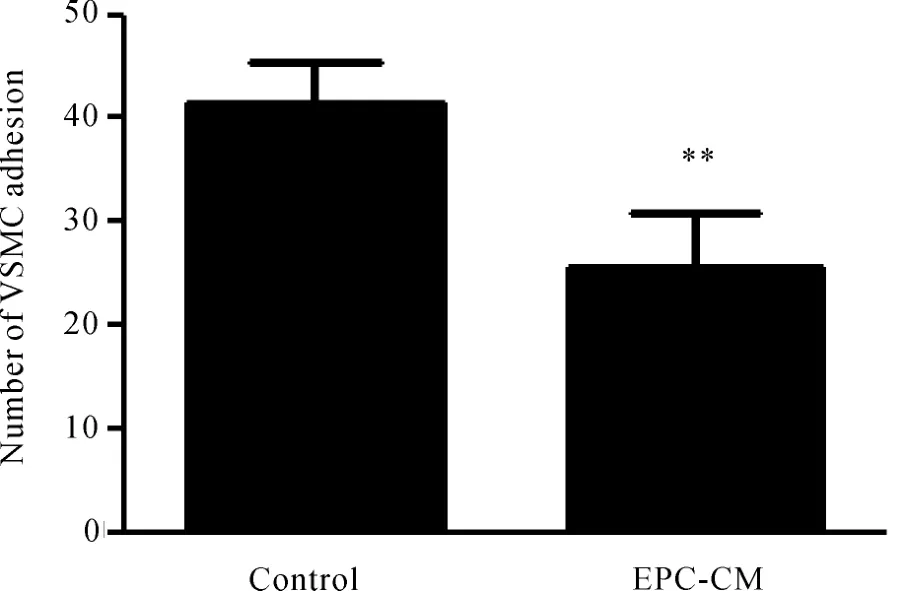
Fig.4 EPC-CM inhibited VSMC adhesion(±s,n=9)
2.5 EPC-CM对VSMCs迁移的影响
Boyden小室检测显示:与对照组相比,EPC-CM条件培养基显著抑制VSMCs迁移,差异具有统计学意义(P<0.01,图 5见彩图页Ⅱ)。
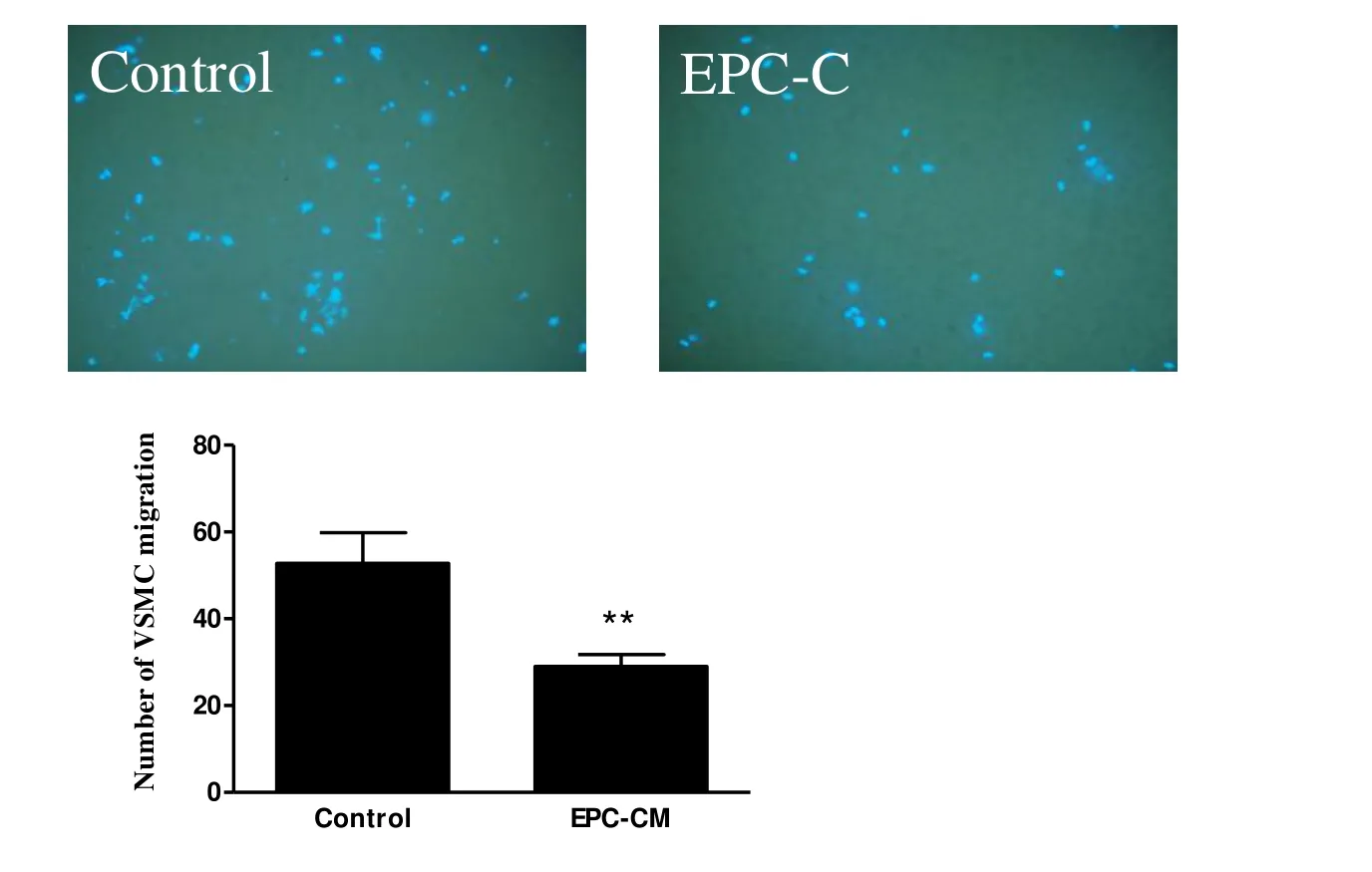
Fig. 5 EPC-CM impaired VSMC migration(x ± s,n=5)
3 讨论
AS所致的心、脑血管疾病是当今严重危害人类生命健康的疾病之一,其发病率和死亡率均居各种疾病之首。研究表明,血管内皮功能障碍是其始动因素,当血管损伤后,中膜的VSMCs发生表型转化,由收缩型转化为合成型,相对稳定的VSMCs进行增殖,随之大量VSMCs迁移至内膜,导致血管受损处大量VSMCs的粘附,血管壁变厚,弹性降低,促进了动脉粥样硬化和新生内膜的形成[4]。
内皮细胞损伤势必诱发机体一系列反应,对其进行修复,以实现受损内皮的重新内皮化。传统观点认为损伤周边的内皮细胞可通过迁移、增殖来修复内皮缺损。但成熟内皮细胞是终末分化细胞,其增殖潜能有限,修复能力并不理想[5]。EPCs是一类能增殖并分化为血管内皮细胞的前体细胞,出生后EPCs主要存在于骨髓,缺血及血管内皮损伤等因素可以促进EPCs由骨髓动员到外周血中,迁移并粘附到损伤处[6]。实验证实 EPCs移植在冠心病、高血压、血管成形术后再狭窄等血管性疾病中发挥了积极的治疗作用,表现为降低血管损伤后血管内膜增殖、预防支架植入术后支架内血栓形成和再狭窄等[7],提示:EPCs可能抑制 VSMCs的病理性增殖及功能。方立等[8]实验表明EPCs与VSMCs共培养可抑制后者增殖。然而EPCs如何参与调控VSMCs功能尚不清楚。最近研究[9]证实:EPCs的许多生物学功能主要是通过其旁分泌实现的。而检测其旁分泌作用对细胞的影响,最简单的方法就是使用“条件培养基”,就是将一种细胞(细胞A)的条件培养基(含该细胞分泌物或代谢产物)作用于另一种细胞(细胞B),观察其对细胞 B相关功能的影响[10]。本实验中,我们采用 EPC-CM培养 VSMCs,结果显示 EPCCM作用VSMCs 24 h以后,VSMCs的增殖、迁移和粘附能力均受到抑制。
理论上讲,条件培养基对细胞功能起负调节还是正调节作用,是由条件培养基中刺激活性物质和抑制活性物质之间的平衡决定。在本实验条件下,EPC-CM中抑制活性可能占优势,因此表现为对VSMCs功能的负性调控作用,这与生理状态下体内VSMCs处于静止和非增殖状态相符合。然而EPCCM影响VSMCs相关功能的确切机制,EPCs分泌的何种生物活性物质在其中发挥主导作用,以及是通过哪些途径来发挥作用有待于进一步研究,将有助于我们进一步揭示AS的发病机制,并为经皮冠状动脉成形术(PTCA)术后再狭窄的治疗提供新的思路。
【参考文献】
[1] Wu X J,Xia Z Y,Wang L L,etal.Effects of penehyclidine hydrochloride on pulmonary contusion from blunt chest trauma in rats[J].Injury,2012,43(2):232-236.
[2] SegalM S,Shah R,Afzal A,etal.Nitric oxide cytoskeletal-induced alterations reverse the endothelial progenitor cell migratory defect associated with diabetes[J].Diabetes,2006,55(1):102-109.
[3] Yang Z,Tao J,Wang JM,etal.Shear stress contributes to t-PA mRNA expression in human endothelial progenitor cells and nonthrombogenic potential of small diameter artificial vessels[J].BiochemBiophysResCommun,2006,342(2):577-584.
[4] 韩 英.血管平滑肌细胞迁移的调控机制[J].高血压杂志,2003,11(2):7-10.
[5] Fernández Jiménez P,Solera Santos J.Pharmacological strategies in prevention of vascular injury[J].RevClinEsp,2005,205(8):395-397.
[6] Hristov M,ErlW,Weber PC.Endothelial progenitor cells:mobilization,differentiation,and homing[J].Arterioscler ThrombVascBiol,2003,23(7):1185-1189.
[7] 崔 斌,黄 岚,武晓静,等.内皮祖细胞移植对血管内膜修复的影响[J].中国病理生理杂志,2007,23(4):625-628.
[8] 方 立,陈美芳,余国龙,等.内皮祖细胞对血管平滑肌细胞增殖的影响[J].中南大学学报(医学版),2010,35(1):52-62.
[9] Fang L,Chen M F,Xiao Z L,etal.The effectof endothelial progenitor cells on angiotensin II-induced proliferation of cultured rat vascular smooth muscle cells[J].JCardiovasc Pharmacol,2011,58(6):617-625.
[10]李 乐,高晓利,丁宝兴,等.青藤碱对培养VSMC MAPK、PKC活性和细胞[Ca~(2+)]i的影响[J].中国应用生理学杂志,2009,25(2):154-155.
