低温低氧复合应激对大鼠肺微血管内皮细胞的损伤作用研究*
2013-03-19张竞丹杨丹凤曹燕卿安玉林刘嘉瀛
张竞丹,杨丹凤,曹燕卿,李 曦,安玉林,刘嘉瀛,汪 海
(1.中南大学公共卫生学院,湖南长沙410078;2.军事医学科学院卫生学环境医学研究所,天津300050)
高原肺水肿(high altitude pulmonary edema,HAPE)是高原病中最具有代表性的一型,比较常见且发病急骤,病死率较高。关于诱发高原肺水肿的机制尚不完全清楚,较为肯定的有血液动力学改变、体液潴留和循环障碍等[1]。一般认为机体缺氧引起肺小动脉收缩而产生的肺动脉高压和血管内皮细胞损伤是高原肺水肿发生的基本原因[2]。而寒冷对高原肺水肿发生的影响的研究甚少。本文采用2×2析因设计[3],通过观察低温和低氧对大鼠肺微血管内皮细胞(pulmonary microvascular endothelial cells,PMVECs)在细胞膜通透性和血管活性物质变化方面的影响,以及二者之间的协同作用,以探讨低温和低氧两个因素在高原肺水肿发生中所起的作用。
1 材料与方法
1.1 主要试剂及仪器
主要试剂:高糖DMEM培养基、胰蛋白酶、I型胶原酶(美国Gibco公司);胎牛血清(美国 Hyclone公司);内皮细胞生长添加剂 ECGS(Upstate公司);肝素(Amresco公司);中性蛋白酶、DMSO、MTT、明胶(美国SIGMA公司);内皮细胞鉴定试剂盒(武汉原生代生物医药科技有限公司);TRIZOL、PCR引物(美国 Invitrogen公司);PCR相关试剂(天根生化科技有限公司);LDH、SOD、MDA、NO检测试剂盒(南京建成生物工程研究所)。
主要仪器设备:三气培养箱(美国 Thermo公司),显微摄像系统(成都仪器厂),电子天平、酶标仪(瑞士 Tecan公司),PCR仪(美国 Biorad公司)。
1.2 PMVECs的培养、传代及鉴定
参照相关文献[4],选用体重 100~130 g的健康雄性Wistar大鼠,颈椎脱臼法处死后,迅速打开胸腔,左心耳剪一小口,从右心室注入 15~25 ml DMEM培养基,至肺脏发白,然后将肺取出,0.25%胰蛋白酶37℃消化5min后,pH为7.0的PBS溶液冲洗2遍,剪取2~3mm的边缘肺组织并剪成1 mm×1 mm×1 mm的小块,加入2 ml I型胶原酶(2.5 mg/ml)37℃消化 15 min。然后用滴管吸出胶原酶,加入 2 ml中性蛋白酶(10 mg/ml)37℃消化 15 min。待组织块消化完全后加入5 ml培养基终止消化,2 000 r/min离心 10 min,弃上清。用 3 ml胎牛血清重悬沉淀并吹打使内皮细胞聚集,1 000 r/min离心5min,取沉淀细胞加入含有20%血清的DMEM培养基中培养。3 d后换液,以后隔天换液,待细胞生长至单层即可传代。
弃去细胞培养液,pH为7.0的 PBS溶液洗2遍,加入0.25%胰酶1 ml,显微镜下观察,待细胞间隙逐渐增大,细胞变圆钝后立即加入1 ml含10%胎牛血清的DMEM培养基中止消化,用吸管将细胞轻轻吹落并充分混匀,细胞悬液移入离心管中,1 000 r/min离心10min。弃上清,以1∶2分装接种进行传代。
采用FITC标记的CD31绿色荧光及植物凝集素结合实验进行鉴定。
1.3 实验分组
选取2~7代生长良好的PMVECs用于实验,用无血清培养基进行细胞同步化2 h,根据2×2析因设计进行实验,按低温和低氧两因素的有无,分为四组:正常对照组(37℃、21%O2)、低温组(28℃、21%O2)、低氧组(37℃、3%O2)、低温低氧组(28℃、3%O2)。所有实验组分别在不同条件的培养箱中培养24 h。
1.4 培养液中LDH活力的测定
取2~7代生长良好的PMVECs以1×106cells/ml接种至六孔板中,每组设3个复孔。不同条件下分别培养24 h后,收集各孔细胞培养上清液,按照LDH检测试剂盒说明书立即检测。
1.5 硝酸还原酶法检测NO
取2~7代生长良好的PMVECs以2×105cells/well接种至24孔板,每组设6个复孔,80%融合后,换无血清培养基,四个条件下培养24 h。收集各孔细胞培养上清液,用NO试剂盒(硝酸还原酶法)检测 NO2-/NO3-的水平。
1.6 RT-PCR法检测VEGF、ET-1mRNA表达水平
取2~7代生长良好的PMVECs以1×106cells/ml接种至六孔板中,每组六孔。每2个孔提取一个mRNA样本。总RNA的提取严格按Trizol试剂说明书操作,紫外分光光度计测定其纯度并定量。采用降落 PCR法:(1)94℃ 5min;(2)94℃ 30 s,61℃ 40 s,每次下降0.2℃直至55℃,72℃延伸50 s,共30个循环;(3)72℃ 10min。PCR产物在2%琼脂糖(TAE缓冲液)凝胶中进行电泳。用凝胶成像系统检验各条带的积分吸光度值,以VEGF、ET-1与β-actin灰度的比值作为RT-PCR的半定量结果。引物设计如下:VEGF上游引物 5’-CAGGGAAGACAATGGGATGA-3’,下游引物 5’-AGGAAGTGGGGTAGGGAGAG-3’,扩增基因片段长度为 470 bp;ET-1上游引物5’-CTGCCACCTGGACATCATCT-3’,下 游 引 物 5’-GCTCGGAGTTCTTTGTCTGC-3’,扩增基因片段长度为198 bp;β-actin上游引物 5’-CAGGTCATCACTATCGGCAA-3’,下游引物5’-AAGAAAGGGTGTAAAACGCA-3’,扩增基因片段长度为430 bp。以上引物均由Invitrogen公司合成。
1.7 统计分析
实验数据以均数 ±标准差(±s)表示,利用SPSS 20.0软件进行分析和处理,对测得的数据进行完全随机设计的方差分析和t检验。
2 结果
2.1 大鼠PMVECs形态学观察及鉴定
培养4 h后更换培养液时可见内皮细胞团块聚集贴壁(图1-A),3 d后内皮细胞团块已经扩增成内皮细胞岛(图1-B)。生长至5~7 d时细胞可基本融合成片,铺满培养皿底。细胞在倒置显微镜下,呈典型的内皮细胞形态,以多角形和短梭形为主,铺路石样镶嵌状排列生长(图1-C)。第3代细胞进行FITC标记的CD31免疫荧光鉴定(图1-D),绿色荧光即为内皮细胞,显示纯度几乎为100%;植物凝集素(BSI)结合实验(图1-E),呈明亮的绿色荧光,表示所培养的细胞确实为PMVECs(图1见彩图页Ⅰ)。

Fig. 1 Rat pulmonary microvascular endothelial cell cultures
2.2 不同因素对PMVECs的LDH活性的影响
低温组、低温低氧组(Complex)的LDH活性与对照组相比均上升,且在统计学上具有显著差异(P<0.01);与低温组、低氧组相比,低温低氧组的 LDH活性升高的更明显,且具有显著地统计学差异(P<0.01)。析因方差分析结果显示,低温和低氧对PMVECs细胞的 LDH活性都有影响(P<0.01),而且两者之间存在协同作用(P<0.01,表1)。
2.3 不同因素对PMVECs的NO释放量的影响
低温组、低氧组、低温低氧组的NO释放量与对照组相比均有所下降,且在统计学上具有显著差异(P<0.01)。析因方差分析结果显示,低温和低氧对PMVECs细胞的NO的释放量都有影响(P<0.01),而且两因素之间存在协同作用(P<0.05,表1)。
Tab.1 LDH leakage and releasing of NO2-/NO3-from PMVECs under the four conditions(±s,n=3)

Tab.1 LDH leakage and releasing of NO2-/NO3-from PMVECs under the four conditions(±s,n=3)
LDH:Lactate dehydrogenase;PMVEC:Pulmonary microvascular endothelial cell**P<0.01 vs control group; ##P<0.01 vs hypothermia group;△△P<0.01 vs hypoxia group
Group LDH viability(U/ml) Releasing of NO2-/NO3-(μmol/L )Control 12.49±2.24 1.237±0.035 Hypothermia 26.42±0.78** 0.653±0.020**Hypoxia 14.10±2.87 0.654±0.040**Complex 48.37±4.42**##△△ 0.292±0.040**##△△
2.4 不同因素对 PMVECs的 VEGF、ET-1 mRNA表达的影响
2.4.1 不同因素对PMVECs的VEGFmRNA表达的影响 可见低温组、低氧组、低温低氧组的VEGF mRNA表达与对照组相比上调,且差异具有统计学意义(P<0.01)。低温组与低温低氧组之间亦有着差异,并有统计学意义(P<0.01)。
2.4.2 不同因素对 PMVECs的 ET-1 mRNA表达的影响 可见低温组、低氧组、低温低氧组的 ET-1 mRNA表达与对照组相比上调,低温低氧组与对照组之间的差异具有统计学意义(P<0.01),而低温组和低氧组与对照组之间没有显著的统计学差异。方差分析结果显示,低温和低氧都会使PMVECs细胞的ET-1mRNA表达上调(P<0.01),而且低温和低氧之间具有协同作用(P<0.01,图 3)。
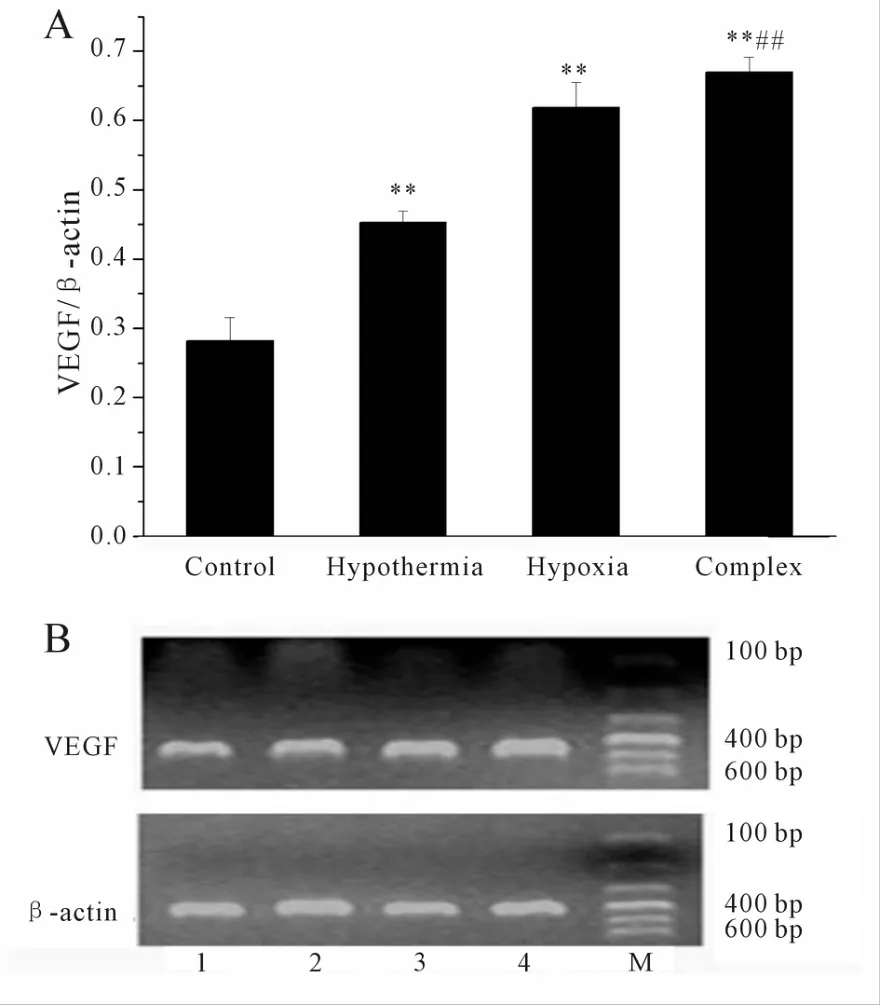
Fig.2 Effectsof hypothermia,hypoxia and hypothermia combined with hypoxia on expression of VEGFmRNA in PMVECs(±s,n=3)

Fig.3 Effectsof hypothermia,hypoxia and hypothermia combined with hypoxia on expression of ET-1 mRNA in PMVECs(±s,n=3)
3 讨论
随着西部大开发和旅游业的发展,进入高原地区人员也越来越多,而高原地区的低温低氧的恶劣环境对人体的健康构成了很大的威胁,因此各种高原病也越来越受到重视。在高原病中高原肺水肿是比较具有代表性的一型,高原肺水肿是从低海拔地区快速进入高海拔地区后发生的一种非心源性肺水肿,如不及时救治,很有可能危及生命[5]。多年来科研人员对高原肺水肿的发病机制做了大量的研究,取得了长足进展和很多成果,但仍有一些不明之处。目前认为血管通透性增加是高原肺水肿发病过程中的关键环节,大量水分进入肺泡而来不及重吸收导致肺水肿的发生。以往研究的重点偏向于低氧对高原肺水肿发生的影响,但在环境如此复杂的高原,低温低氧复合因素的存在是不可忽视的。当机体急进高原环境的时候,首先呼吸加深加快,肺通气、潮气量和每分通气量瞬时增加,可较安静时增大上千倍,将有大量低温低氧气体进入呼吸道。由此,我们推想在急进高原时发生的高原肺水肿是否由于呼气量的增加,导致肺微血管内皮细胞瞬间感受大量低温低氧气体的伤害性刺激,从而导致血管内皮损伤及其功能改变,进而诱发了高原肺水肿?因此,本实验通过研究低温低氧对PMVEC的损伤作用并分析其交互作用,以进一步探讨两因素在高原肺水肿发生中的作用。
血管内皮细胞是血管内壁覆盖的一层上皮细胞,是循环血液与血管平滑肌间的机械屏障,对维持血管内壁完整性、调节血管通透性、防止凝血和血栓形成等有重要作用。其中,血管内皮细胞分泌的血管活性物质NO、ET-1、VEGF在维持血管张力和内皮细胞功能方面有重要作用。以往,研究人员倾向于选择大血管内皮细胞模拟进行心脑血管与其他器官血管疾病机制的研究,但随着近年来各个器官微血管内皮细胞培养方法的成功建立,选择疾病发生所在部位的微血管内皮细胞能够更好的模拟发病过程。肺微血管内皮细胞结构和功能的完整性对于维持正常肺功能至关重要,在病理条件下,肺微血管内皮细胞是炎症反应的主要靶细胞。因此,本实验采用复合酶消化法原代培养的大鼠肺微血管内皮细胞(PMVEC)来进行低温、低氧以及低温低氧复合因素对其影响的研究,以探讨高原肺水肿发生过程中低温和低氧所起的作用。
首先,我们以乳酸脱氢酶(LDH)作为判断细胞损伤的指标,LDH是一种广泛存在于细胞浆中的糖酵解酶,当细胞膜受到损伤时,LDH从细胞中释放到细胞外的量会增加,因此测定培养液中的LDH含量可客观的衡量细胞的受损程度[6]。本次实验结果显示,低温、低氧以及低温低氧复合因素都会使细胞培养液中的LDH活性升高,且与低温、低氧组相比,低温低氧复合应激组的LDH活性升高的更明显。而析因方差分析结果显示低温和低氧在对细胞释放LDH的影响上有协同作用。说明低温和低氧在对细胞损伤作用上均有影响,而低温低氧复合在一起造成的影响更严重。
血管内皮细胞的功能是通过其分泌的一系列血管活性物质实现的,如一氧化氮(NO)和内皮素(ET)参与调节血管张力。NO是在血管内皮细胞一氧化氮合酶的作用下合成,有内皮细胞释放的血管活性物质,具有较强的血管舒张作用[7]。ET是具有强大收缩作用的血管活性肽,分为三个亚型:ET-1、ET-2和ET-3,其中ET-1尤为重要,是目前已知的收缩血管作用最强的细胞因子。在生理状态下,内源性激动剂刺激内皮细胞释放的NO和ET-1相互作用,处于动态平衡而共同维持正常的血管张力,一旦这种平衡被打破,内皮细胞功能就会出现障碍,表现为NO的减少或活性降低,而ET-1的释放增加。这与本研究的结果相符,在低温、低氧、低温低氧复合条件下,PMVEC细胞释放的NO大幅度减少而ET-1的mRNA表达则增加,并且低温和低氧存在协同作用,低温低氧复合因素作用于PMVEC细胞比单一因素作用更强。说明在低温低氧条件的作用下,PMVEC细胞的功能受损,可能导致血管张力调节失常,血管收缩作用增强。
血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)是一种特异性作用于血管内皮细胞的糖蛋白,在促进内皮细胞增殖和增加血管通透性方面起着关键作用[8]。有研究表明,在低氧条件下VEGFmRNA的表达上调[9],VEGF再通过其他的多种途径改变血管内皮细胞间紧密连接蛋白的重新分布,导致毛细血管的通透性增加,可能是高原肺水肿发生的重要因素之一。另外有研究结果显示,急性缺氧大鼠肺组织中的VEGF水平明显的升高[10]。但关于低温对体外细胞或组织中VEGF表达的影响尚无报道。本研究的结果显示,在低温、低氧和低温低氧复合条件下,PMVEC细胞VEGFmRNA的表达均上调,并且低温和低氧存在协同作用。VEGF的异常升高使得血管的通透性增加,大量血浆蛋白漏出,机体超负荷就会诱发肺水肿的发生。
综上所述,本研究显示,低温和低氧两个环境因素对PMVEC细胞均会产生损害作用,无论是在内皮细胞功能还是细胞通透性方面,并且两因素的共同作用下比单一因素对PMVEC细胞的损害作用更大,即低温和低氧在对PMVEC细胞损伤作用上存在协同作用。PMVEC细胞功能受损是高原肺水肿发生的关键因素之一。因此,我们有理由相信进入高原地区时的低温低氧复合的环境因素是造成高原肺水肿发生的重要原因,在防治方面除了及时吸氧外还要注意防寒保暖措施的有利实施。
【参考文献】
[1] 赵贵锋,葛德元.高原肺水肿研究进展[J].心血管病学进展,2008,29(5):757-760.
[2] 杨生岳,郭振援,冯恩志,等.血清缺氧诱导因子-1α和血管内皮生长因子水平与高原肺水肿患者肺动脉压的关系[J].临床肺科杂志,2011,16(9):1325-1327.
[3] 胡良平.统计学三型理论在试验设计中的应用[M].北京:人民军医出版社,2006:94.
[4] 梁志欣,徐淑凤,王 平,等.大鼠肺微血管内皮细胞分离培养方法的研究[J].国际呼吸杂志,2011,31(18):1376-1380.
[5] Densmore JC,Signorino PR,Ou JS,etal.Endotheliumderived microparticles induce endothelial dysfunction and acute lung injury[J].Shock,2006,26(5):464-471.
[6] Danz E D,Skramsted J,Henry N,etal.Resveratrol prevents doxorubicin cardiotoxicity through mitochondrial stabilization and the Sirt1 pathway[J].FreeRadicalBiolMed,2009,46(12):1589-1597.
[7] Mam V,Tanbe A F,Vitali SH,etal.Impaired vasoconstriction and nitric oxide-mediated relaxation in pulmonary arteries of hypoxia-and monocrotaline-induced pulmonary hypertensive rats[J].JPhamacolExpTher,2010,332(2):455-462.
[8] Hanaoka M,Droma Y,Naramoto A,etal.Vascular endothelial growth factor in patientswith high-altitude pulmonary edema[J].JApplPhysiol,2003,94(5):1836-1840.
[9] Jin H L,Liu M L,Kim H A,etal.Role of the oxygen-dependent degradation domain in a hypoxia-inducible gene expression system in vascular endothelial growth factor gene therapy[J].Spine,2009,34(26):E952-958.
[10] Christou H,Yoshida A,Arthur V,etal.Increased vascular endothelial factor production in the lungs of ratswith hypoxiainduced pulmonary hypertension[J].AmJRespirCellMol Biol,1998,18(6):768-770.
