疏血通注射液对局灶性脑梗死大鼠缺血周围区细胞凋亡和TLR4表达的影响
2013-03-04钟艺华李光勤唐显军
钟艺华,李光勤,唐显军
(1.重庆市肿瘤研究所神经内科 400031;2.重庆医科大学附属第一医院神经内科 400016)
近年来研究表明,Toll样受体4(toll like receptor 4,TLR4)作为中枢神经系统固有免疫反应的模式识别受体,在脑缺血损伤亚急性期,不但能调节促炎症介质的产生,还能通过诱导细胞凋亡维持神经损伤与保护之间的平衡[1]。疏血通注射液具有抗凝、促纤溶、细胞保护的多重作用,能多环节、多途径、多靶点发挥抗脑缺血损伤作用。本研究通过观察疏血通注射液对大鼠脑缺血损伤后细胞凋亡及TLR4表达的影响,探讨其可能的神经保护机制。
1 材料和方法
1.1 动物分组 健康成年雄性SD大鼠56只,体质量230~280g(由重庆医科大学动物中心提供)。用抽签法将动物分为3组:假手术组(n=8)、模型组(n=24)、疏血通注射液(SXT)治疗组(n=24);再根据缺血时间(即线栓法阻断血管至取材的时间)随机分为12、24、48h及72h共4个亚组。
1.2 药品与试剂 疏血通注射液(牡丹江友博药业有限公司,批号为1206199);细胞凋亡检测试剂盒、兔抗大鼠TLR4单克隆抗体(北京博奥森生物技术有限公司);逆转录聚合酶链反应(RT-PCR)试剂盒(Takara公司);SABC免疫组化试剂盒(武汉博士德生物技术公司);DAB显色试剂盒(北京中杉生物技术公司)。
1.3 动物模型制备与给药 参照Longa等[2]的插线方法,采用线栓法制备大鼠右侧大脑中动脉闭塞(MCAO)模型,假手术组操作步骤同模型组,但线栓只插入距离CCA分叉5mm处的ICA内。在大鼠麻醉苏醒后,采用Longa等[2]的5分制评分标准进行评分,评分为1~3分的大鼠纳入实验。SXT治疗组在造模成功后按照0.7mL/kg剂量对大鼠进行腹腔注射,12h和24h亚组:每天1次,持续1d;48h亚组:每天1次,持续2d;72h亚组:每天1次,持续3d;假手术组和模型组在相同时间点则给予等量生理盐水替代。
1.4 标本制备 每个亚组中一半大鼠在各观察时间点用3.5%水合氯醛(1mL/100g)进行深度麻醉,经左室灌注生理盐水200 mL和4%多聚甲醛溶液(PFA)200mL进行内固定,断头取视交叉前后各2mm的脑组织进行石蜡包埋后作连续冠状切片。每个脑组织共取片3套,分别进行HE染色、TUNEL和TLR4免疫组化染色。另一半大鼠则断头取脑,分离缺血周围区残存的大脑皮质,提取RNA进行RT-PCR检测。
1.5 指标检测
1.5.1 HE染色 标本切片常规脱蜡、水化、HE染色、封片、光镜下观察。
1.5.2 凋亡细胞表达检测 标本切片常规脱蜡、水化,按照TUNEL试剂盒提供的实验步骤进行操作,DAB显色,光镜下观察到TUNEL阳性细胞表现为:细胞体积缩小,包膜发泡,核内染色质浓聚,细胞核内可见棕黄色的TUNEL反应产物。用图像信号采集分析系统分别测量计数各亚组缺血周围区阳性细胞高表达的部位中5个互不重叠视野(10×20倍)下的阳性细胞数,将所得平均值作为统计资料。
1.5.3 TLR4蛋白表达检测 标本切片常规脱蜡、水化,按照SABC免疫组化试剂盒提供的实验步骤进行操作,DAB显色,光镜下观察到细胞质或细胞膜上中出现粗细不等的棕黄色颗粒为阳性细胞。用图像信号采集分析系统分别测量计数各亚组中缺血周围区皮层阳性细胞高表达部位中互不重叠的3个视野(10×40倍)下的阳性细胞数,将所得平均值作为统计资料。
1.5.4 TLR4mRNA表达检测 按照Trizol试剂盒说明书提取缺血脑组织中的总RNA,用紫外分光光度计检测RNA浓度。用反转录试剂盒将RNA逆转录为cDNA第一链:37℃孵育15min,85℃5s终止反应,灭活反转录酶。TLR4引物序列上游为5′-TAA ATG CCA ACT GGA ACA-3′,下游为5′-TCT GCT AAG AAG GCG ATA-3′(862bp)。内参采用GAPDH,上游为5′-GTG GAG TCT ACT GGC GTC TT-3′,下游为5′-ATC ATA CTT GGC AGG TTT CT-3′(483bp)。反应条件:94℃预变性3min,进入循环94℃变性30s,57℃退火30s,72℃延伸30s,共进行35次循环,最后72℃延伸5 min。PCR产物在琼脂糖凝胶上进行电泳,运用Quantity-one凝胶自动成像仪成像,以看家基因GAPDH为内对照进行质控和标化,测定TLR4/GAPDH的灰度比值作为TLR4mRNA的相对表达量。
1.6 统计学处理 应用SPSS18.0统计软件进行统计学分析,正态分布数据采用±s表示,组间差异采用单因素方差分析,即F检验;其中两两比较采用LSD检验。P<0.05为差异有统计学意义。
2 结 果
2.1 HE染色结果 假手术组未见缺血梗死灶,皮层神经细胞排列整齐,层次分明,包膜完整,核仁清楚,无核固缩、核碎裂及核溶解,神经间质无水肿(图1A)。模型组可见白色梗死灶,表现为组织结构疏松,间质水肿,呈海绵状,有炎性细胞浸润,神经细胞结构模糊,胞体缩小,胞核固缩,碎裂及溶解,胞质尼氏小体减少或消失(图1B)。SXT治疗组可见缺血坏死区范围明显缩小,皮层神经细胞结构清楚,胞体肿胀、核固缩、核碎裂及核溶解现象较模型组明显减轻(图1C)。
2.2 凋亡细胞表达结果 在假手术组中可见零星散在分布的凋亡细胞;模型组中可见大量凋亡细胞,以缺血灶边缘区内侧及皮层分布最明显,呈簇状分布,在缺血24h表达达到峰值后随着缺血时间的延长,表达开始下降,但在各缺血时间点较假手术组仍维持高水平表达(P<0.01)。SXT治疗组中细胞凋亡表达情况与模型组基本一致,在缺血24h达到峰值后,在各对应时间点TUNEL阳性细胞表达均较模型组低,二者比较差异有统计学意义(P<0.05)。并且,随着治疗时间的延长,SXT治疗组中TUNEL阳性细胞表达呈进行性下降,与前一时间点比较差异有统计学意义(P<0.05),见表1。
2.3 TLR4蛋白表达结果 假手术组中可见少量TLR4阳性细胞表达(图2A);在模型组中,TLR4蛋白在缺血12h表达逐渐增加,24h时达到高峰,颜色加深(P<0.01)(图2B);随着缺血时间延长,其表达逐渐下降,但与假手术组比较仍维持高位表达。SXT治疗组在缺血24h后TLR4蛋白表达均较模型组下调,二者比较差异有统计学意义(P<0.05)(图2C);随着治疗时间延长,与前一时间点比较,其表达呈下降趋势(P<0.05),见表2。
表1 各组大鼠不同缺血时间点凋亡细胞表达情况比较(±s)
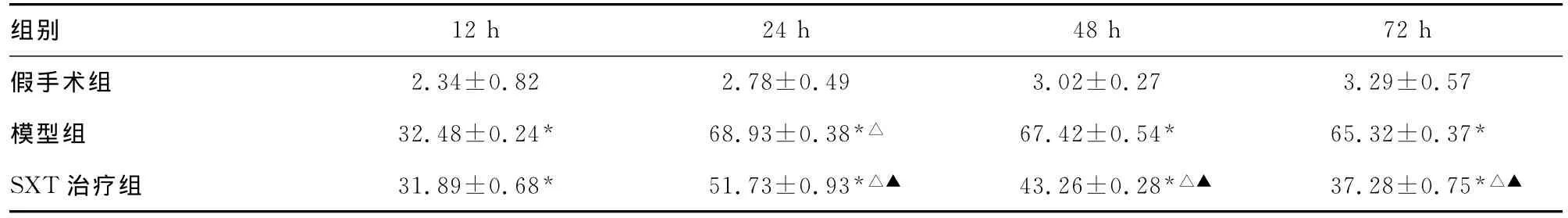
表1 各组大鼠不同缺血时间点凋亡细胞表达情况比较(±s)
*:P<0.01,与假手术组比较;△:P<0.05,与前一时间点比较;▲:P<0.05,与模型组比较。
组别2.34±0.82 2.78±0.49 3.02±0.27 3.29±0.57模型组 32.48±0.24* 68.93±0.38*△ 67.42±0.54* 65.32±0.37*SXT治疗组 31.89±0.68* 51.73±0.93*△▲ 43.26±0.28*△▲ 37.28±0.75 12h 24h 48h 72h假手术组*△▲
表2 各组大鼠不同缺血时间点TLR4蛋白表达情况比较(±s)

表2 各组大鼠不同缺血时间点TLR4蛋白表达情况比较(±s)
*:P<0.01,与假手术组比较;△:P<0.05,与前一时间点比较;▲:P<0.05,与模型组比较。
组别1.05±0.24 1.32±0.39 1.83±0.13 1.89±0.18模型组 3.32±0.87 28.32±0.49*△ 22.72±0.36*△ 18.53±0.24*△SXT治疗组 3.02±0.42 21.07±0.29*△▲ 16.72±0.38*△▲ 15.32±0.75 12h 24h 48h 72h假手术组*△▲
表3 各组大鼠不同缺血时间点TLR4mRNA表达情况比较(±s)
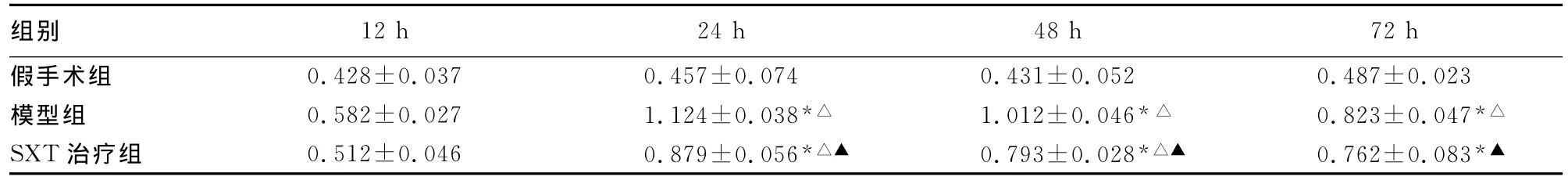
表3 各组大鼠不同缺血时间点TLR4mRNA表达情况比较(±s)
*:P<0.01,与假手术组比较;△:P<0.05,与前一时间点比较;▲:P<0.05,与模型组比较。
组别0.023模型组 0.582±0.027 1.124±0.038*△ 1.012±0.046*△ 0.823±0.047*△SXT治疗组 0.512±0.046 0.879±0.056*△▲ 0.793±0.028*△▲ 0.762±0.083 12h 24h 48h 72h假手术组 0.428±0.037 0.457±0.074 0.431±0.052 0.487±*▲
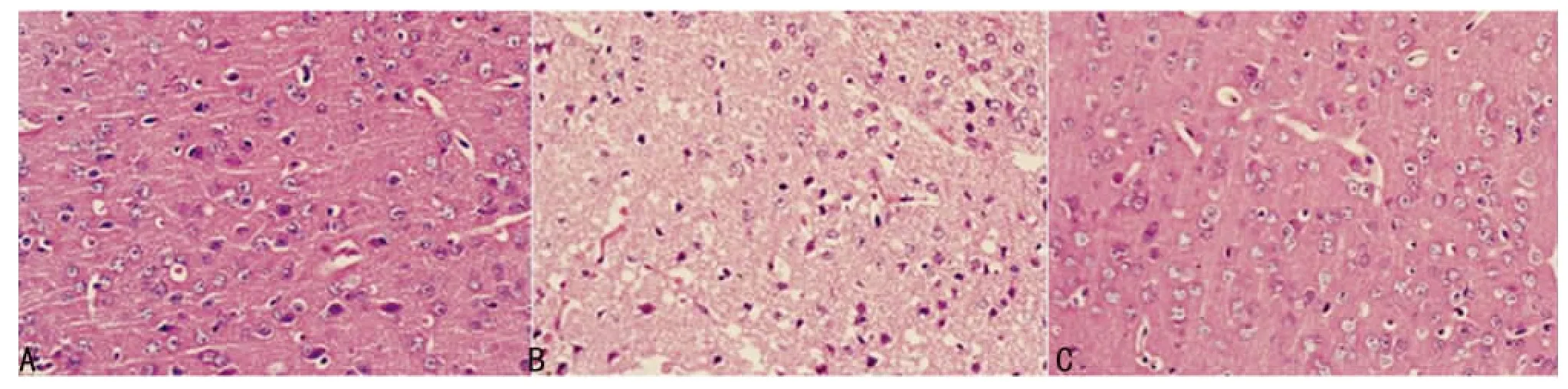
图1 各组HE染色情况
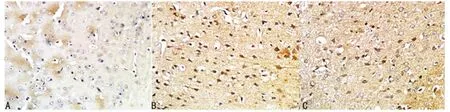
图2 各组第24小时缺血周围区大脑皮层TLR4蛋白表达(ABC×400)
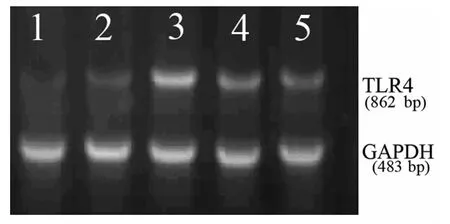
图3 各缺血时间点模型组大鼠TLR4mRNA表达
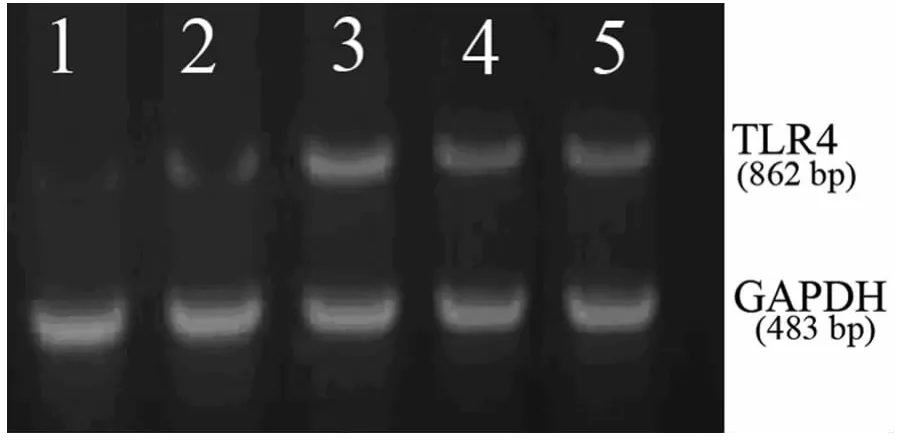
图4 各缺血时间点SXT治疗组大鼠TLR4mRNA表达
2.4 TLR4mRNA表达结果 在模型组中,TLR4mRNA在缺血12h后表达逐渐增强,24h达到峰值,48~72h表达有所下降,与假手术组比较仍维持高水平表达(P<0.01),见图3。在SXT治疗组中,TLR4mRNA表达规律与模型组一致,在缺血24h后TLR4mRNA表达在各缺血时间点均较模型组低,二者比较差异有统计学意义(P<0.05),见表3、图4。
3 讨 论
脑缺血损伤是一个复杂的病理生理过程,可分为3个阶段:急性期兴奋毒性产生和血脑屏障破坏;亚急性期免疫炎症反应和神经细胞凋亡;慢性期神经修复和再生。近年来研究表明,在亚急性期阶段(缺血后数小时至数天),促炎症介质的产生和释放作为介导细胞凋亡的主要因素之一,能加重缺血半暗带区神经细胞的损伤[3-4]。TLRs作为固有免疫反应关键的模式识别受体(pattern recognition receptor,PRR)之一,在诱导炎症反应和炎症介质产生中扮演着重要角色[5]。其中,TLR4主要表达在小胶质细胞,在神经元及星形胶质细胞中也有表达[6]。当脑缺血损伤释放大量内源性激活物,TLR4能通过识别相应的配体诱导MyD88依赖和TRIF依赖的两个信号通路触发一系列级联免疫炎症反应,引起相关细胞因子和炎症因子的表达,最终导致炎症反应失控[7]。本实验研究发现:TLR4基因水平和蛋白表达规律一致,模型组在缺血12h表达逐渐增强,24h达到峰值后逐渐回落,48~72h较假手术组仍然维持高位表达,其表达规律与国内外研究结果相符[8-9],提示TLR4作为炎性损伤因子与缺血后脑损伤有关。TUNEL检测结果显示:模型组在缺血12h时阳性细胞表达明显升高,24h达到高峰后有所减少,至72h仍高于假手术组。上述研究结果显示TLR4表达与细胞凋亡达到高峰的时间基本一致,说明在脑缺血损伤亚急性期,由TLR4介导的炎症信号通路的过度激活,能引起大量与脑损伤密切相关的炎性介质的释放,并且可能通过诱导细胞凋亡加重脑组织损伤。这与Jung等[9]用革兰阴性菌的脂多糖(LPS)作为外源性配体激活TLR4信号通路刺激试管内培养的鼠的小胶质细胞,导致细胞凋亡的结果相符,提示TLR4与细胞凋亡之间可能存在关联。
TLR4作为启动炎症反应的跨膜蛋白受体之一,在非生物性炎症损伤过程中发挥着重要作用。研究证实多种具有明确抗炎疗效的中药能以TLR4为作用靶点,通过抑制相关炎症因子的释放发挥抗炎效应。相关实验研究[8,10]均以 MCAO大鼠为模型,分别采用黄芩苷、木犀草素和氧化苦参碱腹腔注射给药,发现在缺血24h后TLR4表达都出现下调,脑梗死体积缩小和脑水肿减轻,提示中药能通过抑制LPS介导的TLR4炎症信号通路发挥神经保护作用。疏血通注射液是由水蛭和地龙两味动物药材按科学配方提取的复方中药制剂,其有效成分为水蛭中的水蛭素和地龙中的蚓激酶。水蛭素作为凝血酶抑制剂具有强大的抗凝作用,而蚓激酶具有类纤溶酶原激活物(tPA)作用,能发挥很强的溶栓作用。动物实验及临床研究均证明该药抗凝、溶栓作用显著。本研究结果显示:SXT治疗组在缺血24h后,TUNEL阳性细胞、TLR4mRNA和蛋白表达在各时间点均较模型组降低;并且随着治疗时间的延长,TLR4蛋白及TUNEL阳性细胞表达均呈下降趋势,说明疏血通注射液能使TLR4表达下调,抑制神经细胞凋亡,提示疏血通注射液可能通过抑制TLR4信号通路调节促炎症介质的产生和神经细胞的凋亡,这可能是其发挥脑保护作用的机制之一。
综上所述,本研究结果从分子水平证实了脑梗死亚急性期,在缺血周围区存在细胞凋亡和免疫炎症反应能加重脑缺血损伤。疏血通注射液可能通过抑制细胞凋亡和下调启动炎症免疫反应的上游核心因子TLR4的表达发挥神经保护作用,但该药抗脑缺血损伤的具体作用机制还有待进一步研究论证。
[1]Zhang Y,Jin FH,Ren ZP,et al.TLR4signaling transduc-tion and microglia activation after brain ischemia[J].Inter J Path Clin Med,2008,28(4):334-338.
[2]Longa EZ,Weistein PR,Calson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[3]Fagan SC,Hess DC,Hohnadel EJ,et al.Targets for vascular protection after acute ischemic stroke[J].Stroke,2004,35(9):2220-2225.
[4]Iadecola C,Alexander M.Cerebral ischemia and inflammation[J].Curr Opin Neurol,2001,14(1):89-94.
[5]Zwagerman N,Plumlee C,Guthikonda M,et al.Toll-like receptor-4and cytokine cascade in stroke after exercise[J].Neurological Research,2010,32(2):123-126.
[6]胡晓松,宋海星,刘静,等.缺血预处理对局灶性脑缺血大鼠脑梗死周围TLR4及GFAP表达的影响[J].重庆医学,2012,41(29):3076-3079.
[7]Guo J,Friedman SL.Toll-like receptor 4signaling in liver injury and hepatic fibrogenesis[J].Fibrogenesis Tissue Repair,2010,3-21.
[8]Tu XK,Yang WZ,Shi SS,et al.Baicalin inhibits TLR2/4 signaling pathway in rat brain following permanent cerebral ischemia[J].Inflammation,2011,34(5):463-470.
[9]Jung DY,Lee H,Jung BY,et al.TLR4,but not TLR2,signals autoregulatory apoptosis of cultured microglia:a critical role of IFN-beta as a decision maker[J].J Immunol,2005,174(10):6467.
[10]Qiao H,Zhang X,Zhu C,et al.Luteolin downregulates TLR4,TLR5,NF-κB and p-p38MAPK expression,upregulates the p-ERK expression,and protects rat brains against focal ischemia[J].Brain Res,2012,1448(1):71-81.
