热休克蛋白-27与磷脂酰肌醇蛋白聚糖-3在原发性肝癌中的表达及意义*
2013-03-04申东,李莉,高建
申 东,李 莉,高 建
(重庆医科大学附属第二医院消化内科 400010)
原发性肝癌(primary hepatic cancer,PHC)是最常见的恶性肿瘤之一,其恶性程度高,往往发现的时候已属晚期,治疗效果差,故早期诊断对于肝癌患者的预后至关重要。甲胎蛋白(AFP)目前是应用最广的肝癌标志物,在肝癌的诊断、治疗及疗效监测中具有重要的作用。但是在活动性肝病、妊娠、生殖腺胚胎源性肿瘤和少数肾、胰、结肠、直肠癌也可有AFP的增高,显示AFP诊断肝癌的局限性。由于肝细胞癌具有较高的异质性,同时检测两种或以上的肿瘤生物标志物被认为是肿瘤早期诊断的较好选择[1-2]。
热休克蛋白-27(heat shock protein,HSP-27)是小分子热休克蛋白亚家族中重要的一员,参与了细胞的增殖、分化以及细胞凋亡的信号转导调节,与肿瘤关系密切,是一个涉及细胞生长、细胞凋亡、肿瘤的发生和转移等功能的重要蛋白,在乳腺、肝、结肠、肺等多种肿瘤细胞中异常过表达,并与肿瘤的恶性程度有关[3]。磷脂酰肌醇蛋白聚糖-3(glypican-3,GPC-3)在肝癌组织中高表达,而在非肝癌组织及正常组织中没有表达或表达量极低,其表达的阳性率高于AFP,有可能成为用于诊断PHC新的肿瘤标志物[4]。本实验通过免疫组织化学方法检测肝癌、肝硬化、肝炎、良性肝脏占位组织中的HSP-27与GPC-3的表达情况,探讨这二者在肝癌诊断中的临床意义。
1 材料与方法
1.1 材料 32例肝癌组织、30例肝硬化组织、25例良性肝脏占位组织(14例肝囊肿、11例肝血管瘤组织)取自本院肝胆外科,31例慢性肝炎组织标本取自本院消化内科及感染科。其中肝癌组织为术前未经放疗、化疗的原发性肝癌患者的手术切除标本,均取无坏死癌组织和无癌细胞浸润的癌旁组织。肝癌患者中男22例,女10例;年龄39~83岁(≤50岁12例,>50岁20例)。血清乙型肝炎病毒表面抗原(HBsAg)阳性18例,阴性14例:AFP≤400μg/L 18例,>400μg/L 14例,瘤体直径小于或等于5cm 14例,大于5cm 18例。肿瘤组织Edmondson-Steiner分级:Ⅰ级6例,Ⅱ级14例,Ⅲ级2例,Ⅳ级10例。肝癌TNM分期Ⅰ期16例,Ⅱ期2例,Ⅲ期12例,Ⅳ期2例。标本经4%甲醛固定,脱水,常规石蜡包埋。
1.2 试剂 鼠抗人HSP-27单克隆抗体、鼠抗人GPC-3单克隆抗体均购自福州迈新生物技术开发有限公司,ChemMateTM EnVision/HRP兔/鼠通用型二抗购自基因科技(上海有限公司),10mmol/L磷酸盐缓冲液(PBS)、苏木素。
1.3 方法 用病理组织切片机将组织标本石蜡块切成3μm厚切片,再以免疫组织化学染色二步法(SP法)检测HSP-27及GPC-3的表达。免疫组化主要步骤:石蜡切片脱蜡和水化后,高压煮沸修复。切片加50μL过氧化酶溶液,室温下孵育10min。PBS(pH 7.4)冲洗(3×5min下同)。切片加50μL的非免疫性动物血清,室温下孵育10min,吸去多余的液体。切片加50μL的一抗,室温下孵育60min或4℃过夜。PBS冲洗3×5min切片加50μL通用型二抗,室温下孵育10min。PBS冲洗3×5min切片加100μL新鲜配制的DAB溶液,显微镜下观察3~10min。自来水冲洗,苏木素复染,中性树胶封固。
1.4 结果判定 每张切片在400倍显微镜下随机取5个视野,每视野计数100个癌细胞为基数,将着色细胞所占比例的平均数作为评定依据。分为阴性(-),细胞无着色或着色细胞小于5%;弱阳性(+),着色细胞占5%~25%;阳性(++),着色细胞占26%~50%;强阳性(+++),着色细胞超过50%。
1.5 统计学处理 采用SPSS 17.0统计软件进行分析。采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 HSP-27在肝癌、肝硬化、肝炎、良性肝脏占位组织中的表达 HSP-27主要表达在细胞质,少数可见胞膜表达,呈棕黄色。其在肝癌组织中高表达,阳性率56.25%(18/32),而在癌旁组织中未见表达;HSP-27在30例肝硬化组织中的阳性率为20%(6/30),与其在肝癌组织中的表达差异有统计学意义(P<0.05);而在肝炎组织、良性肝脏占位组织中均未见表达,见图1。
2.2 GPC-3在肝癌、肝硬化、肝炎、良性肝脏占位组织中的表达 GPC-3主要表达在胞质中,呈棕褐色。其在肝癌组织中高表达,阳性率87.5%(28/32),在癌旁组织中偶见表达(3/32);GPC-3在肝硬化组织中的阳性率为40%(12/30),与其在肝癌组织中的表达差异有统计学意义(P<0.05);在肝炎组织、良性肝脏占位组织中均未见表达,见图2。
2.3 HSP-27、GPC-3的表达与原发性肝癌临床特征的关系HSP-27在肝癌组织的表达,与肝癌细胞的分化程度及临床分期有关,差异有统计学意义(P<0.05),在Ⅲ~Ⅳ级及Ⅲ~Ⅳ期的肝癌组织中的HSP-27的阳性率分别为100.0%、85.7%,明显高于Ⅰ~Ⅱ级及Ⅰ~Ⅱ期肝癌组织的HSP-27的阳性率;但HSP-27的表达与患者年龄、性别、肿瘤大小、HB-sAg定性和AFP定量无关;GPC-3在肝癌组织的表达则与肿瘤病理分级、临床分期、肿瘤大小、HBsAg定性和AFP定量无关,但在性别、年龄上的差异有统计学意义(P<0.05),见表1。
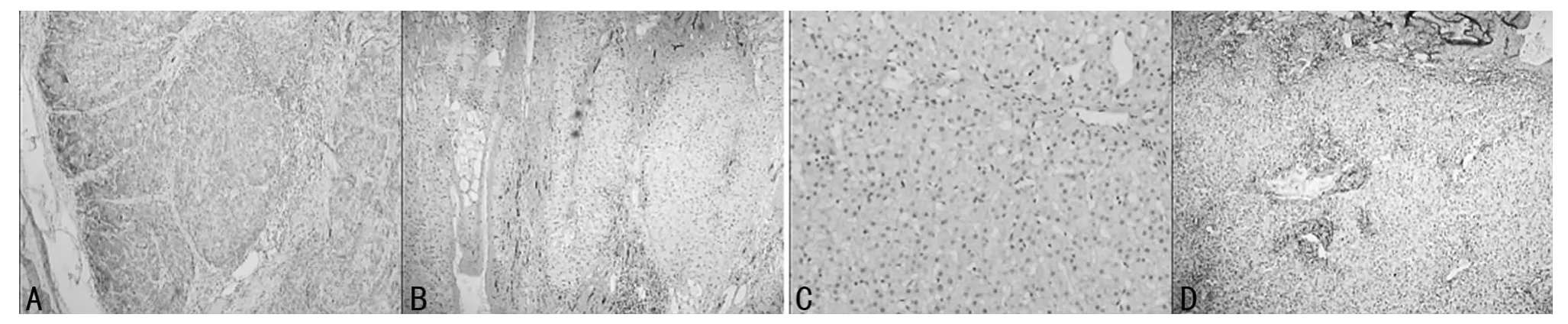
图1 HSP-27在肝癌、肝硬化、肝炎、良性肝脏占位组织中的表达(SP染色 ×40)
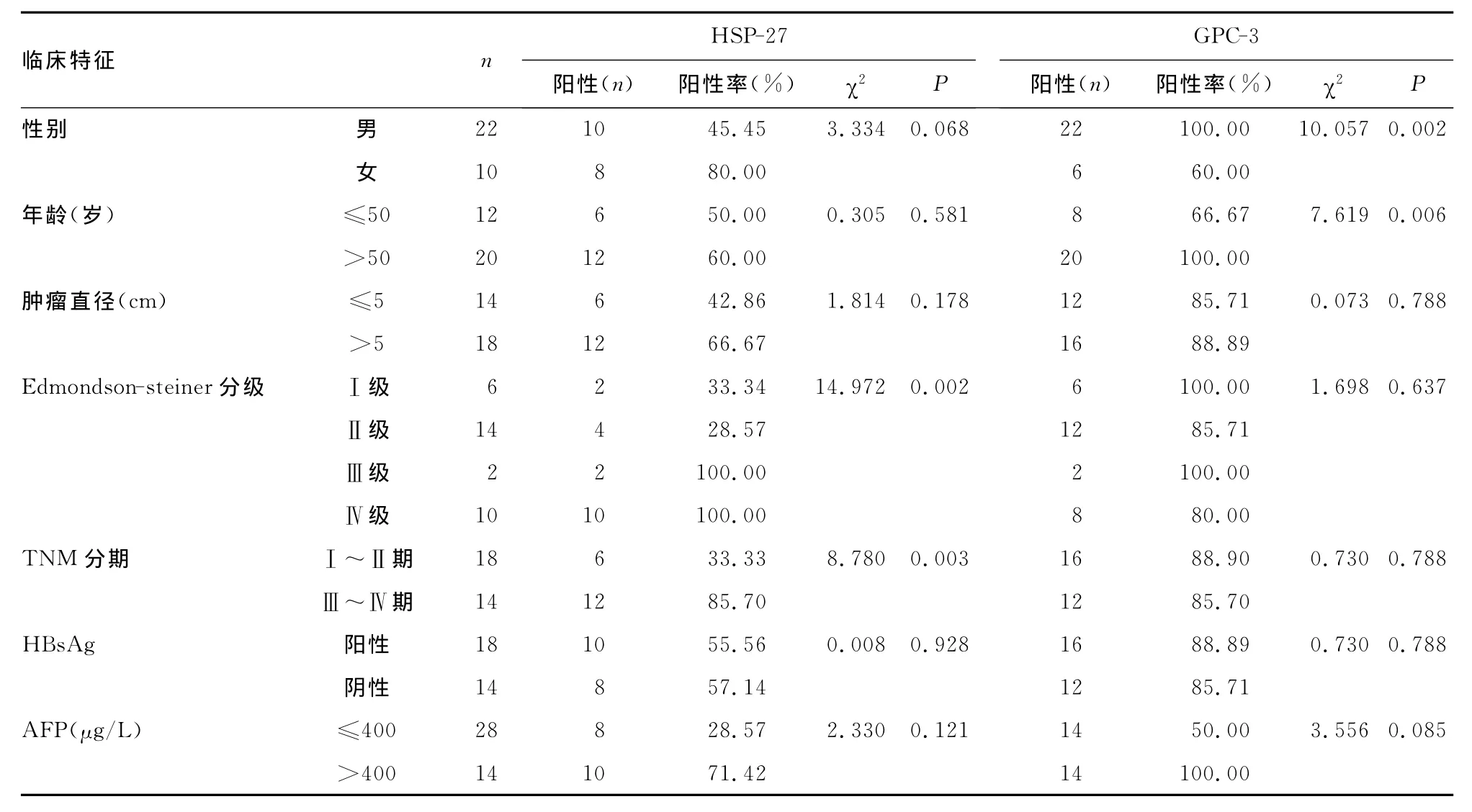
表1 HSP-27、GPC-3的表达与原发性肝癌临床特征的关系
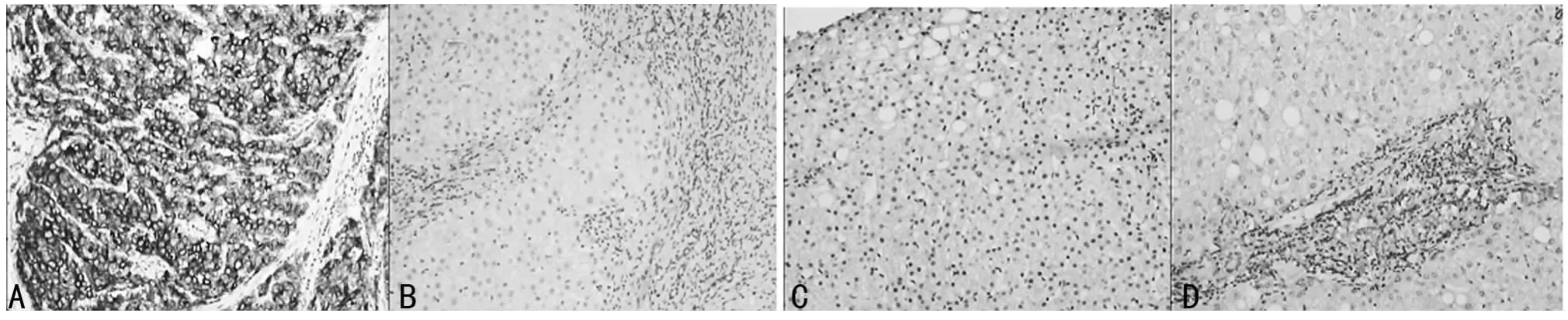
图2 GPC-3在肝癌、癌旁、肝硬化、肝炎、良性肝脏占位组织中的表达(SP染色 ×100)
3 讨 论
HSP-27是功能很强并普遍存在的一种分子伴侣,其重要的生物学功能包括保护细胞免受各种应激因素的损伤、参与细胞增殖分化,在细胞凋亡的多个关键点起作用,在癌细胞中表达水平很高,并参与癌症的发生、发展、转移和化疗抵抗等。HSP-27在一些肿瘤中呈现高表达,包括乳腺癌、神经母细胞瘤、消化道肿瘤等多种恶性肿瘤,并与肿瘤的恶性程度及TNM分期有关[5]。对肝肿瘤组织、健康人及乙型肝炎病毒感染者的血清蛋白质组学研究发现,在恶性程度高、侵袭性强的肝癌组织及肝癌患者血清中HSP-27呈高表达[6]。有研究表明,在对76例PHC患者的单一诊断及平行诊断中,HSP-27单项的敏感性为59.21%,特异性73.13%,阳性预测值是71.43%,当HSP-27与经典标志物AFP相结合检测PHC时诊断的敏感性为78.95%,特异性77.61%,阳性预测值是80.00%[7]。本研究结果提示,HSP-27在32例肝癌中的阳性率明显高于肝硬化,而在肝炎、良性肝脏占位组织中均未见表达,且与癌组织的病理分级及TMN分期有明显相关性,低分化及晚期转移性肝癌HSP-27的阳性率明显偏高,而与肝癌患者的年龄、性别、肿瘤大小、HBsAg定性和AFP定量等因素均无关,这与文献[8]报道的研究结果相一致,作者推测HSP-27蛋白在肝癌的发生、发展及转移中发挥重要作用。
GPC-3是一种参与细胞增殖和胚胎发育的细胞膜糖蛋白,在细胞增殖与分化的发展过程中发挥重要作用,通过结合胞外基质、生长因子和蛋白酶等对细胞生长分化以及肿瘤形成和转移起重要作用[9]。Hsu等[10]报道了在191例 PHC组织中,143例(74.8%)能检测到了GPC-3mRNA,而在156例癌旁“非瘤”肝组织中仅有5例(3.2%)为阳性,该5例均为有门脉或远处转移的病例。GPC-3mRNA及其蛋白在PHC组织中的阳性率通常为70%左右,而在正常肝脏、肝脏良性肿瘤、慢性肝炎和肝硬化等中均呈阴性[11-12]。Capurro等[13]研究表明,在29例HCC组织中,21例GPC-3蛋白表达阳性,而在正常肝组织及良性肝病组织中未检测到GPC-3蛋白,而后用酶联免疫吸附试验(ELISA)法检测血清中GPC-3蛋白,结果发现在34例HCC患者中有18例(53%)GPC-3蛋白浓度明显升高,而在20例肝硬化合并慢性肝炎的患者中仅有1例GPC-3蛋白浓度升高。丁光辉等[14]研究发现,GPC-3mRNA的表达与包膜是否完整、有无癌栓形成、有无肝内转移、性别、年龄及HBsAg均无关。本研究结果显示,GPC-3在肝癌中的阳性率为87.5%明显高于肝硬化组织(阳性率为40%),差异有统计学意义(P<0.05),在肝炎、良性肝脏占位组织中均未见表达,同时GPC-3与肿瘤的病理分级、临床分期、大小、HBsAg定性和AFP定量等无关,与上述研究报道[10-15]相一致,这再次证实了GPC-3与肝癌有着密切的联系,表明GPC-3可作为新的肝癌肿瘤标记物。而GPC-3在患者性别、年龄方面的统计学差异有可能与样本数量较少有关,故进一步的大样本研究是必要的。
综上所述,HSP-27和GPC-3在肝癌组织中高表达,而在肝硬化组织中低表达,在肝炎、良性肝脏占位组织中不表达,表明HSP-27和GPC-3与肝癌的发生、发展和转移有着密切联系,可成为潜在的肝癌诊断标志物,对提高肝癌的检出率以及肝癌预后判断都有重要意义,进一步的研究以明确HSP-27及GPC-3表达调控异常在肝癌发生中的机制,可能为肝癌的靶向治疗开辟新的前景。
[1]Santamaria E,Munoz J,Fernandez-Irigoyen J,et al.Toward the discovery of new biomarkers of hepatocellular carcinoma by proteomics[J].Liver Int,2007,27(2):163-173.
[2]Block TM,Marrero J,Gish RG,et al.The degree of readiness of selected biomarkers for the early detection of hepatocellular carcinoma:notes from a recent workshop[J].Cancer Biomark,2008,4(1):19-33.
[3]Calderwood SK,Khaleque MA,Sawyer DB,et al.Heat shock proteins in cancer:chaperones of tumorigenesis[J].Trends Biochem Sci,2006,3(3):164-172.
[4]杨广顺,杨宁.原发性肝癌近20年的诊治进展和发展趋势[J].中国实用外科杂志,2002,22(1):9-11.
[5]Filomeni G,Aquilano K,Rotilio G,et al.Antiapoptotic response to induced GSH depletion:involvement of heat shock proteins and NF-kappaB activation[J].Antioxid Redox Signal,2005,7(3/4):446-455.
[6]Feng JT,Liu YK,Song HY,et al.Heat-shock protein 27:apotential biomarker for hepatocellular carcinoma identified by serum proteome analysis[J].Proteomics,2005,5(17):4581-4588.
[7]王金龙,胡树珍,潘东晓,等.血清 HSP-27在原发性肝细胞癌早期诊断中的应用[J].解剖学研究,2011,33(3):194-197.
[8]戴凤姣,冯茂辉,谢伟,等.HSP-27在肝癌中的表达及临床意义[J].中国肿瘤临床,2009,36(10):578-581.
[9]周伟,郭霞,曹志刚.血清glypican3检测在原发性肝癌诊断中的临床意[J].肿瘤,2007,27(9):679-682.
[10]Hsu HC,Cheng W,Lai PL.Cloning and expression of a developmentally regulated transcriptMXR7in hepatocellular carcinoma:biological significance and temporospatial distribution[J].Cancer Res,1997,57(22):5179-5184.
[11]Gonzalez AD,Kaya M,Shi W,et al.OCI-5/GPC-3,a glypican encoded by agene that is mutated in the Golabi-Behmel overgrowth syndrome,induces apoptosis in a cell line-specific manner[J].J Cell Biol,1998,141(10):1407-1414.
[12]Sung YK,Hwang SY,Park MK,et al.Glypican-3is overexpressed in human hepatocellular carcinoma[J].Cancer Sci,2003,94(3):259-262.
[13]Capurro M,Wanless IR,Sherman M,et al.Glypican-3:A novel serum and histochemical marker for hepatocellular Carcinoma[J].Gastroenterology,2003,125(1):89-97.
[14]丁光辉,王红阳,陈汉,等.GPC-3mRNA在甲胎蛋白阴性肝癌中的表达及其意义[J].中华实验外科杂志,2001,18(2):112-113.
[15]蔡荣耀,黄志勇,梁宾勇,等.原发性肝细胞癌根治术后肿瘤复发的影响因素及预后[J].中华消化外科杂志,2011,10(4):263-265.
